将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
| A.c(HCN)<c(CN-) | B.c(Na+)>c(CN-) |
| C.c(Na+)>c(HCN) | D.c(HCN)+c(CN-)=0.2mol·L-1 |
更新时间:2020-11-01 15:46:45
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】已知H2CO3和H2SO3的电离常数如下表:
向10mL0.1mol/L Na2CO3溶液中滴加0.1mol/L H2SO3溶液,测得溶液pH随加入H2SO3溶液体积的变化如图所示。
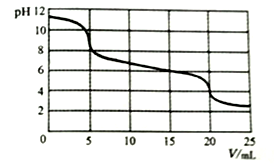
下列说法不正确的是
 电离常数 电离常数酸 | Ka1 | Ka2 |
| H2CO3 | 4.27×10-7 | 5.61×10-11 |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
向10mL0.1mol/L Na2CO3溶液中滴加0.1mol/L H2SO3溶液,测得溶液pH随加入H2SO3溶液体积的变化如图所示。

下列说法不正确的是
| A.加入H2SO3溶液前, Na2CO3溶液中: c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| B.0<V<5时,溶液中反应为: H2SO3+CO32-==HCO3-+HSO3- |
| C.15<V<20时,溶液中反应为:H2SO3+HCO3-==HSO3-+CO2↑+H2O |
| D.V= 15时,所得溶液中: (HCO3-)<c(HSO3-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法正确的是
A. 的溶液一定呈中性 的溶液一定呈中性 |
| B.向水中加入少量Na促进水的电离 |
C.25℃时,水的电离产生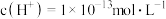 ,溶液一定呈酸性 ,溶液一定呈酸性 |
| D.向醋酸溶液中加水稀释,所有离子浓度都减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】H2C2O4为二元弱酸。20℃时,有一组H2C2O4和NaOH的混合溶液,其中c (H2C2O4) +c (HC2O4)+c (C2O42-)=0.1mol/L,溶液中部分微粒的物质的量浓度随pH 的变化如图所示。[电离度=( 已电离电解质分子数/原弱电解质分子数) x 100%] 下列说法不正确的是


| A.H2C2O4的Ka2数量级为10-5 |
| B.在NaHC2O4溶液中,c (Na+)>c(HC2O4)>c (H+)>c(C2O42-)>c (OH-) |
| C.0.1mol/L 的H2C2O4溶液,H2C2O4的电离度约为80% |
| D.pH=7.0的溶液中,c (Na+)=0.1+c(C2O42-)-c (H2C2O4) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】室温下,H2C2O4的电离平衡常数Ka1= 5.9 ×10 -2,Ka2= 6.4 ×10 -5,用0.100 0 mol•L-1 NaOH溶液滴定20.00 mL 0.100 0 mol•L-1H2C2O 4溶液的曲线如图所示(体积变化忽略不计)。下列说法正确的是

A.滴定过程中,当 pH=4 时,存在:c(H+)+c(Na+ )=c(OH- )+c( )+c( )+c( ) ) |
| B.点①、③、④所示溶液中,点③所示溶液水的电离程度最大 |
C.点③所示溶液:3c( )+2c( )+2c( )+c(H2C2O4)=0.l mol•L-1 )+c(H2C2O4)=0.l mol•L-1 |
D.滴定过程中可能出现:c(Na+)>c( )= c( )= c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】25℃时,向20.0mL0.100mol/LHR溶液中滴加0.100mol/LMOH溶液,混合溶液的pH与加入MOH溶液体积的变化关系如图所示。设NA为阿伏加德罗常数的值。下列说法错误的是
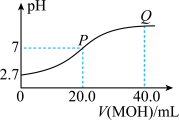

A. 的电离常数的数量级为 的电离常数的数量级为 |
B.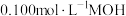 溶液的电离度大于 溶液的电离度大于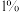 |
C.P点溶液中水电离出的H+数目为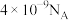 |
D.Q点溶液中存在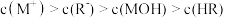 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】每年10月23日上午的6:02到晚上的6:02被誉为“摩尔日”(MoleDay),这个时间的美式写法为6:0210/23,外观与阿伏加德罗常数 相似。通常用
相似。通常用 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 相似。通常用
相似。通常用 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.标准状况下,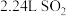 与 与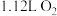 充分反应,生成的 充分反应,生成的 分子数目为 分子数目为 |
B. 石墨烯(单层石墨)中含有六元环的个数为 石墨烯(单层石墨)中含有六元环的个数为 |
C.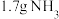 完全溶于 完全溶于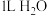 所得溶液中, 所得溶液中, 微粒数目为 微粒数目为 |
D.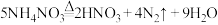 反应中,生成 反应中,生成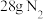 时,转移的电子数目为 时,转移的电子数目为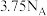 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】H2C2O4为二元弱酸,25℃时,Ka1=5.4×10-2 , Ka2=5.4×10-5。下列说法正确的是( )
A.0.1mol/LNaHC2O4溶液中:c(H2C2O4)>c(C2O ) ) |
B.反应HC2O +OH- +OH-  C2O C2O +H2O的平衡常数K=5.4×1012 +H2O的平衡常数K=5.4×1012 |
C.0.1mol/LNa2C2O4溶液中:c(OH-)=c(H+)+c(HC2O )+2c(H2C2O4) )+2c(H2C2O4) |
D.pH=7的NaHC2O4与Na2C2O4的混合溶液中:c(Na+)=c(HC2O )+c(C2O )+c(C2O ) ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】钾的化合物对调节体内循环有重要用途,一定温度下,下列溶液中的离子浓度关系式正确的是
| A.K2S溶液中:2c(K+)=c(S2-)+c(HS-)+c(H2S) |
B.K2CO3溶液中:c(OH-)=c(H+)+c( )+2c(H2CO3) )+2c(H2CO3) |
C.0.1mol•L-1的KHCO3溶液中:c(K+)+c(H+)=c( )+c( )+c( )+c(OH-) )+c(OH-) |
| D.pH相同的①CH3COOK、②KOH、③KClO三种溶液中的c(K+):③>①>② |
您最近一年使用:0次



