与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。如表是某温度下几种常见弱酸的电离平衡常数:
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO 、H3PO4、H2PO
、H3PO4、H2PO 、HPO
、HPO 都看作是酸,则它们酸性最强的是
都看作是酸,则它们酸性最强的是___________ (填化学式)。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为___________ 。
(3)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是___________ 。
A.c(H+) B.c(H+)•c(CH3COO﹣) C.c(H+)•c(OH﹣) D.
(4)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1___________ V2(填“>”、“<”或“=”)。
(5)下列四种离子结合H+能力最强的是___________ 。
A.HCO B.CO
B.CO C.ClO﹣ D.CH3COO﹣
C.ClO﹣ D.CH3COO﹣
(6)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是___________ 。
A.Va>10Vb B.Va<10Vb C.Vb<10Va D.Vb>10Va
(7)已知100℃时,水的离子积常数Kw=1.0×10﹣12,pH=3的CH3COOH和pH=9的NaOH溶液等体积混合,混合溶液呈___________ 性;
(8)等浓度的①(NH4)2SO4、②NH4HSO4、③NH4HCO3、④NH4Cl、⑤NH3•H2O溶液中,NH 浓度由大到小的顺序是:
浓度由大到小的顺序是:___________ 。
(9)计算该温度下CH3COONa的水解平衡常数Kh___________ 。
(10)物质的量浓度相同的四种溶液:a.CH3COONa b.NaHCO3 c.NaClO d.Na2CO3四种溶液的pH由小到大排列的顺序是___________ (用编号填写)。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH CH3COO﹣+H+ CH3COO﹣+H+ | 2×10﹣5 |
| HClO | HClO ClO﹣+H+ ClO﹣+H+ | 3.0×10﹣8 |
| H2CO3 | H2CO3 H++HCO H++HCO HCO   H++CO H++CO | K1=4.4×10﹣7 K2=5.6×10﹣11 |
| H3PO4 | H3PO4 H++H2PO H++H2PO H2PO   H++HPO H++HPO HPO   H++PO H++PO | K1=7.1×10﹣3 K2=6.3×10﹣8 K3=4.2×10﹣13 |
(1)若把CH3COOH、HClO、H2CO3、HCO
 、H3PO4、H2PO
、H3PO4、H2PO 、HPO
、HPO 都看作是酸,则它们酸性最强的是
都看作是酸,则它们酸性最强的是(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为
(3)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是
A.c(H+) B.c(H+)•c(CH3COO﹣) C.c(H+)•c(OH﹣) D.

(4)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1
(5)下列四种离子结合H+能力最强的是
A.HCO
 B.CO
B.CO C.ClO﹣ D.CH3COO﹣
C.ClO﹣ D.CH3COO﹣(6)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是
A.Va>10Vb B.Va<10Vb C.Vb<10Va D.Vb>10Va
(7)已知100℃时,水的离子积常数Kw=1.0×10﹣12,pH=3的CH3COOH和pH=9的NaOH溶液等体积混合,混合溶液呈
(8)等浓度的①(NH4)2SO4、②NH4HSO4、③NH4HCO3、④NH4Cl、⑤NH3•H2O溶液中,NH
 浓度由大到小的顺序是:
浓度由大到小的顺序是:(9)计算该温度下CH3COONa的水解平衡常数Kh
(10)物质的量浓度相同的四种溶液:a.CH3COONa b.NaHCO3 c.NaClO d.Na2CO3四种溶液的pH由小到大排列的顺序是
更新时间:2020-12-14 20:14:17
|
相似题推荐
计算题
|
适中
(0.65)
名校
【推荐1】已知水在25℃和95℃时的电离平衡曲线如图所示:
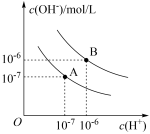
(1)95℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比_______ 。
(2)25℃时,等体积的pH=12的NaOH溶液和氨水分别与0.1mol/L的盐酸发生中和反应时,恰好完全反应时消耗盐酸的体积_______ 。(填:“前者多”或“后者多”或“一样多”)
(3)在一定温度下,有以下三种酸:a.醋酸 b.硫酸 c.盐酸
①当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是_______ (用a、b、c表示,下同)。
②当三种酸的pH相同、体积相同时,分别加入足量的锌,产生H2 的体积(相同状况)由大到小的顺序为_______ 。

(1)95℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比
(2)25℃时,等体积的pH=12的NaOH溶液和氨水分别与0.1mol/L的盐酸发生中和反应时,恰好完全反应时消耗盐酸的体积
(3)在一定温度下,有以下三种酸:a.醋酸 b.硫酸 c.盐酸
①当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是
②当三种酸的pH相同、体积相同时,分别加入足量的锌,产生H2 的体积(相同状况)由大到小的顺序为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】60mL 0.5mol/L NaOH溶液和40mL 0.4mol/L的H2SO4混合后,溶液的pH是_____
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】(1)某温度下,纯水中的c(H+)=2×10-7 mol/L,则此时c(OH-)=___ 。若温度不变,滴入稀硫酸使c(H+)=5×10-6mol/L,则由水电离出的c(H+)为___ 。
(2)常温下有一pH=12的NaOH溶液100mL,欲使它的pH降为11。
①如果加入蒸馏水,就加入___ mL;
②如果加入pH=10的NaOH溶液,应加入___ mL;
③如果加入0.008mol/L HCl溶液,应加入____ mL。
(3)常温下,浓度均为0.01 mol/L的两瓶溶液盐酸和氢氟酸,升高相同的温度c(Cl-)/c(F-)的值____ (填“变大”“变小”“不变”)。
(2)常温下有一pH=12的NaOH溶液100mL,欲使它的pH降为11。
①如果加入蒸馏水,就加入
②如果加入pH=10的NaOH溶液,应加入
③如果加入0.008mol/L HCl溶液,应加入
(3)常温下,浓度均为0.01 mol/L的两瓶溶液盐酸和氢氟酸,升高相同的温度c(Cl-)/c(F-)的值
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】完成下列各题:
(1)磷的一种化合物叫亚磷酸( )。已知:
)。已知:
(i)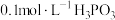 溶液的
溶液的 ;
;
(ii) 与NaOH反应只生成
与NaOH反应只生成 和
和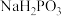 ;
;
(iii) 和碘水反应,碘水棕黄色褪去,再加
和碘水反应,碘水棕黄色褪去,再加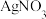 溶液有黄色沉淀生成。
溶液有黄色沉淀生成。
①关于 的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是
的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是______ 。(填序号)
A.bdf B.ade C.bcf D. bce
②Na2HPO3为__________ (填“正盐”或“酸式盐”)
(2)常温下,氨水的pH>7,用离子方程式解释其原因:_____________________________ 。
(3)25℃时, 溶液和盐酸的物质的量浓度相同。
溶液和盐酸的物质的量浓度相同。
①加水稀释至相同的倍数,此时 溶液的pH
溶液的pH______ (填“大于”“小于”或“等于”)盐酸的pH。
②加水稀释至相同的pH,此时加入 溶液中水的体积
溶液中水的体积______ (填“大于”“小于”或“等于”)加入盐酸中水的体积。
(4)常温下, 溶液中
溶液中
______ (用含 和
和 的代数式表示)。
的代数式表示)。
(5)25℃时,现有 的HCl溶液100mL,要使它的
的HCl溶液100mL,要使它的 ,如果加入蒸馏水,需加水
,如果加入蒸馏水,需加水______ mL;如果加入 的HCl溶液,需加入此HCl溶液
的HCl溶液,需加入此HCl溶液______ mL(假定溶液体积有加和性,下同)。
(6)某温度下,纯水中的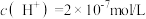 。若温度不变,滴入稀硫酸使
。若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的 为
为______ mol/L。
(1)磷的一种化合物叫亚磷酸(
 )。已知:
)。已知:(i)
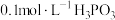 溶液的
溶液的 ;
;(ii)
 与NaOH反应只生成
与NaOH反应只生成 和
和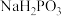 ;
;(iii)
 和碘水反应,碘水棕黄色褪去,再加
和碘水反应,碘水棕黄色褪去,再加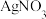 溶液有黄色沉淀生成。
溶液有黄色沉淀生成。①关于
 的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是
的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是A.bdf B.ade C.bcf D. bce
②Na2HPO3为
(2)常温下,氨水的pH>7,用离子方程式解释其原因:
(3)25℃时,
 溶液和盐酸的物质的量浓度相同。
溶液和盐酸的物质的量浓度相同。①加水稀释至相同的倍数,此时
 溶液的pH
溶液的pH②加水稀释至相同的pH,此时加入
 溶液中水的体积
溶液中水的体积(4)常温下,
 溶液中
溶液中
 和
和 的代数式表示)。
的代数式表示)。(5)25℃时,现有
 的HCl溶液100mL,要使它的
的HCl溶液100mL,要使它的 ,如果加入蒸馏水,需加水
,如果加入蒸馏水,需加水 的HCl溶液,需加入此HCl溶液
的HCl溶液,需加入此HCl溶液(6)某温度下,纯水中的
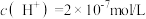 。若温度不变,滴入稀硫酸使
。若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的 为
为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】电解质溶液中的离子间存在多种形式的平衡。
(1)电离平衡
弱酸、弱碱的电离程度可以分别用它们的电离度(α= )或电离常数(K)来表示。常温下,实验测定的醋酸电离达到平衡时各种微粒的浓度如下表:
)或电离常数(K)来表示。常温下,实验测定的醋酸电离达到平衡时各种微粒的浓度如下表:
①该条件下醋酸的电离度α=___ %。
②该条件下醋酸的电离常数Ka=___ (用科学记数法表示,保留两位有效数字)。
(2)水解平衡
①写出Na2CO3溶于水时发生水解反应的离子方程式:____ 。
②比较常温下同浓度溶液的pH:Na2CO3___ NaHCO3(选填“>”“<”或“=”)。
③常温下,浓度均为0.1 mol/L的Na2CO3和NaHCO3混合溶液中,离子浓度从大到小到顺序为___ 。物料守恒关系为___ 。
(3)沉淀溶解平衡
①写出Mg(OH)2沉淀溶解平衡常数的表达式:_____ 。
②已知常温下Mg(OH)2、Al(OH)3的溶度积常数分别为5.6×10-12和1×10-33。常温下,某溶液中c(Mg2+)=5.6 mol·L-1,欲除去该溶液中的Al3+(使其浓度小于1×10-6 mol·L-1),需调节溶液的pH范围为___ <pH<___ 。
(1)电离平衡
弱酸、弱碱的电离程度可以分别用它们的电离度(α=
 )或电离常数(K)来表示。常温下,实验测定的醋酸电离达到平衡时各种微粒的浓度如下表:
)或电离常数(K)来表示。常温下,实验测定的醋酸电离达到平衡时各种微粒的浓度如下表:| 醋酸溶液的初始浓度: | 0.100 | |
| 平衡浓度/ mol·L-1 | c(CH3COOH) | |
| c(CH3COO-) | 1.34×10-3 | |
| c(H+) | 1.34×10-3 | |
②该条件下醋酸的电离常数Ka=
(2)水解平衡
①写出Na2CO3溶于水时发生水解反应的离子方程式:
②比较常温下同浓度溶液的pH:Na2CO3
③常温下,浓度均为0.1 mol/L的Na2CO3和NaHCO3混合溶液中,离子浓度从大到小到顺序为
(3)沉淀溶解平衡
①写出Mg(OH)2沉淀溶解平衡常数的表达式:
②已知常温下Mg(OH)2、Al(OH)3的溶度积常数分别为5.6×10-12和1×10-33。常温下,某溶液中c(Mg2+)=5.6 mol·L-1,欲除去该溶液中的Al3+(使其浓度小于1×10-6 mol·L-1),需调节溶液的pH范围为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】25 ℃时,将体积为Va、pH=a的某一元酸HA溶液与体积为Vb、pH=b的某一元碱BOH溶液混合,请回答。
(1)若a + b=14,2Va=Vb,反应后所得溶液pH=7。则生成的盐溶液中,一定发生水解的离子方 程式为_______
(2)若a + b=12,酸是盐酸,碱是KOH,反应后所得溶液pH=7,则Va与Vb的关系是_______
(3)若酸是盐酸,碱是氨水,反应后所得溶液中离子浓度大小关系不可能是_________ (填序号)
A.c(Cl-)>c(NH )>c(H+)>c(OH-) B.c(H+)>c(OH-)>c(Cl-)>c(NH
)>c(H+)>c(OH-) B.c(H+)>c(OH-)>c(Cl-)>c(NH )
)
C.c(NH )>c(Cl-)>c(OH-)>c(H+) D.c(Cl-)>c(H+)>c(NH
)>c(Cl-)>c(OH-)>c(H+) D.c(Cl-)>c(H+)>c(NH )>c(OH-)
)>c(OH-)
E.c(Cl-)=c(NH )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
(4)若酸是醋酸,碱是NaOH,且反应后混合溶液中c(CH3COO-)>c(H+),则混合溶液可能呈_____ (填序号)
A.酸性 B.碱性 C.中性 D.都有可能
(5)25 ℃时,将体积Va=200 mL,pH=2的H2SO4溶液与体积Vb=10 mL、pH=11的氨水溶液混合,恰好完全反应。则此条件下,氨水的电离平衡常数是____________
(1)若a + b=14,2Va=Vb,反应后所得溶液pH=7。则生成的盐溶液中,一定发生水解的离子方 程式为
(2)若a + b=12,酸是盐酸,碱是KOH,反应后所得溶液pH=7,则Va与Vb的关系是
(3)若酸是盐酸,碱是氨水,反应后所得溶液中离子浓度大小关系不可能是
A.c(Cl-)>c(NH
 )>c(H+)>c(OH-) B.c(H+)>c(OH-)>c(Cl-)>c(NH
)>c(H+)>c(OH-) B.c(H+)>c(OH-)>c(Cl-)>c(NH )
)C.c(NH
 )>c(Cl-)>c(OH-)>c(H+) D.c(Cl-)>c(H+)>c(NH
)>c(Cl-)>c(OH-)>c(H+) D.c(Cl-)>c(H+)>c(NH )>c(OH-)
)>c(OH-)E.c(Cl-)=c(NH
 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)(4)若酸是醋酸,碱是NaOH,且反应后混合溶液中c(CH3COO-)>c(H+),则混合溶液可能呈
A.酸性 B.碱性 C.中性 D.都有可能
(5)25 ℃时,将体积Va=200 mL,pH=2的H2SO4溶液与体积Vb=10 mL、pH=11的氨水溶液混合,恰好完全反应。则此条件下,氨水的电离平衡常数是
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下,向20mL0.01mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:(已知lg4=0.6)

(1)a点溶液中c(H+)为__ ,pH约为__ 。
(2)a、b、c、d四点中水的电离程度最大的是__ 点,滴定过程中宜选用__ 作指示剂,滴定终点在__ (填“c点以上”或“c点以下”)。

(1)a点溶液中c(H+)为
(2)a、b、c、d四点中水的电离程度最大的是
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】已知在25 ℃时,碳酸和亚硫酸的电离平衡常数如表所示:
(1)NaHSO3水解反应的平衡常数Kh=___________ mol·L-1。
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为___________
| 电解质 | 碳酸 | 亚硫酸 |
| 电离常数 | Ka1=4.30×10-7 ,Ka2=5.61×10-11 | Ka1=1.00×10-2 ,Ka2=1.02×10-7 |
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题:
(1)已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,回答下列问题:
①该溶液的pH=_______ 。
②升高温度时,K_______ (填“增大”“减小”或“不变”,下同),pH_______ 。
(2)25 ℃下,纯水中c(H+)=1×10-7 mol·L-1,则此时c(OH-)=_______ ,该温度下向纯水中加盐酸,使溶液中的c(H+)=1×10-3 mol·L-1,则此时溶液的pH=_______ ;若25 ℃下,向纯水中加入NaOH固体,使溶液的pH=13,此时溶液中c(OH-)=_______ 。
(3)pH=2的NH4Cl溶液中由H2O电离的c(H+)=_______ 。
(1)已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,回答下列问题:
①该溶液的pH=
②升高温度时,K
(2)25 ℃下,纯水中c(H+)=1×10-7 mol·L-1,则此时c(OH-)=
(3)pH=2的NH4Cl溶液中由H2O电离的c(H+)=
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】已知酸度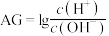
 常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
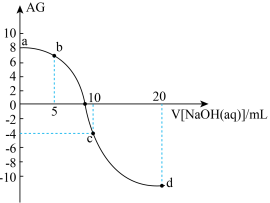
(1)a 点溶液的pH为___________ ,常温下 Kₐ(HA)=___________ 。
(2)若升高温度,0.1 mol∙L−1NaOH 溶液的酸度(AG)将___________ (填“变大”、“变小”或“不变”)。
(3)c 点加入 NaOH 溶液的体积___________ (填“>”、“<”或“=”)10mL。
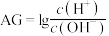
 常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
(1)a 点溶液的pH为
(2)若升高温度,0.1 mol∙L−1NaOH 溶液的酸度(AG)将
(3)c 点加入 NaOH 溶液的体积
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐3】表中是常温下碳酸的电离常数和Fe(OH)3的溶度积常数:
(1)常温下,pH=10的Na2CO3溶液中,发生水解反应的 的浓度c(CO
的浓度c(CO )≈
)≈___ mol·L-1。
(2)常温下,若在实验室中配制500 mL5 mol·L-1FeCl3溶液,为使配制过程中不出现浑浊现象,至少需要加入2 mol·L-1的盐酸___ mL。(加入盐酸后溶液体积变化忽略不计)
| H2CO3 | Fe(OH)3 |
| K1=4.2×10-7 K2=5.6×10-11 | Ksp=4×10-38 |
(1)常温下,pH=10的Na2CO3溶液中,发生水解反应的
 的浓度c(CO
的浓度c(CO )≈
)≈(2)常温下,若在实验室中配制500 mL5 mol·L-1FeCl3溶液,为使配制过程中不出现浑浊现象,至少需要加入2 mol·L-1的盐酸
您最近一年使用:0次

 =
= (保留两位有效
(保留两位有效 数字)。
数字)。


