现有下列化合物①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O,回答问题:
(1)NH4Cl 溶液显_______ 性,用离子方程式表示_______ 。
(2)常温下,pH=10 的 CH3COONa 溶液中,水电离出来的 c(OH- )为_______ mol/L,在 pH=3 的CH3COOH 溶液中水电离出来的 c(H+ )为_______ mol/L。
(3)已知水中存在如下平衡:H2O+H2O⇌H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的方法是_______ 。
A.向水中加入 NaHSO4 固体 B.向水中加入 Na2CO3 固体
C.加热至 100℃ D.向水中加入(NH4)2SO4 固体
(4) 常温下,将 pH=12 的 NaOH 和氨水分别加水稀释 100 倍后,稀释后 NaOH 的 pH_______ 10, 氨水的 pH_______ 10(填“>”“<”或“=”)
(5)等物质的量浓度的④NH4Cl、⑤CH3COONa、⑦NH3·H2O溶液中 浓度由大到小的顺序是
浓度由大到小的顺序是____________ (填序号)
(1)NH4Cl 溶液显
(2)常温下,pH=10 的 CH3COONa 溶液中,水电离出来的 c(OH- )为
(3)已知水中存在如下平衡:H2O+H2O⇌H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的方法是
A.向水中加入 NaHSO4 固体 B.向水中加入 Na2CO3 固体
C.加热至 100℃ D.向水中加入(NH4)2SO4 固体
(4) 常温下,将 pH=12 的 NaOH 和氨水分别加水稀释 100 倍后,稀释后 NaOH 的 pH
(5)等物质的量浓度的④NH4Cl、⑤CH3COONa、⑦NH3·H2O溶液中
 浓度由大到小的顺序是
浓度由大到小的顺序是
更新时间:2021-02-02 11:54:50
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】已知溶液中的化学反应大多是离子反应。根据要求回答下列问题。
(1)水存在如下平衡:H2O+H2O H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________ (填 “左”或“右”)移动, 且所得溶液显____ 性。
(2)向水中加NaHCO3固体,水的电离平衡向____ (填“左”或“右”)移动,且所得溶液显____ 性。
(3)常温下,0.1 mol·L-1 CH3COONa溶液的pH为9,则由水电离出的c(H+)=________ 。
(4)若取pH、体积均相等的NaOH溶液和氨水分别加水稀释m倍、n倍后pH仍相等,则m____ n ( 填“>”“<”或“=”)。
(1)水存在如下平衡:H2O+H2O
 H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向(2)向水中加NaHCO3固体,水的电离平衡向
(3)常温下,0.1 mol·L-1 CH3COONa溶液的pH为9,则由水电离出的c(H+)=
(4)若取pH、体积均相等的NaOH溶液和氨水分别加水稀释m倍、n倍后pH仍相等,则m
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】在不同温度下的水溶液中,c(H+)和c(OH-)的关系如图所示:
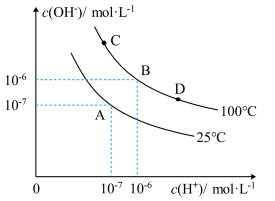
(1)A点水的离子积为________ ,C点水的离子积为_______ ,对纯水由25℃升高温度至100℃时水的离子积______ (填“增大”、“减小”或“不变”)。
(2)100℃时,若向B点溶液中滴加硫酸,体系将由B点移向_____ 点(填C或D),为什么_________ 。
(3)25℃时,0.001mol/L的盐酸溶液pH=_______ ;0.001mol/L的氢氧化钠溶液pH=_________ ;若将二者温度都升高至100℃,_________ (填“盐酸”、“氢氧化钠”、“盐酸和氢氧化钠”)的pH会改变。

(1)A点水的离子积为
(2)100℃时,若向B点溶液中滴加硫酸,体系将由B点移向
(3)25℃时,0.001mol/L的盐酸溶液pH=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
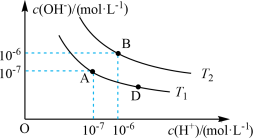
(1)A点水的离子积为1.0×10-14,B点水的离子积为___________ 。造成水的离子积变化的原因是___________ 。
(2)下列说法正确的是___________ (填字母)。
a.图中A、B、D三点处Kw的大小关系:B>A>D
b.AB线上任意点的溶液均呈中性
c.B点溶液呈酸性
d.图中温度T1>T2
(3)T2时,若向溶液中滴加盐酸,能否使体系处于B点位置?为什么?___________ 。
(4)T2时,若盐酸中c(H+)=5×10-4 mol·L-1,则由水电离产生的c(H+)=___________ 。

(1)A点水的离子积为1.0×10-14,B点水的离子积为
(2)下列说法正确的是
a.图中A、B、D三点处Kw的大小关系:B>A>D
b.AB线上任意点的溶液均呈中性
c.B点溶液呈酸性
d.图中温度T1>T2
(3)T2时,若向溶液中滴加盐酸,能否使体系处于B点位置?为什么?
(4)T2时,若盐酸中c(H+)=5×10-4 mol·L-1,则由水电离产生的c(H+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】电解质溶液中存在多种平衡体系,请根据相关信息回答下列问题。
(1)已知常温下FeS和CuS的溶度积分别为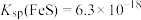 ,
,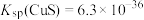 。向FeS悬浊液中滳加
。向FeS悬浊液中滳加 溶液产生黑色沉淀,发生反应的离子方程式为
溶液产生黑色沉淀,发生反应的离子方程式为_______ ,该反应得平衡常数K=_______ 。
(2)已知常温下HA的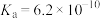 。常温下,含等物质的量浓度的HA与NaA的混合溶液显
。常温下,含等物质的量浓度的HA与NaA的混合溶液显_______ (填“酸”“碱”或“中”)性,该溶液中各离子浓度由大到小的顺序为_______ 。
(3)若25℃时,0.10mol/L的 的电离度为1%,则由醋酸电离出的
的电离度为1%,则由醋酸电离出的 约为水电离出的
约为水电离出的 的
的_______ 倍。
(4)已知在25℃时,醋酸的电离平衡常数为 。常温下,0.1mol/LNaOH溶液
。常温下,0.1mol/LNaOH溶液 和
和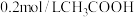 溶液
溶液 混合后(忽略混合前后溶液体积的变化)溶液的pH=7。
混合后(忽略混合前后溶液体积的变化)溶液的pH=7。
①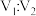
_______ (填“>”、“<”或“=”)2:1
②
_______ 。
(1)已知常温下FeS和CuS的溶度积分别为
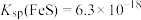 ,
,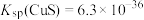 。向FeS悬浊液中滳加
。向FeS悬浊液中滳加 溶液产生黑色沉淀,发生反应的离子方程式为
溶液产生黑色沉淀,发生反应的离子方程式为(2)已知常温下HA的
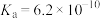 。常温下,含等物质的量浓度的HA与NaA的混合溶液显
。常温下,含等物质的量浓度的HA与NaA的混合溶液显(3)若25℃时,0.10mol/L的
 的电离度为1%,则由醋酸电离出的
的电离度为1%,则由醋酸电离出的 约为水电离出的
约为水电离出的 的
的(4)已知在25℃时,醋酸的电离平衡常数为
 。常温下,0.1mol/LNaOH溶液
。常温下,0.1mol/LNaOH溶液 和
和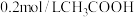 溶液
溶液 混合后(忽略混合前后溶液体积的变化)溶液的pH=7。
混合后(忽略混合前后溶液体积的变化)溶液的pH=7。①
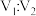
②

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】25℃时,向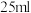 氢氧化钠标准溶液中逐滴加入
氢氧化钠标准溶液中逐滴加入 的一元酸
的一元酸 溶液,
溶液, 变化曲线如下图所示:
变化曲线如下图所示:

(1)该氢氧化钠溶液的物质的量浓度为___________  。
。
(2)A点对应酸的体积为 ,则所得混合溶液中由水电离出的
,则所得混合溶液中由水电离出的
_____  。
。
(3) 是
是___________ 酸(选填“强”、“弱”)。
(4)在B点所得混合溶液中, 、
、 、
、 、
、 的大小的顺序是
的大小的顺序是______ 。
(5)在C点所得混合溶液中,下列说法正确的是___________。
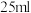 氢氧化钠标准溶液中逐滴加入
氢氧化钠标准溶液中逐滴加入 的一元酸
的一元酸 溶液,
溶液, 变化曲线如下图所示:
变化曲线如下图所示:
(1)该氢氧化钠溶液的物质的量浓度为
 。
。(2)A点对应酸的体积为
 ,则所得混合溶液中由水电离出的
,则所得混合溶液中由水电离出的
 。
。(3)
 是
是(4)在B点所得混合溶液中,
 、
、 、
、 、
、 的大小的顺序是
的大小的顺序是(5)在C点所得混合溶液中,下列说法正确的是___________。
| A.该混合溶液中水的电离受到抑制作用 |
B.离子浓度由大到小的顺序是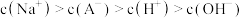 |
C. |
D.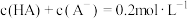 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】水是生命的源泉,水溶液中的离子平衡与我们的生产生活密切相关。
(1)25℃时,pH为2的硫酸溶液与pH为12的氢氧化钠溶液,由水电离出的c(OH-)之比为___________ 。
(2)t℃时,测得纯水中c(OH-)=1×10-7mol/L,则t___________ 25℃(填“>”“<”或“=”),该温度下,0.5mol/L Ba(OH)2溶液的pH=___________ 。
(3)25℃时,pH=a的某强酸和pH=b的某强碱按体积比1:100混合后,溶液恰呈中性,则a+b=___________ 。
(4)现有以下五种电解质溶液,回答下列问题:
①CH3COOH ②NaOH ③NH3·H2O ④H2SO4 ⑤CH3COONa
①浓度均为0.1mol·L-1的五种溶液中导电能力最强的是___________ (填序号)。
②浓度均为0.1mol·L-1的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为___________ (填序号)。
(1)25℃时,pH为2的硫酸溶液与pH为12的氢氧化钠溶液,由水电离出的c(OH-)之比为
(2)t℃时,测得纯水中c(OH-)=1×10-7mol/L,则t
(3)25℃时,pH=a的某强酸和pH=b的某强碱按体积比1:100混合后,溶液恰呈中性,则a+b=
(4)现有以下五种电解质溶液,回答下列问题:
①CH3COOH ②NaOH ③NH3·H2O ④H2SO4 ⑤CH3COONa
①浓度均为0.1mol·L-1的五种溶液中导电能力最强的是
②浓度均为0.1mol·L-1的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】25℃时部分弱酸的电离平衡常数如下表:
1.室温下① ②
② ③
③ ④
④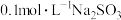 ,溶液的pH由大到小的关系为(填序号)
,溶液的pH由大到小的关系为(填序号)_____ 。
2.下列离子方程式书写正确的是
| 弱酸 |  |  |  |  |
| 电离平衡常数 |  | 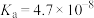 |   | 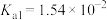  |
 ②
② ③
③ ④
④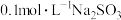 ,溶液的pH由大到小的关系为(填序号)
,溶液的pH由大到小的关系为(填序号)2.下列离子方程式书写正确的是
A.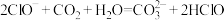 |
B. |
C. |
D. |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】几种弱酸的电离常数(25℃)如下表:
(1) 的第一步电离方程式为
的第一步电离方程式为___________ 。
(2)上述三种酸的酸性由强到弱的顺序是___________ (写化学式)。
(3)对 溶液进行下列操作,能使
溶液进行下列操作,能使 的水解程度增大的是___________(填标号)。
的水解程度增大的是___________(填标号)。
(4)用实验确定HA是否为弱电解质,设计了如下实验方案:
①方案1:先量取一定体积的HA,配制成 的溶液,用pH计测出常温下该溶液的pH的值
的溶液,用pH计测出常温下该溶液的pH的值___________ ,证明HA为弱电解质。
②方案2:设计一个合理且比较容易进行的实验方案(药品可任取),并作简明扼要的表述:___________ 。
③25℃时,用pH计测定不同浓度HA溶液的pH如图所示。稀释HA溶液,水的电离程度会___________ (填“增大”或“减小”),根据图中信息,判断HA为弱电解质的依据是___________ 。

| 弱酸 |  | HClO |  |
电离常数 | 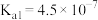  |  |  |
 的第一步电离方程式为
的第一步电离方程式为(2)上述三种酸的酸性由强到弱的顺序是
(3)对
 溶液进行下列操作,能使
溶液进行下列操作,能使 的水解程度增大的是___________(填标号)。
的水解程度增大的是___________(填标号)。| A.适当升高温度 | B.加入NaOH固体 |
| C.通入HCl气体 | D.加入 固体 固体 |
①方案1:先量取一定体积的HA,配制成
 的溶液,用pH计测出常温下该溶液的pH的值
的溶液,用pH计测出常温下该溶液的pH的值②方案2:设计一个合理且比较容易进行的实验方案(药品可任取),并作简明扼要的表述:
③25℃时,用pH计测定不同浓度HA溶液的pH如图所示。稀释HA溶液,水的电离程度会

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)有一种溶液除H+、OH-外,还有Na+、SO 和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为
和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为________ 。
(2)NH4Cl溶液显酸性,试用离子方程式表示这一原理______________________ 。
(3)液氨的电离类似于水,试写出液氨的电离方程式________________________________ ;在液氨中加入NH4Cl,平衡将向________ 移动。
(1)有一种溶液除H+、OH-外,还有Na+、SO
 和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为
和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为(2)NH4Cl溶液显酸性,试用离子方程式表示这一原理
(3)液氨的电离类似于水,试写出液氨的电离方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】I.用相应的方程式解释:
(1)NaHSO3溶液显酸性:___________________
(2)NaHCO3溶液显碱性:____________________
(3)NH4Cl溶液显酸性:______________________
(4)明矾[KAl(SO4)2]净水:___________________
(5)FeCl3溶液蒸干得到Fe2O3固体:____________ (第一步反应)
II.向2份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2CO3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为_______ 、______ (填“减小”、“增大”或“不变”)。
(1)NaHSO3溶液显酸性:
(2)NaHCO3溶液显碱性:
(3)NH4Cl溶液显酸性:
(4)明矾[KAl(SO4)2]净水:
(5)FeCl3溶液蒸干得到Fe2O3固体:
II.向2份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2CO3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】按要求完成下列各题。
(1)FeCl3溶液中加入KSCN呈红色,写出离子方程式_________________________ 。
(2)NaHCO3溶液显碱性的原因_________________________ 。
(3)NH4Cl溶液加入锌粒产生气体的离子方程式_________________________ 。
(4)已知16克固体硫充分燃烧放出148.4kJ的热量,则该反应的热化学方程式为_____________ 。
(1)FeCl3溶液中加入KSCN呈红色,写出离子方程式
(2)NaHCO3溶液显碱性的原因
(3)NH4Cl溶液加入锌粒产生气体的离子方程式
(4)已知16克固体硫充分燃烧放出148.4kJ的热量,则该反应的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】按要求书写以下反应的方程式:
(1)偏铝酸钠溶液呈碱性,用离子方程式解释其原因:___________ ,因此贮存偏铝酸钠溶液时,不能用带___________ 塞的试剂瓶保存。
(2)盐碱地(含较多的 )不利于农作物生长,通过施加适量石膏可以降低土壤的碱性,用离子方程式解释石膏能降低其碱性的原因:
)不利于农作物生长,通过施加适量石膏可以降低土壤的碱性,用离子方程式解释石膏能降低其碱性的原因:___________ 。
(3)制备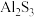 时必须干燥环境,用化学方程式解释原因:
时必须干燥环境,用化学方程式解释原因:___________ 。
(4)将 溶液蒸干并灼烧后的产物为
溶液蒸干并灼烧后的产物为___________ ,但将 与
与 混合并加热,可得到无水
混合并加热,可得到无水 ,用化学方程式解释其原因
,用化学方程式解释其原因___________ 。
(5)利用 制备
制备 的化学方程式:
的化学方程式:___________ 。
(1)偏铝酸钠溶液呈碱性,用离子方程式解释其原因:
(2)盐碱地(含较多的
 )不利于农作物生长,通过施加适量石膏可以降低土壤的碱性,用离子方程式解释石膏能降低其碱性的原因:
)不利于农作物生长,通过施加适量石膏可以降低土壤的碱性,用离子方程式解释石膏能降低其碱性的原因:(3)制备
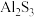 时必须干燥环境,用化学方程式解释原因:
时必须干燥环境,用化学方程式解释原因:(4)将
 溶液蒸干并灼烧后的产物为
溶液蒸干并灼烧后的产物为 与
与 混合并加热,可得到无水
混合并加热,可得到无水 ,用化学方程式解释其原因
,用化学方程式解释其原因(5)利用
 制备
制备 的化学方程式:
的化学方程式:
您最近一年使用:0次



