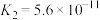物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种,请根据所学化学知识回答下列问题:
(1)已知 溶液呈中性。常温下,浓度均为
溶液呈中性。常温下,浓度均为 的8种溶液:①
的8种溶液:① 溶液;②
溶液;② 溶液;③
溶液;③ 溶液:④
溶液:④ ;⑤
;⑤ 溶液;⑥
溶液;⑥ 溶液;⑦
溶液;⑦ 溶液:⑧
溶液:⑧ 溶液。这些溶液中水的电离程度由大到小的顺序是
溶液。这些溶液中水的电离程度由大到小的顺序是___________ (填序号)。
(2)25℃时,向 的氯化铵溶液中加入
的氯化铵溶液中加入 的氨水,判断铵离子的水解程度如何变化并说明理由:
的氨水,判断铵离子的水解程度如何变化并说明理由:___________ 。
(3)室温下,如果将
 和
和
 全部溶于水,形成混合溶液(假设无损失),两种粒子
全部溶于水,形成混合溶液(假设无损失),两种粒子___________ (填两种粒子的化学式)的物质的量之和比 多
多 。
。
(4)如图所示,横坐标为溶液的 ,纵坐标为
,纵坐标为 或
或 物质的量浓度的对数。回答下列问题:
物质的量浓度的对数。回答下列问题:
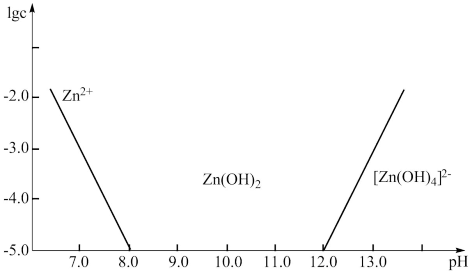
①向 溶液中加入足量的氢氧化钠溶液,写出该反应的化学方程式:
溶液中加入足量的氢氧化钠溶液,写出该反应的化学方程式:___________ 。
②从图中数据计算可得 的溶度积
的溶度积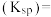
___________ 。
(5) 饱和溶液中存在:
饱和溶液中存在: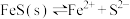 ,常温下
,常温下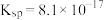 。
。
①理论上 的溶解度为
的溶解度为___________ g。
②又知 饱和溶液中
饱和溶液中 与
与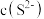 之间存在以下限量关系:
之间存在以下限量关系: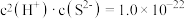 ,为了使溶液里
,为了使溶液里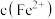 达到
达到 ,现将适量
,现将适量 投入其饱和溶液中,应调节溶液中的
投入其饱和溶液中,应调节溶液中的 为
为___________ 。
(1)已知
 溶液呈中性。常温下,浓度均为
溶液呈中性。常温下,浓度均为 的8种溶液:①
的8种溶液:① 溶液;②
溶液;② 溶液;③
溶液;③ 溶液:④
溶液:④ ;⑤
;⑤ 溶液;⑥
溶液;⑥ 溶液;⑦
溶液;⑦ 溶液:⑧
溶液:⑧ 溶液。这些溶液中水的电离程度由大到小的顺序是
溶液。这些溶液中水的电离程度由大到小的顺序是(2)25℃时,向
 的氯化铵溶液中加入
的氯化铵溶液中加入 的氨水,判断铵离子的水解程度如何变化并说明理由:
的氨水,判断铵离子的水解程度如何变化并说明理由:(3)室温下,如果将

 和
和
 全部溶于水,形成混合溶液(假设无损失),两种粒子
全部溶于水,形成混合溶液(假设无损失),两种粒子 多
多 。
。(4)如图所示,横坐标为溶液的
 ,纵坐标为
,纵坐标为 或
或 物质的量浓度的对数。回答下列问题:
物质的量浓度的对数。回答下列问题:
①向
 溶液中加入足量的氢氧化钠溶液,写出该反应的化学方程式:
溶液中加入足量的氢氧化钠溶液,写出该反应的化学方程式:②从图中数据计算可得
 的溶度积
的溶度积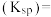
(5)
 饱和溶液中存在:
饱和溶液中存在: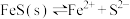 ,常温下
,常温下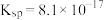 。
。①理论上
 的溶解度为
的溶解度为②又知
 饱和溶液中
饱和溶液中 与
与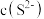 之间存在以下限量关系:
之间存在以下限量关系: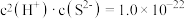 ,为了使溶液里
,为了使溶液里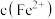 达到
达到 ,现将适量
,现将适量 投入其饱和溶液中,应调节溶液中的
投入其饱和溶液中,应调节溶液中的 为
为
更新时间:2021/12/07 20:32:27
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】(1)已知常温时,a mol/L醋酸在水中有0.1 mol/L NaOH等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=___________________ (用含a的代数式表示)。
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
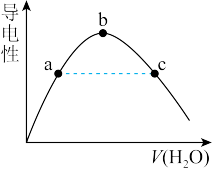
a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是______________ 。
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
①物质的量浓度均为0.1 mol/L的四种溶液:pH由小到大排列的顺序是____________ (用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:_____________________________ 。
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:

a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】25℃时,有关物质的电离常数如下表:
(1)25℃时,反应 的平衡常数K=
的平衡常数K=___________ 。
(2)NaClO溶液在空气中吸收 的离子方程式为
的离子方程式为___________ 。
(3)反应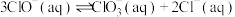 在室温下能自发进行。
在室温下能自发进行。
①T℃时,该反应的平衡常数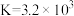 。若某混合溶液中
。若某混合溶液中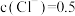
 ,
,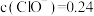
 ,
,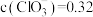
 ,则υ(正)
,则υ(正)___________ υ(逆)(填“>”“<”或“=”)。
②已知基元反应 的速率方程为
的速率方程为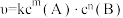 (k为只与温度有关的速率常数),一般反应的速率由基元反应中的慢反应决定。反应
(k为只与温度有关的速率常数),一般反应的速率由基元反应中的慢反应决定。反应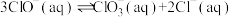 可能的机理有如下几种:
可能的机理有如下几种:
Ⅰ.
Ⅱ.(一)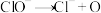 (慢)
(慢)
(二) (快)
(快)
(三) (快)
(快)
Ⅲ.(一) (慢)
(慢)
(二) (快)
(快)
则机理Ⅱ的中间体是___________ 。若反应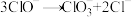 的速率方程为
的速率方程为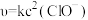 ,则该反应的历程可能是
,则该反应的历程可能是___________ (填标号)。
| 物质 | HClO |  |
| 电离常数 | 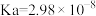 | 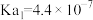 , ,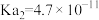 |
(1)25℃时,反应
 的平衡常数K=
的平衡常数K=(2)NaClO溶液在空气中吸收
 的离子方程式为
的离子方程式为(3)反应
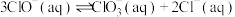 在室温下能自发进行。
在室温下能自发进行。①T℃时,该反应的平衡常数
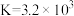 。若某混合溶液中
。若某混合溶液中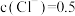
 ,
,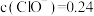
 ,
,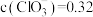
 ,则υ(正)
,则υ(正)②已知基元反应
 的速率方程为
的速率方程为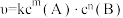 (k为只与温度有关的速率常数),一般反应的速率由基元反应中的慢反应决定。反应
(k为只与温度有关的速率常数),一般反应的速率由基元反应中的慢反应决定。反应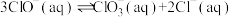 可能的机理有如下几种:
可能的机理有如下几种:Ⅰ.

Ⅱ.(一)
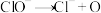 (慢)
(慢)(二)
 (快)
(快)(三)
 (快)
(快)Ⅲ.(一)
 (慢)
(慢)(二)
 (快)
(快)则机理Ⅱ的中间体是
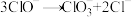 的速率方程为
的速率方程为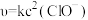 ,则该反应的历程可能是
,则该反应的历程可能是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ的溶液,滴定曲线如图所示。
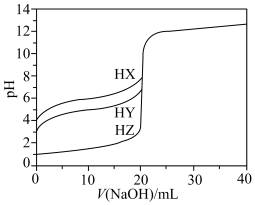
(1)在相同温度下,相同浓度的三种酸溶液的导电能力由强到弱的顺序是____________ 。
(2)V(NaOH)=20.00 mL时,溶液中c(HY)__________ (填“<”“>”或“=”,下同)c(Y-)。若使最终溶液的pH=7,则滴定HZ溶液和滴定HX溶液所需NaOH溶液的体积的关系是HX溶液________ HZ溶液。
(3)将上述HX溶液、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,溶液中各离子浓度的大小关系为_____________ 。
(4)根据滴定曲线,可得Ka(HY)≈________ 。

(1)在相同温度下,相同浓度的三种酸溶液的导电能力由强到弱的顺序是
(2)V(NaOH)=20.00 mL时,溶液中c(HY)
(3)将上述HX溶液、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,溶液中各离子浓度的大小关系为
(4)根据滴定曲线,可得Ka(HY)≈
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】25℃时,三种酸的电离平衡常数如下表所示。
回答下列问题:
(1)pH相等的 溶液、
溶液、 溶液、
溶液、 溶液中,物质的量浓度最小的是
溶液中,物质的量浓度最小的是____________ (填化学式)。
(2)已知 为正盐,依据表格数据,
为正盐,依据表格数据, 的第二级电离平衡常数表达式
的第二级电离平衡常数表达式
___________ ;25℃时,5.6mol·L-1 溶液的pH=
溶液的pH=____________ 。
(3)向体积均为10mL、 均为
均为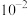 mol·L-1的
mol·L-1的 溶液和一元酸
溶液和一元酸 溶液中,分别加水稀释至1000mL,稀释过程中
溶液中,分别加水稀释至1000mL,稀释过程中 的变化如图所示,则HX的电离平衡常数
的变化如图所示,则HX的电离平衡常数____________ (填“大于”“小于”或“等于”) 的电离平衡常数,理由是
的电离平衡常数,理由是______________________________ 。
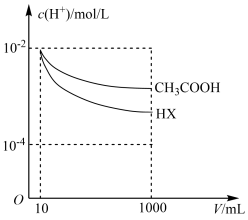
(4)常温下,将0.05mol·L-1的氨水逐滴加入10mL0.1mol·L-1 溶液中至溶液显中性,此时溶液中各离子浓度大小关系为
溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________ 。
| 化学式 |  |  |  |
| 名称 | 醋酸 | 次氯酸 | 亚磷酸 |
| 电离平衡常数 |  | 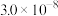 | 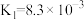 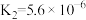 |
(1)pH相等的
 溶液、
溶液、 溶液、
溶液、 溶液中,物质的量浓度最小的是
溶液中,物质的量浓度最小的是(2)已知
 为正盐,依据表格数据,
为正盐,依据表格数据, 的第二级电离平衡常数表达式
的第二级电离平衡常数表达式
 溶液的pH=
溶液的pH=(3)向体积均为10mL、
 均为
均为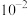 mol·L-1的
mol·L-1的 溶液和一元酸
溶液和一元酸 溶液中,分别加水稀释至1000mL,稀释过程中
溶液中,分别加水稀释至1000mL,稀释过程中 的变化如图所示,则HX的电离平衡常数
的变化如图所示,则HX的电离平衡常数 的电离平衡常数,理由是
的电离平衡常数,理由是
(4)常温下,将0.05mol·L-1的氨水逐滴加入10mL0.1mol·L-1
 溶液中至溶液显中性,此时溶液中各离子浓度大小关系为
溶液中至溶液显中性,此时溶液中各离子浓度大小关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】已知常温下部分弱电解质的电离平衡常数如下表:
(1)常温下, 相同的三种溶液a.
相同的三种溶液a. 溶液;b.
溶液;b. 溶液;c.
溶液;c. 溶液,其物质的量浓度由大到小的顺序是
溶液,其物质的量浓度由大到小的顺序是______ 。(填序号)。
(2)已知在常温时,将浓度相等的 与
与 溶液等体积混合,溶液呈酸性。用平衡常数解释溶液呈酸性的原因
溶液等体积混合,溶液呈酸性。用平衡常数解释溶液呈酸性的原因______ 。
(3)同浓度的 溶液和
溶液和 溶液相比:后者溶液中
溶液相比:后者溶液中
______ 前者溶液中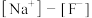 (填字母)。
(填字母)。
A.大于 B.小于
化学式 |
|
|
|
|
电离常数 |
|
|
|
|
 相同的三种溶液a.
相同的三种溶液a. 溶液;b.
溶液;b. 溶液;c.
溶液;c. 溶液,其物质的量浓度由大到小的顺序是
溶液,其物质的量浓度由大到小的顺序是(2)已知在常温时,将浓度相等的
 与
与 溶液等体积混合,溶液呈酸性。用平衡常数解释溶液呈酸性的原因
溶液等体积混合,溶液呈酸性。用平衡常数解释溶液呈酸性的原因(3)同浓度的
 溶液和
溶液和 溶液相比:后者溶液中
溶液相比:后者溶液中
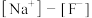 (填字母)。
(填字母)。A.大于 B.小于
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Ⅰ.请回答下列问题:
(1)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
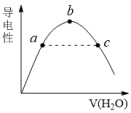
a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是___________ 。
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
①物质的量浓度均为0.1 mol/L的四种溶液:pH由小到大排列的顺序是___________ (用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________ 。
(3)已知常温时,a mol/L醋酸在水中与0.1 mol/L NaOH等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=___________ (用含a的代数式表示)。
Ⅱ.结合下表回答下列问题(均为常温下的数据):
(4)0.1mol/L的H2C2O4溶液与0.1mol/L的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为___________ 。
(5)pH相同的NaClO和CH3COOK溶液中,[c(Na+)-c(C1O-)]___________ [c(K+)-c(CH3COO-)](填“>”、“<”或“=”) 。
(6)向0.1mol/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=___________ 。
(1)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:

a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(3)已知常温时,a mol/L醋酸在水中与0.1 mol/L NaOH等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=
Ⅱ.结合下表回答下列问题(均为常温下的数据):
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
| HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
(5)pH相同的NaClO和CH3COOK溶液中,[c(Na+)-c(C1O-)]
(6)向0.1mol/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】按要求填空:
(1)试解释碳酸氢钠水溶液显碱性的原因_____________________________ 。(用离子方程式和文字叙述解释)
(2)CuSO4的水溶液呈酸性的原因是:________ (用离子方程式表示);实验室在配制CuSO4溶液时,需向CuSO4的溶液中加入少量硫酸,其目的是________ 。
(3)在25℃时,在浓度均为0.1mol/L的下列溶液中:①(NH4)2SO4②(NH4)2CO3③(NH4)2Fe(SO4)2④氨水,其中NH4+的物质的量浓度由小到大的顺序是________ (填序号)。
(4)用0.1mol·L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
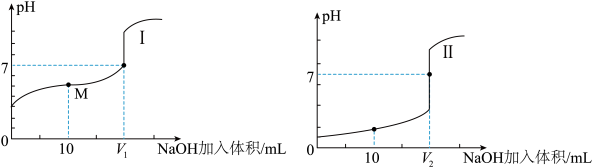
①滴定醋酸的曲线是___________ (填“I”或“Ⅱ”)。
②滴定开始前,0.1mol·L-1NaOH、0.1mol·L-1的盐酸和0.1mol·L-1醋酸三种溶液中由水电离出的c(H+)最大的是_______ 溶液。
③图I中,V=10时,溶液中的c(H+)_________ c(OH-)(填“>”、“=”或“<”,下同),c(Na+)_________ c(CH3COO-)。
(5)常温下两种溶液:a.pH=4NH4Cl,b.pH=4盐酸溶液,其中水电离出c(H+)之比为______ 。
(6)已知:25℃时KSP[Cu(OH)2]=2×10-20。常温下:某CuSO4溶液中c(Cu2+)=0.02mol∙L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为________ 。
(1)试解释碳酸氢钠水溶液显碱性的原因
(2)CuSO4的水溶液呈酸性的原因是:
(3)在25℃时,在浓度均为0.1mol/L的下列溶液中:①(NH4)2SO4②(NH4)2CO3③(NH4)2Fe(SO4)2④氨水,其中NH4+的物质的量浓度由小到大的顺序是
(4)用0.1mol·L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是
②滴定开始前,0.1mol·L-1NaOH、0.1mol·L-1的盐酸和0.1mol·L-1醋酸三种溶液中由水电离出的c(H+)最大的是
③图I中,V=10时,溶液中的c(H+)
(5)常温下两种溶液:a.pH=4NH4Cl,b.pH=4盐酸溶液,其中水电离出c(H+)之比为
(6)已知:25℃时KSP[Cu(OH)2]=2×10-20。常温下:某CuSO4溶液中c(Cu2+)=0.02mol∙L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)25℃时,0.05mol/L H2SO4溶液的pH= _________
(2)某温度下纯水的c(H+)=4.0×10-7mol/L,则此溶液中的c(OH-)=________ ;若温度不变,滴入稀盐酸,使c(H+)=2.0×10-4mol/L,则此溶液中由水电离产生的c(H+)= _________ 。
(3)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH>
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH> ________
(4)向明矾溶液中逐滴加入Ba(OH) 2溶液至硫酸根离子刚好完全沉淀时,溶液的pH________ 7(填>、<、=),离子反应总方程式________________________________________ 向明矾溶液中逐滴加入Ba(OH) 2溶液至铝离子刚好完全沉淀时,溶液的pH________ 7(填>、<、=),离子反应总方程式________________________________________
(2)某温度下纯水的c(H+)=4.0×10-7mol/L,则此溶液中的c(OH-)=
(3)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)
 Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH>
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH> (4)向明矾溶液中逐滴加入Ba(OH) 2溶液至硫酸根离子刚好完全沉淀时,溶液的pH
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)实验室在配制氯化铁溶液时,常出现少许浑浊,原因离子方程式表示为______ 。为防止出现这样的现象,在配制时常加入______
(2)根据下列2个热化学反应方程式:
FeO(s)+CO(g)= Fe(s)+CO2(g) △H= ―218kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学反应方程式:______
(4)常温下,等物质的量的浓度的①氨水 ②NH4HSO4 ③NH4Cl ④(NH4)2CO3⑤(NH4)2SO4溶液中,c(NH4+)由大到小的顺序为______ (填序号)
(2)根据下列2个热化学反应方程式:
FeO(s)+CO(g)= Fe(s)+CO2(g) △H= ―218kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学反应方程式:
(4)常温下,等物质的量的浓度的①氨水 ②NH4HSO4 ③NH4Cl ④(NH4)2CO3⑤(NH4)2SO4溶液中,c(NH4+)由大到小的顺序为
您最近一年使用:0次


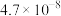
 ;
;