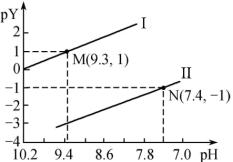
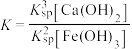25 °C时,向一定浓度的正盐Na2X溶液中逐滴加入盐酸,溶液的pH与pY (pY= -lgY,Y表示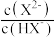 或
或 关系如图所示。
关系如图所示。
下列说法错误的是
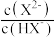 或
或 关系如图所示。
关系如图所示。
下列说法错误的是
A.曲线I表示pH与p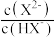 的变化关系 的变化关系 |
| B.NaHX溶液中c(H+)> c(OH- ) |
| C.Ka1(H2X)= 1.0 × 10-6.4 |
| D.当溶液呈中性时,c(Na+) = c(HX- )+2c(X2- )+c(Cl -) |
更新时间:2022-01-24 09:28:55
|
相似题推荐
单选题
|
较难
(0.4)
名校
解题方法
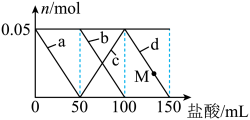
【推荐1】已知对于电离常数为Ka的某一元弱酸滴定过程中,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是( )


| A.由图可知,c1>c2>c3 |
| B.M点溶液中存在:c(H+)+c(HA)=c(OH-)+c(A-) |
| C.恰好中和时,溶液中离子浓度的大小关系:c(Na+)>c(A-)>c(OH-)>c(H+) |
D.由pH=7的溶液计算得:Ka= (V0是消耗的NaOH溶液的体积) (V0是消耗的NaOH溶液的体积) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】改变0.1mol/L的二元弱酸H2A溶液的pH。 溶液中的H2A。HA-、A2-的δ(X)随pH的变化如图所示。已知δ(X)= 。下列叙述正确的是
。下列叙述正确的是
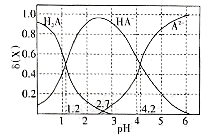
 。下列叙述正确的是
。下列叙述正确的是
| A.K1(H2A)的数量级是10-1 |
| B.pH=4.2时,c(HA-)=c(A2-)>c(H+)>c(OH-) |
| C.0.1mol/L的NaHA溶液pH<2.7 |
| D.在pH由1~4.2的过程中。水的电离程度变小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的一元酸HX溶液和HY溶液(两溶液水的电离程度:HX>HY,当Ka≤10-5时可以认为电解质达到电离平衡时的浓度近似等于起始浓度),其滴定曲线如图所示
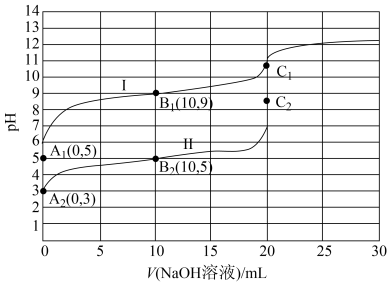
已知:弱电解质在溶液里达到电离平衡时,已电离的电解质分子数占起始时总分子数的百分数称为电离度,下列说法正确的是

已知:弱电解质在溶液里达到电离平衡时,已电离的电解质分子数占起始时总分子数的百分数称为电离度,下列说法正确的是
| A.曲线I和II对应的酸分别为HY和HX |
| B.相比曲线I,曲线II选用酚酞作终点指示剂误差更小 |
| C.把曲线上加入40mLNaOH溶液的点称为E点,则B1、C1和E三点溶液中由水电离出的c(H+)大小关系为C1>E>B1 |
| D.0.10mol/L弱酸HX和HY电离度之比为1:10 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下,0.1 mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。下列表述不正确的是
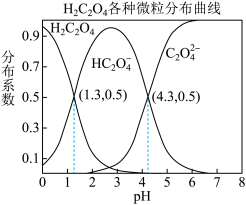

A.HC2O4- H++C2O42-,K=1×10-4.3 H++C2O42-,K=1×10-4.3 |
| B.将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液pH恰好为4.3 |
| C.常温下HF的K=1×10-3.45,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4- |
| D.在0.1 mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下,向20mL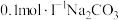 溶液中通入HCl气体(溶液体积变化忽略不计),溶液中含碳元素的各种微粒(
溶液中通入HCl气体(溶液体积变化忽略不计),溶液中含碳元素的各种微粒( 气体因逸出不考虑)物质的量分数(δ)随溶液pH变化的部分情况如图所示。下列说法正确的是
气体因逸出不考虑)物质的量分数(δ)随溶液pH变化的部分情况如图所示。下列说法正确的是
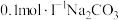 溶液中通入HCl气体(溶液体积变化忽略不计),溶液中含碳元素的各种微粒(
溶液中通入HCl气体(溶液体积变化忽略不计),溶液中含碳元素的各种微粒( 气体因逸出不考虑)物质的量分数(δ)随溶液pH变化的部分情况如图所示。下列说法正确的是
气体因逸出不考虑)物质的量分数(δ)随溶液pH变化的部分情况如图所示。下列说法正确的是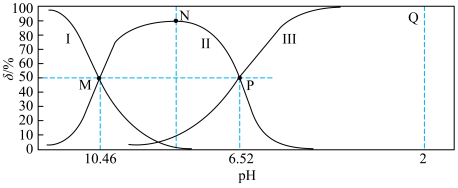
A.曲线Ⅰ表示 物质的量分数 物质的量分数 |
B. 水解的平衡常数为 水解的平衡常数为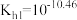 |
| C.水的电离程度:M<N<P<Q |
D.Q点存在: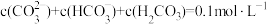 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】常温下,向20 mL0.01mol/LCH3COOH溶液中逐滴加入0.01mol/L的NaOH溶液,溶液中水电离的c(H+)随加入NaOH溶液的体积变化如下图所示,下列说法正确的是( )
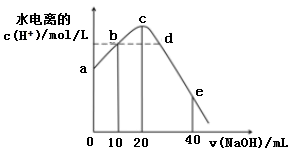

| A.b、d两点溶液的pH相同 |
| B.从a到c,对醋酸的电离既有促进作用也有抑制作用 |
| C.e 点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH)=0.01mol/L |
| D.从a→c的过程中,既存在pH=7的点也存在水电离的c(H+)=10-7mol/L的点 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在化学计量点附近,被测离子浓度产生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。现利用盐酸滴定某溶液中碳酸钠的含量,其电位滴定曲线如图所示。下列说法错误的是
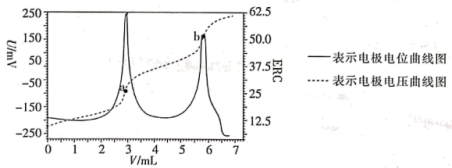

| A.根据图象可知,该滴定过程中不需滴加指示剂 |
B.a点溶液中存在: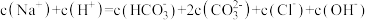 |
| C.b点溶液中溶质为NaCl,此时溶液一定呈中性 |
| D.从a点到b点的过程中,水的电离程度逐渐减小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】室温下,通过下列实验探究NaHCO3溶液的化学性质。已知Ka1、Ka2分别表示H2CO3的一级、二级电离常数。
下列有关说法不正确 的是
| 实验 | 实验操作和现象 |
| 1 | 用pH试纸测得0.1mol·L-1NaHCO3溶液pH约为8 |
| 2 | 向0.1mol·L-1NaHCO3溶液中通入一定量NH3,测得溶液pH约为10 |
| 3 | 向0.1mol·L-1NaHCO3溶液中滴加等体积0.2mol·L-1NaOH,观察不到实验现象 |
| 4 | 向0.1mol·L-1NaHCO3溶液中滴加少量澄清石灰水,产生白色沉淀 |
A.实验1的溶液中c(HCO )=108×Ka2×c(H2CO3) )=108×Ka2×c(H2CO3) |
B.实验2所得溶液中有c(NH )+c(H2CO3)>c(CO )+c(H2CO3)>c(CO ) ) |
| C.实验3中得溶液中水的电离程度随NaOH溶液的滴加先变大后变小 |
D.实验4中反应的离子反应方程式为2HCO +2OH-+Ca2+=CaCO3↓+CO +2OH-+Ca2+=CaCO3↓+CO +2H2O +2H2O |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】25℃时,NaCN溶液中CN-、HCN浓度所占分数( )随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的
)随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的
 )随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的
)随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的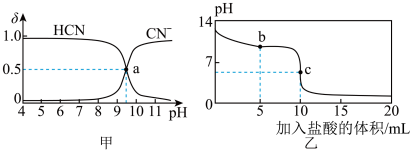
| A.图甲中pH=7的溶液:c(Cl-)=c(HCN) |
| B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol/L |
| C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+) |
| D.图乙中c点的溶液:c(Na+)+ c(H+)= c(HCN)+ c(OH-)+ c(CN-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】常温下,向20.0mL0.10mol·L-1NaOH溶液中滴入0.10mol·L-1的醋酸,溶液的pH与所加醋酸的体积关系如图所示。已知Ka(CH3COOH)=1.8×10-5,lg6=0.8.下列有关叙述不正确的是
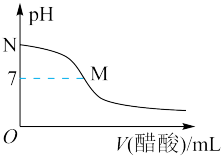

| A.该滴定过程应该选择酚酞作为指示剂 |
| B.M点对应的醋酸体积大于20.0mL |
| C.M点处的溶液中c(Na+)=c(CH3COO-)=c(H+)=c(OH-) |
| D.恰好中和时,溶液的pH约为8.7 |
您最近一年使用:0次


 的醋酸溶液稀释至
的醋酸溶液稀释至 ,稀释后溶液的
,稀释后溶液的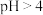
 的稀溶液在加水稀释的过程中,
的稀溶液在加水稀释的过程中,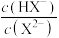 逐渐增大
逐渐增大 溶液中的粒子浓度关系:
溶液中的粒子浓度关系:
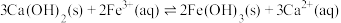 的平衡常数
的平衡常数