汽车尾气中的CO、NOx、硫氧化物、乙烯、丙烯等碳氢化合物会引起光化学烟雾、酸雨等污染;汽油抗震添加剂四乙基铅(熔点-136°C,极易挥发)的排放严重危害人体中枢神经系统。汽车尾气净化装置可将污染物中的CO和NO转化为无害气体,发生反应为2CO(g)+2NO(g)⇌N2(g)+2CO2(g) △H=-746.5kJ·mol-1。对于反应2CO(g)+2NO(g)⇌N2(g)+2CO2(g),下列说法正确的是
A.反应的平衡常数可表示为K=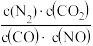 |
| B.使用催化剂可降低反应的活化能,减小反应的焓变 |
| C.增大压强能加快反应速率,提高反应物的平衡转化率 |
| D.用E总表示键能之和,该反应ΔH=E总(生成物)-E总(反应物) |
2022·江苏·一模 查看更多[10]
江苏省苏锡常镇四市2022届高三下学期教学情况调研(一)化学试题(已下线)押江苏卷第14题 反应机理、化学反应速率与平衡 -备战2022年高考化学临考题号押题(江苏卷)(已下线)押江苏卷第8题 化学反应速率与化学平衡、热化学 -备战2022年高考化学临考题号押题(江苏卷)(已下线)化学-2022年高考考前押题密卷(江苏卷)吉林省吉林市第一中学2021-2022学年高二下学期6月月考化学试题(理科创新班)江苏省昆山六校2022~2023学年高三上学期10月联合教学质量调研化学试题江苏省南京师范大学苏州实验学校2022-2023学年高二上学期9月月考化学试题湖南省茶陵县第一中学2023届高三第六次月考化学试题湖南省常德市第一中学2022-2023学年高三下学期第六次月考化学试题湖南省邵阳市第一中学2023届高三第五次月考化学试题
更新时间:2022-04-02 14:40:18
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】H2O2分解反应过程能量变化如下图所示,以下相关叙述正确的是( )
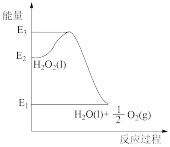

| A.1mol H2O2(l)键能总和比1mol H2O(1) +0.5mol O2键能总和大(E2-E1) |
| B.该反应是吸热过程 |
| C.使用MnO2催化剂,E3将降低 |
| D.2H2O2(l)=2H2O(l)+O2(g) △H= E1-E2 |
您最近一年使用:0次
【推荐2】自由基是化学键断裂时产生的含未成对电子的中间体,活泼自由基与氧气的反应一直是科研人员的关注点。HNO自由基与O2反应过程的能量变化如图所示,下列说法正确的是


| A.反应物的键能总和大于生成物的键能总和 |
| B.该历程中最大正反应的活化能E正=186.19 kJ∙mol-1 |
| C.两种产物中P2更稳定,相同条件下Z转化为产物的速率:v(P1)<v(P2) |
| D.使用催化剂能提高产物P2的平衡产率 |
您最近一年使用:0次
【推荐3】化学清洗剂NF3是一种温室气体,在大气中的寿命可长达740年之久。以下是几种化学键的键能(通常人们把断裂l mol化学键需要的能量看成该化学键的键能):
下列说法中正确的是
| 化学键 | N N N | F-F | N-F |
| 键能/kJ·mol-1 | 941.7 | 154.8 | 283.0 |
下列说法中正确的是
| A.过程N2(g)→2N(g)放出能量 |
| B.过程N(g)+3F(g)→NF3(g)吸收能量 |
| C.反应N2(g)+3F2(g)=2NF3(g),生成2 mol NF3(g)放出291.9kJ的热量 |
| D.NF3吸收能量后如果没有化学键的断裂与形成,仍可能发生化学反应 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】一定条件下,在密闭容器中,氮气与氢气合成氨气,能量变化曲线如图所示。下列说法正确的是


| A.加入催化剂,E1、E2都变小 |
B.N2(g)+3H2(g) 2NH3(g)+600kJ 2NH3(g)+600kJ |
| C.升温可以增大该反应的化学平衡常数 |
| D.通入1molN2和3molH2充分反应,放热小于92kJ |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】DMC被广泛应用与生产聚酯、合成医药及农药。科研人员提出催化合成DMC需经历三步反应,示意图如下:
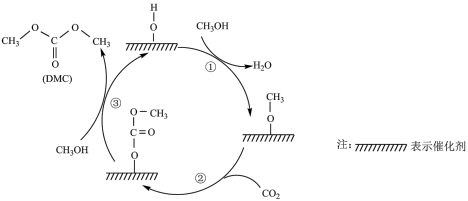
下列说法正确的是

下列说法正确的是
A.①、②、③中均有 的断裂 的断裂 |
B.生成DMC总反应为: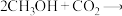  |
| C.该催化剂可有效提高反应物的平衡转化率 |
D.DMC与过量 溶液反应生成 溶液反应生成 和甲醇 和甲醇 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】在绝热恒容的密闭容器中,进行反应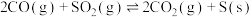
 ,对此反应下列说法正确的是
,对此反应下列说法正确的是
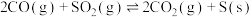
 ,对此反应下列说法正确的是
,对此反应下列说法正确的是| A.分离出S,正、逆反应速率均减小 |
| B.若混合气体的密度保持不变,则已达平衡 |
C.达平衡后,再充入一定量的 ,平衡常数保持不变 ,平衡常数保持不变 |
| D.从反应开始至平衡,容器内气体的压强保持不变 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】在一定条件下,发生反应2NO2 N2O4,该反应达到化学平衡后,升高温度,混合物的颜色变深。下列有关说法正确的是
N2O4,该反应达到化学平衡后,升高温度,混合物的颜色变深。下列有关说法正确的是
 N2O4,该反应达到化学平衡后,升高温度,混合物的颜色变深。下列有关说法正确的是
N2O4,该反应达到化学平衡后,升高温度,混合物的颜色变深。下列有关说法正确的是| A.正反应为放热反应 | B.正反应为吸热反应 |
| C.降温瞬间NO2的浓度增大 | D.降温后各物质的浓度不变 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
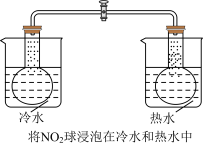
【推荐3】下列实验中,有关操作、现象及结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将盛有NH4Cl和消石灰的小烧杯放在表面有水的玻璃片上,用玻璃棒搅拌小烧杯中的药品 | 片刻后,玻璃片表面的水结冰,将玻璃片和小烧杯粘在一起 | NH4Cl和消石灰的反应属于吸热反应 |
| B | 将铁钉与电源正极相连,铜片与电源负极相连,把铁钉和铜片放入硫酸铜溶液中,接通直流电源 | 片刻后,铁钉表面附着一层红色固体 | 铁钉表面镀上一层铜 |
| C | 将NO2—N2O4平衡球的两端分别浸在盛有热水和冰水的烧杯中 | 球中气体颜色:热水中变浅,冰水中变深 | 升温使平衡向吸热方向移动 |
| D | 将盛有FeCl3饱和溶液的小烧杯用酒精灯加热一段时间 | 小烧杯中液体由棕黄色变为红褐色 | 有氢氧化铁胶体生成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】合成氨反应:3H2+N2 2NH3在密闭容器中进行。下列有关说法正确的是( )
2NH3在密闭容器中进行。下列有关说法正确的是( )
 2NH3在密闭容器中进行。下列有关说法正确的是( )
2NH3在密闭容器中进行。下列有关说法正确的是( )| A.达到化学平衡时,各物质的浓度不再改变 |
| B.其他条件不变,升高温度,不能增大反应的速率 |
| C.使用催化剂可使H2的转化率达到100% |
| D.其他条件不变,降低N2的浓度,可以增大反应的速率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】有催化剂的合成塔中发生的反应为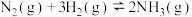
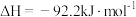 ,
, 。298K下合成氨反应的平衡常数K=4.1×106,下列说法
。298K下合成氨反应的平衡常数K=4.1×106,下列说法错误 的是
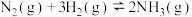
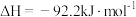 ,
, 。298K下合成氨反应的平衡常数K=4.1×106,下列说法
。298K下合成氨反应的平衡常数K=4.1×106,下列说法| A.合成氨反应在298K时进行得比较完全 |
| B.合成氨反应在298K时反应速率较快 |
| C.仅从K的值无法得知该反应的平衡转化率 |
| D.改变温度,K的值也会变化 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】已知某化学反应的平衡常数表达式为K=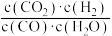 ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
下列有关叙述不正确的是( )
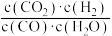 ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
A.该反应的化学方程式是CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g) |
| B.上述反应的正反应是放热反应 |
| C.若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态 |
D.若平衡浓度符合下列关系式: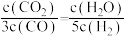 ,则此时的温度为1000℃ ,则此时的温度为1000℃ |
您最近一年使用:0次