利用间接转化法可将氮氧化物转化为化工产品以实现氮氧化物的充分利用。
已知①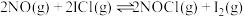

②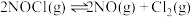

③
 。
。
若某温度下,向VL密闭容器中加入2molNO和2molICl发生上述反应,达平衡时容器中NOCl(g)为amol, 为bmol。下列说法不正确的是
为bmol。下列说法不正确的是
已知①
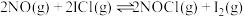

②
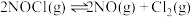

③

 。
。若某温度下,向VL密闭容器中加入2molNO和2molICl发生上述反应,达平衡时容器中NOCl(g)为amol,
 为bmol。下列说法不正确的是
为bmol。下列说法不正确的是A.若升高温度NOCl的物质的量增大,则 且 且 |
B.此时 的浓度为 的浓度为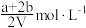 |
| C.若该密闭容器中气体颜色保持不变,说明各反应已达平衡状态 |
D.NO转化率为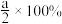 |
2022·河北唐山·三模 查看更多[5]
河北省唐山市2022届高三第三次模拟考试化学试题(已下线)专题09 化学反应速率、化学平衡-2022年高考真题模拟题分项汇编(已下线)专题10 化学反应速率与化学平衡-备战2023年高考化学母题题源解密(全国通用)进阶训练5山东省青岛第十七中学2022-2023学年高二上学期期末考试化学试题
更新时间:2022-05-21 09:06:11
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】在3个体积均为1L的恒容密闭容器中发生反应:SO2(g)+2NO(g)  2NO2(g)+S(s)。改变容器I的反应温度,平衡时c(NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c(NO2)与温度的关系如下图所示。下列说法正确的是
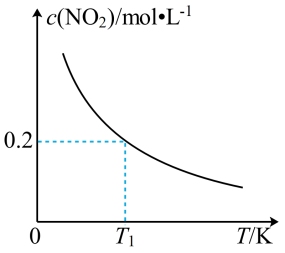
 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c(NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c(NO2)与温度的关系如下图所示。下列说法正确的是
| 容器 编号 | 温度/K | 起始物质的量/mol | |||
| SO2 | NO | NO2 | S | ||
| I | 0.5 | 0.6 | 0 | 0 | |
| II | T1 | 0.5 | 1 | 0.5 | 1 |
| III | T2 | 0.5 | 0.2 | 1 | 1 |
| A.该反应的ΔH>0 |
B.T1时,该反应的平衡常数为 |
| C.容器I与容器II均在T1时达到平衡,总压强之比小于1:2 |
| D.若T2<T1,达到平衡时,容器III中NO的体积分数小于40% |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】已知:[Co(H2O)6]2+呈粉红色,[CoCl4]2-呈蓝色,[ZnCl4]2-为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[Co(H2O)6]2++4Cl- [CoCl4]2-+6H2O,用该溶液做实验,溶液的颜色变化如下:
[CoCl4]2-+6H2O,用该溶液做实验,溶液的颜色变化如下:
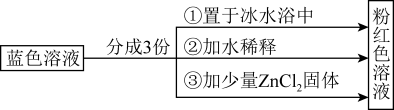
以下结论和解释正确的是
 [CoCl4]2-+6H2O,用该溶液做实验,溶液的颜色变化如下:
[CoCl4]2-+6H2O,用该溶液做实验,溶液的颜色变化如下:
以下结论和解释正确的是
| A.由实验①可推知正反应为放热反应 |
| B.等物质的量的[Co(H2O)6]2+和[CoCl4]2-中σ键数之比为9:4 |
| C.实验②是由于c(H2O)增大,导致平衡逆向移动 |
| D.由实验③可知配离子的稳定性:[ZnCl4]2-> [CoCl4]2- |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】一定温度下,在三个容积均为1 L的恒容密闭容器中按不同方式投入反应物,发生反应:2SO2(g) + O2(g) 2SO3(g) ΔH<0,测得反应的相关数据如下:
2SO3(g) ΔH<0,测得反应的相关数据如下:
下列说法错误的是
 2SO3(g) ΔH<0,测得反应的相关数据如下:
2SO3(g) ΔH<0,测得反应的相关数据如下:| 容器1 | 容器2 | 容器3 | |
| 反应温度T/K | T1 | T1 | T2(T2>T1) |
| 反应物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 | 2 mol SO2、1 mol O2 |
| 平衡c(SO3)/mol·L-1 | 1 mol·L-1 | c2 | c3 |
| 物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
| A.c2 > 2 mol·L-1 |
| B.α2(SO3) + α3(SO2) =1 |
C.T1时,若SO2、O2、SO3的浓度分别为1.2 mol·L-1、0.6 mol·L-1、1.2 mol·L-1,则此时 (正)> (正)> (逆) (逆) |
| D.若在恒压条件下,c2 = 1 mol·L-1 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】已知:
 ,向一恒温恒容的密闭容器中充入1mol A和3mol B发生反应,
,向一恒温恒容的密闭容器中充入1mol A和3mol B发生反应, 时达到平衡状态Ⅰ,在
时达到平衡状态Ⅰ,在 时改变某一条件,
时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法错误的是
时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法错误的是
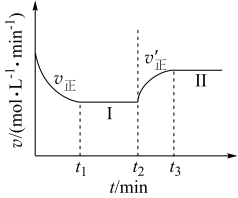

 ,向一恒温恒容的密闭容器中充入1mol A和3mol B发生反应,
,向一恒温恒容的密闭容器中充入1mol A和3mol B发生反应, 时达到平衡状态Ⅰ,在
时达到平衡状态Ⅰ,在 时改变某一条件,
时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法错误的是
时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法错误的是
| A.容器内压强不变,不能表明反应达到平衡 |
| B.t2时改变的条件:向容器中加入C |
C.平衡时A的体积分数 |
D.平衡常数 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】 温度下,
温度下,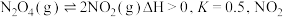 和
和 的消耗速率与浓度存在下列关系:
的消耗速率与浓度存在下列关系: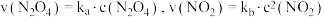 ,其中
,其中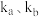 是与反应及温度有关的常数,其消耗速率与浓度的图象如图所示。下列有关说法错误的是
是与反应及温度有关的常数,其消耗速率与浓度的图象如图所示。下列有关说法错误的是

 温度下,
温度下,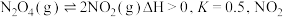 和
和 的消耗速率与浓度存在下列关系:
的消耗速率与浓度存在下列关系: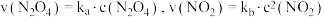 ,其中
,其中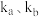 是与反应及温度有关的常数,其消耗速率与浓度的图象如图所示。下列有关说法错误的是
是与反应及温度有关的常数,其消耗速率与浓度的图象如图所示。下列有关说法错误的是
A.曲线 表示 表示 消耗速率与浓度关系 消耗速率与浓度关系 |
B. 平衡混合气中含有的 平衡混合气中含有的 原子的物质的量超过 原子的物质的量超过 |
C.若在 温度下, 温度下,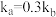 ,则 ,则 |
D.图中 点反应达到平衡 点反应达到平衡 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】研究表明,一定条件下活性炭可有效地将NO转化为 ,反应的热化学方程式为
,反应的热化学方程式为
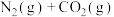 ,△H。已知:
,△H。已知: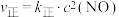 ,
,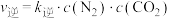 (
( 、
、 为速率常数,只与温度有关)。在某密闭容器中加入足量C(s)和一定量的NO发生上述反应,测得NO的转化率与温度的关系如图所示。下列说法正确的是
为速率常数,只与温度有关)。在某密闭容器中加入足量C(s)和一定量的NO发生上述反应,测得NO的转化率与温度的关系如图所示。下列说法正确的是

 ,反应的热化学方程式为
,反应的热化学方程式为
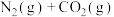 ,△H。已知:
,△H。已知: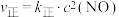 ,
,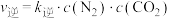 (
( 、
、 为速率常数,只与温度有关)。在某密闭容器中加入足量C(s)和一定量的NO发生上述反应,测得NO的转化率与温度的关系如图所示。下列说法正确的是
为速率常数,只与温度有关)。在某密闭容器中加入足量C(s)和一定量的NO发生上述反应,测得NO的转化率与温度的关系如图所示。下列说法正确的是
| A.该反应的△H>0 | B.q点处,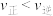 |
C.1050K温度下,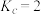 | D.1100K温度下,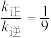 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
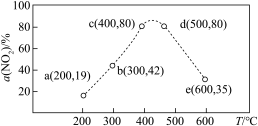
【推荐1】在恒容密闭容器中,通入一定量 和
和 发生反应:
发生反应: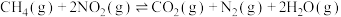 ,相同时间内测得
,相同时间内测得 的转化率与温度的关系如图。下列叙述正确的是
的转化率与温度的关系如图。下列叙述正确的是
 和
和 发生反应:
发生反应: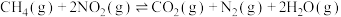 ,相同时间内测得
,相同时间内测得 的转化率与温度的关系如图。下列叙述正确的是
的转化率与温度的关系如图。下列叙述正确的是
A. 的平衡转化率:α(300℃)>α(200℃) 的平衡转化率:α(300℃)>α(200℃) |
| B.反应速率:b点>e点 |
| C.c点和d点均处于平衡状态 |
D.适当升温或增大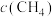 可提高c点时 可提高c点时 的转化率和反应速率 的转化率和反应速率 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】已知: 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: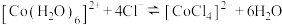 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:

以下结论和解释正确的是
 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: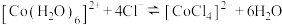 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
以下结论和解释正确的是
| A.由实验①可推知正反应为放热反应 |
B.等物质的量的 和 和 中 中 键数目之比为3∶2 键数目之比为3∶2 |
C.实验②是由于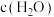 增大,导致平衡逆向移动 增大,导致平衡逆向移动 |
D.由实验③可知配离子的稳定性: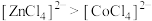 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】—定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)  N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。

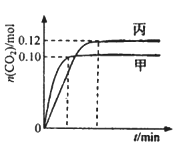
下列说法正确的是
 N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。

下列说法正确的是
| A.该反应的正反应为吸热反应 |
| B.乙容器中反应达到平衡时,N2的转化率小于50% |
| C.达到平衡时,乙容器中的压强一定大于甲容器的2倍 |
| D.丙容器中反应达到平衡后,再充入0.10mol NO和0.10mol CO2,此时v(正)<v(逆) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】一定温度下,把5molA和5molB混合盛入容积为2L的密闭容器里,发生如下反应: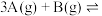
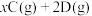 ,经10s反应达平衡,在此10s内C的平均反应速率为
,经10s反应达平衡,在此10s内C的平均反应速率为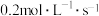 ,同时生成2molD,下列叙述中不正确的是
,同时生成2molD,下列叙述中不正确的是
 ,经10s反应达平衡,在此10s内C的平均反应速率为
,经10s反应达平衡,在此10s内C的平均反应速率为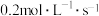 ,同时生成2molD,下列叙述中不正确的是
,同时生成2molD,下列叙述中不正确的是A. |
B.该温度下,此反应的平衡常数 |
| C.反应达到平衡状态时A的转化率为60% |
| D.反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强之比为6∶5 |
您最近一年使用:0次

 。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,
。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,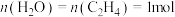 ,容器体积为
,容器体积为 )。下列分析不正确的是
)。下列分析不正确的是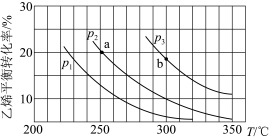

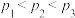
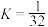

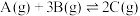
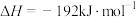 。向M、N中,分别通入x
。向M、N中,分别通入x A和y
A和y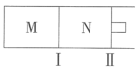
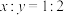 ,则平衡时M中的转化率:
,则平衡时M中的转化率:
 ,当M中放出热量172.8
,当M中放出热量172.8 时,A的转化率为90%
时,A的转化率为90% ,
, ,N中达到平衡时容积为2L,C为0.4
,N中达到平衡时容积为2L,C为0.4

