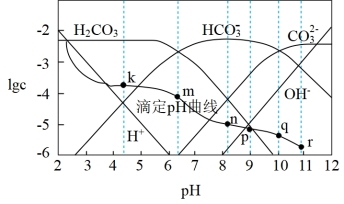
常温时,采用甲基橙和酚酞双指示剂,用盐酸滴定Na2CO3溶液,溶液中lgc(H2CO3)、lgc(HCO )、lgc(H+)、lgc(OH-)随溶液pH的变化及滴定曲线如图所示,下列说法不正确的是
)、lgc(H+)、lgc(OH-)随溶液pH的变化及滴定曲线如图所示,下列说法不正确的是
 )、lgc(H+)、lgc(OH-)随溶液pH的变化及滴定曲线如图所示,下列说法不正确的是
)、lgc(H+)、lgc(OH-)随溶液pH的变化及滴定曲线如图所示,下列说法不正确的是
| A.整个滴定过程中可先用酚酞再用甲基橙作指示剂 |
| B.n点的pH为m点和q点pH的平均值 |
C.r点溶液中c(OH-)=c(H+)+c(HCO )+2c(H2CO3) )+2c(H2CO3) |
| D.r点到k点对应的变化过程中,溶液中水的电离程度先减小后增大 |
2022·内蒙古呼和浩特·二模 查看更多[2]
更新时间:2022-05-22 21:04:33
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。下列说法中不正确的是
| A.D溶液的pH=7 |
| B.四种溶液相比,C溶液中水的电离程度最大 |
| C.A与C等体积混合后,溶液中有c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.B与D等体积混合后,溶液中有c(OH-)=c(CH3COOH)+c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】室温下向20mL 0.1mol/L一元酸HA溶液加入0.1mol/L 的NaOH 溶液,pH的变化曲线如图所示。下列说法正确的是


| A.a点所示溶液中c(HA)>c(A-) |
| B.b点时,消耗的NaOH溶液的体积大于20mL |
| C.c点时,2c(Na+)=3c(A-)+3c(HA) |
| D.水的电离程度:c>b>a |
您最近一年使用:0次
单选题
|
较难
(0.4)
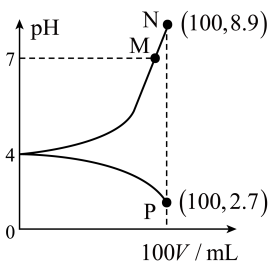
【推荐3】在25℃时,向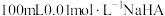 溶液中分别加入浓度均为
溶液中分别加入浓度均为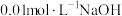 溶液和盐酸,混合溶液的pH随着所加溶液体积的变化如图所示。下列说法正确的是
溶液和盐酸,混合溶液的pH随着所加溶液体积的变化如图所示。下列说法正确的是
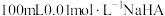 溶液中分别加入浓度均为
溶液中分别加入浓度均为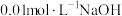 溶液和盐酸,混合溶液的pH随着所加溶液体积的变化如图所示。下列说法正确的是
溶液和盐酸,混合溶液的pH随着所加溶液体积的变化如图所示。下列说法正确的是
A.25℃时, 的第二步电离平衡常数约为 的第二步电离平衡常数约为 |
B. 溶液中: 溶液中: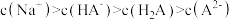 |
C.P点时溶液中存在: |
| D.水的电离程度:M>N>P |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是


| A.己二酸电离常数Ka1(H2X)约为10-4.4 |
B.曲线M表示pH与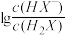 的变化关系 的变化关系 |
| C.当溶液中c(X2—)=c(HX—)时,溶液为碱性 |
D.当混合溶液呈中性时,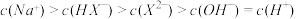 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加)。下列判断错误的是


| A.由图中信息可知,HA一定是强酸 |
| B.当V(MOH)=50.00 mL时,混合溶液中c(M+)+c(MOH)=0.01 mol·L-1 |
| C.N点对应的溶液中c(M+)=c(A-) |
| D.K点所对应的溶液中离子浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】亚氯酸钠是一种高效氧化剂漂白剂,主要用于 棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是
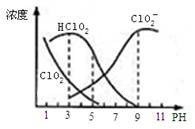

| A.亚氯酸钠在碱性条件下较稳定 |
| B.25℃时,HClO2的电离平衡常数的数值Ka=10-6 |
| C.使用该漂白剂的最佳pH为3 |
| D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,混合溶液中有则c(HClO2)+ 2c(H+)=c(ClO2-)+ 2c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】已知琥珀酸[(CH2COOH)2]是二元弱酸,以H2A代表其化学式,且pX代表-lg 或-lg
或-lg 。常温下,用NaOH溶液滴定琥珀酸溶液,混合溶液的pH与pX的关系如图所示。下列有关说法正确的是
。常温下,用NaOH溶液滴定琥珀酸溶液,混合溶液的pH与pX的关系如图所示。下列有关说法正确的是

 或-lg
或-lg 。常温下,用NaOH溶液滴定琥珀酸溶液,混合溶液的pH与pX的关系如图所示。下列有关说法正确的是
。常温下,用NaOH溶液滴定琥珀酸溶液,混合溶液的pH与pX的关系如图所示。下列有关说法正确的是
A.该溶液中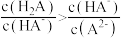 |
| B.水的电离程度d>c |
C.当 被完全中和时, 被完全中和时,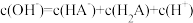 |
| D.滴定至c点时,c(Na+)<2c(A2-)+c(HA-) |
您最近一年使用:0次

 ),作为三羧酸循环(柠檬酸循环)的中间体,柠檬酸循环发生在所有需氧生物的新陈代谢中。现以酚酞作为指示剂,用0.1mol/L的NaOH滴定10mL0.1mol/L的柠檬酸,滴定过程中pH随NaOH体积的关系如图所示。已知柠檬酸
),作为三羧酸循环(柠檬酸循环)的中间体,柠檬酸循环发生在所有需氧生物的新陈代谢中。现以酚酞作为指示剂,用0.1mol/L的NaOH滴定10mL0.1mol/L的柠檬酸,滴定过程中pH随NaOH体积的关系如图所示。已知柠檬酸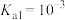 ,
,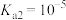 ,
,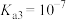 。下列说法正确的是
。下列说法正确的是
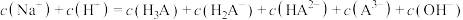
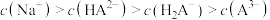
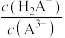 减小
减小


