室温下,通过下列实验探究0.1
 溶液的性质
溶液的性质
下列有关说法不正确 的是

 溶液的性质
溶液的性质| 实验 | 实验操作和现象 |
| 1 | 用pH试纸测定0.1mol·L-1Na2S溶液的pH,测得pH约为13 |
| 2 | 向0.1mol·L-1Na2S溶液中加入过量0.2mol·L-1AgNO3溶液,产生黑色沉淀 |
| 3 | 向0.1mol·L-1Na2S溶液中通入H2S至恰好完全反应,测得溶液pH约为9向0.1mol·L-1Na2S溶液中滴加几滴0.05mol·L-1HCl,观察不到气泡 |
| 4 | 向0.1mol·L-1Na2S溶液中滴加几滴0.05mol·L-1HCl,观察不到气泡 |
A.0.1  溶液中存在 溶液中存在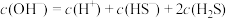 |
B.实验2反应静置后的上层清液中有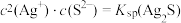 |
C.实验3得到的溶液中有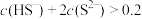  |
D.实验4现象说明 溶液与盐酸发生反应: 溶液与盐酸发生反应: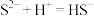 |
更新时间:2022-12-20 22:44:19
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】在25℃时,将1.0Lw mol·L-lCH3COOH溶液与0.1molNaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述正确的是


| A.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b |
| B.b点混合液中c(Na+)>c(CH3COO-) |
C.加入CH3COOH过程中,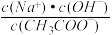 增大 增大 |
D.25℃时,CH3COOH的电离平衡常数Ka=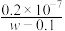 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下将 溶液滴加到
溶液滴加到 溶液中,混合溶液的
溶液中,混合溶液的 与离子浓度变化的关系如图所示(纵坐标为
与离子浓度变化的关系如图所示(纵坐标为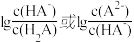 )。下列叙述错误的是
)。下列叙述错误的是
 溶液滴加到
溶液滴加到 溶液中,混合溶液的
溶液中,混合溶液的 与离子浓度变化的关系如图所示(纵坐标为
与离子浓度变化的关系如图所示(纵坐标为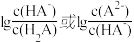 )。下列叙述错误的是
)。下列叙述错误的是 
A.曲线M表示pH与 的关系 的关系 |
B.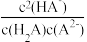 = 104 = 104 |
C.图中a点对应溶液中: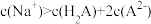 |
| D.溶液pH从2.6到6.6的过程中,水的电离程度逐渐增大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】向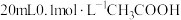 溶液中不断滴入等浓度的
溶液中不断滴入等浓度的 溶液,反应后溶液的
溶液,反应后溶液的 变化如图所示。下列分析
变化如图所示。下列分析错误 的是
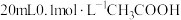 溶液中不断滴入等浓度的
溶液中不断滴入等浓度的 溶液,反应后溶液的
溶液,反应后溶液的 变化如图所示。下列分析
变化如图所示。下列分析
A.a点: |
B.b点: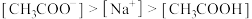 |
C.e点: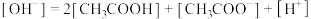 |
| D.水的电离程度由大到小的顺序为:c>d>b |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】有5种混合溶液,分别由等体积0.1mol/L的两种溶液混合而成:
(1)CH3COONa与NaHSO4 (2)CH3COONa与NaOH, (3)CH3COONa与NaCl
(4)CH3COONa与NaHCO3 (5)CH3COONa与NaHSO3
下列各项排序正确的是
(1)CH3COONa与NaHSO4 (2)CH3COONa与NaOH, (3)CH3COONa与NaCl
(4)CH3COONa与NaHCO3 (5)CH3COONa与NaHSO3
下列各项排序正确的是
| A.pH:(2)>(4)>(5)>(3)>(1) | B.c(CH3COOH):(1)>(3)>(5)>(4)>(2) |
| C.c(CH3COO-):(2)>(3)>(4)>(5)>(1) | D.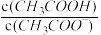 :(1)>(5)>(3)>(4)>(2) :(1)>(5)>(3)>(4)>(2) |
您最近一年使用:0次
单选题
|
较难
(0.4)
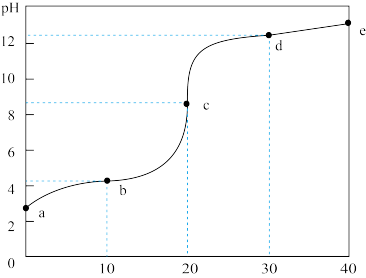
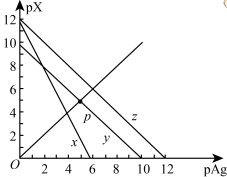
【推荐3】以0.10mol/L的氢氧化钠溶液滴定同浓度某一元酸HA的滴定曲线如图所示(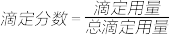 ),下列表述错误的是( )
),下列表述错误的是( )

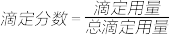 ),下列表述错误的是( )
),下列表述错误的是( )
| A.z点后存在某点,溶液中的水的电离程度和y点的相同 |
| B.a约为3.5 |
| C.z点处,c(Na+)>c(A-) |
| D.x点处的溶液中离子满足:cNa++cH+= c(A-)+c(OH-) |
您最近一年使用:0次
【推荐1】已知: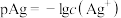 ,
,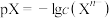 。
。 时,几种物质的
时,几种物质的 的值如下表:
的值如下表:
 、
、 、
、 的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
 ,
, 。
。 时,几种物质的
时,几种物质的 的值如下表:
的值如下表:| 化学式 |  |  |  |
| 颜色 | 白 | 浅黄 | 红 |
 |  |  |  |
 、
、 、
、 的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
A.图中x代表 曲线,z代表 曲线,z代表 曲线 曲线 |
B.298K时,在 和 和 的物质的量浓度均为 的物质的量浓度均为 的溶液中,滴入少量 的溶液中,滴入少量 的 的 溶液,首先产生的是红色沉淀 溶液,首先产生的是红色沉淀 |
| C.298K时,若增大p点的阴离子浓度,则y上的点沿曲线向上移动 |
D.298K时, 的平衡常数 的平衡常数 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】某温度下,25 mL含KX和KY的混合溶液,用0.1000 mol·L-1的硝酸银标准溶液对该混合液进行电位滴定(Y-与H+的反应可以忽略),获得电动势(E)和硝酸银标准溶液体积(V)的电位滴定曲线如图所示。

已知:Ⅰ.Ag+与Y-反应过程为:①Ag++2Y-=[AgY2]- 、②[AgY2]-+Ag+=2AgY↓
Ⅱ.该温度下,Ksp(AgY)=2 ×10-16,Ksp(AgX)=2 ×10-10。
下列说法不正确的是

已知:Ⅰ.Ag+与Y-反应过程为:①Ag++2Y-=[AgY2]- 、②[AgY2]-+Ag+=2AgY↓
Ⅱ.该温度下,Ksp(AgY)=2 ×10-16,Ksp(AgX)=2 ×10-10。
下列说法不正确的是
| A.若HY为弱酸,则从开始到B点,水的电离程度不断减小 |
| B.原混合溶液中c(KX )=0.02000 mol·L-1 |
C.若反应①的平衡常数为K1,反应②的平衡常数为K2,则 =Ksp2 (AgY) =Ksp2 (AgY) |
D.AgX(s)+Y-(aq)  AgY(s)+X-(aq)的平衡常数为106 AgY(s)+X-(aq)的平衡常数为106 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】常温下,将 1molCaC2O4粉末置于盛有500mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中Ca2+和 CO32-的浓度变化曲线如图所示,下列说法中不正确的是
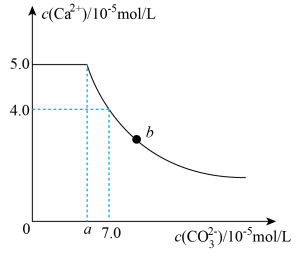

| A.a=5.6 |
| B.常温下,Ksp(CaC2O4)>Ksp(CaCO3) |
| C.b 点对应的溶液中,离子浓度关系为c(C2O42-) <c(CO32-) |
| D.若使 1molCaC2O4全部转化为 CaCO3,至少要加入 2.12molNa2CO3 |
您最近一年使用:0次

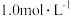 的某二元弱酸
的某二元弱酸 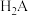 溶液中逐滴加入 NaOH 溶液,
溶液中逐滴加入 NaOH 溶液, A、
A、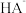 、
、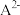 的物质的量分 数随 pH 的变化如图所示。下列叙述正确的是
的物质的量分 数随 pH 的变化如图所示。下列叙述正确的是
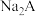 混合物溶于水,所得溶液中
混合物溶于水,所得溶液中 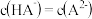
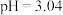 时,溶液中微粒浓度的大小关系为:
时,溶液中微粒浓度的大小关系为:
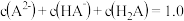
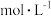
 ,溶液 pH 在
,溶液 pH 在  之间为最佳
之间为最佳

