电解质在水中可能存在电离平衡、水解平衡和溶解平衡。请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在_______ 种微粒,溶液中的电荷守恒关系式为_______ 。
(2)常温下,物质的量浓度均为0.1mol/L的六种溶液①NH4NO3②NaCl③Na2CO3④H2SO4⑤NaOH⑥CH3COONa,pH从大到小排列顺序为_______ 。
(3)常温下,CH3COONa的水溶液呈_______ (填“酸”“中”或“碱”)性,原因是_______ (用离子方程式表示);
(4)泡沫灭火器的灭火原理是_______ (用离子方程式表示)。
(5)碳酸钙是一种难溶物质(Ksp=2.8×10-9)。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的Na2CO3溶液与CaCl2溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_______ 。
(1)NaHCO3溶液中共存在
(2)常温下,物质的量浓度均为0.1mol/L的六种溶液①NH4NO3②NaCl③Na2CO3④H2SO4⑤NaOH⑥CH3COONa,pH从大到小排列顺序为
(3)常温下,CH3COONa的水溶液呈
(4)泡沫灭火器的灭火原理是
(5)碳酸钙是一种难溶物质(Ksp=2.8×10-9)。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的Na2CO3溶液与CaCl2溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
更新时间:2022-12-21 21:46:21
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】已知25℃时部分弱电解质的电离平衡常数如下表所示,请回答下列问题:
(1)25℃时 溶液显
溶液显___________ (填“酸性”、“碱性”或“中性”)。
(2)25℃时物质的量浓度均为0.1 mol/L的 、NaClO、
、NaClO、 三种溶液中pH最大的是
三种溶液中pH最大的是___________ (填化学式)。
(3)常温下,向HCN溶液中加入NaCN固体,则 将
将___________ (填“变大”“变小”或“不变”), 将
将___________ (填“变大”“变小”或“不变”)。
(4)向新制氯水中加入一定量的 固体,产生无色气体,氯水颜色消失,写出该反应的离子方程式:
固体,产生无色气体,氯水颜色消失,写出该反应的离子方程式:___________ 。
(5)25℃时,向 溶液中加入
溶液中加入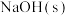 到
到 ,则
,则
___________ 。
| 化学式 |  |  | HCN | HClO |  |
| 电离常数 |  |  |  |  |   |
 溶液显
溶液显(2)25℃时物质的量浓度均为0.1 mol/L的
 、NaClO、
、NaClO、 三种溶液中pH最大的是
三种溶液中pH最大的是(3)常温下,向HCN溶液中加入NaCN固体,则
 将
将 将
将(4)向新制氯水中加入一定量的
 固体,产生无色气体,氯水颜色消失,写出该反应的离子方程式:
固体,产生无色气体,氯水颜色消失,写出该反应的离子方程式:(5)25℃时,向
 溶液中加入
溶液中加入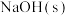 到
到 ,则
,则
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

(1)写出H2N2O2在水溶液中的电离方程式:___________ 。
(2)c点时溶液中各离子浓度由大到小的顺序为___________ 。
(3)b点时溶液中c(H2N2O2)___________ c(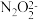 )。(填“>”“<”或“=”,下同)
)。(填“>”“<”或“=”,下同)
(4)a点时溶液中c(Na+)___________ c(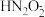 )+c(
)+c(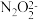 )。
)。
(5)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中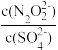 =
=___________ 。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]。
常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

(1)写出H2N2O2在水溶液中的电离方程式:
(2)c点时溶液中各离子浓度由大到小的顺序为
(3)b点时溶液中c(H2N2O2)
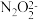 )。(填“>”“<”或“=”,下同)
)。(填“>”“<”或“=”,下同)(4)a点时溶液中c(Na+)
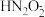 )+c(
)+c(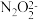 )。
)。(5)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中
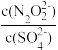 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;请回答下列问题:______ 。(请用离子方程式加文字进行描述)
(2)相同条件下,0.1mol•L﹣1NH4Al(SO4)2中c(NH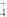 )
)______ (填“等于”、“大于”或“小于”)0.1mol•L﹣1 NH4HCO3中c( )。
)。
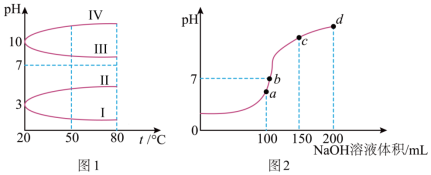
(3)如图1是0.1mol•L﹣1电解质溶液的pH随温度变化的图像
①其中符合0.1mol•L﹣1NH4Al(SO4)2的pH随温度变化的曲线是______ (填写序号)。
②20℃时,0.1mol•L﹣1NH4Al(SO4)2中2c( )﹣c(
)﹣c( )﹣3c(Al3+)=
)﹣3c(Al3+)= ______ mol•L﹣1(用数字表达式写出精确结果)。
(4)室温时,向100mL 0.1mol•L﹣1 NH4HSO4溶液中滴加0.1mol•L﹣1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图2中a、b、c、d四个点,水的电离程度最大是______ 点。
(2)相同条件下,0.1mol•L﹣1NH4Al(SO4)2中c(NH
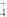 )
) )。
)。(3)如图1是0.1mol•L﹣1电解质溶液的pH随温度变化的图像
①其中符合0.1mol•L﹣1NH4Al(SO4)2的pH随温度变化的曲线是
②20℃时,0.1mol•L﹣1NH4Al(SO4)2中2c(
 )﹣c(
)﹣c( )﹣3c(Al3+)=
)﹣3c(Al3+)= (4)室温时,向100mL 0.1mol•L﹣1 NH4HSO4溶液中滴加0.1mol•L﹣1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图2中a、b、c、d四个点,水的电离程度最大是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如表。
表1.几种砷酸盐的Ksp
表2.工厂污染物排放浓度及允许排放标准
回答下列问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=________ mol·L-1。
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:
Ksp[Ca3(AsO4)2]=________ ,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4 mol·L-1,c(AsO43-)最大是______ mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3为弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4为弱酸),写出该反应的离子方程式:_______________________ 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为__________ ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为_______________________ 。
表1.几种砷酸盐的Ksp
| 难溶物 | Ksp | |
| Ca3(AsO4)2 | 6.8×10-19 | |
| AlAsO4 | 1.6×10-16 | |
| FeAsO4 | 5.7×10-21 | |
表2.工厂污染物排放浓度及允许排放标准
| 污染物 | H2SO4 | As |
| 浓度 | 28.42 g·L-1 | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
回答下列问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:
Ksp[Ca3(AsO4)2]=
(3)工厂排放出的酸性废水中的三价砷(H3AsO3为弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4为弱酸),写出该反应的离子方程式:
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知二元酸H2A在水中存在以下电离:H2A===H++HA-, HA- H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
(1)NaHA溶液呈________ 性,理由是________________________________________ 。
(2)某温度下,向10 mL 0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液VmL至中性,此时溶液中以下关系一定正确的是________ (填写字母)。
(3)已知难溶物CaA在水中存在溶解平衡;CaA(s) Ca2++A2-;ΔH>0。
Ca2++A2-;ΔH>0。
①温度升高时,Ksp________ (填“增大”、“减小”或“不变”,下同)。
②向浊液中通入HCl气体,c(Ca2+)________ ,原因是______________________ 。
(4)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3。甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________ ,Fe3+完全沉淀时溶液的pH为_______ ,通过计算确定上述方案______ (填“可行”或“不可行”)。
 H++A2-,试回答下列问题:
H++A2-,试回答下列问题:(1)NaHA溶液呈
(2)某温度下,向10 mL 0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液VmL至中性,此时溶液中以下关系一定正确的是
| A.c(Na+)+c(K+)=c(HA-)+c(A2-) | B.水的离子积Kw=c2(OH-) |
| C.V=10 | D.c(K+)<c(Na+) |
(3)已知难溶物CaA在水中存在溶解平衡;CaA(s)
 Ca2++A2-;ΔH>0。
Ca2++A2-;ΔH>0。①温度升高时,Ksp
②向浊液中通入HCl气体,c(Ca2+)
(4)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3。甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】弱电解质在水溶液中会部分电离产生阴、阳离子,部分盐在水溶液中会发生水解,难溶电解质能与水溶液中的离子建立沉淀溶解平衡。利用以,上化学反应原理解释生活生产中的相关问题:
(1)盐碱地(含较多NaCl、 )不利于作物生长,通过施加适量
)不利于作物生长,通过施加适量 可以降低土壤的碱性。用离子方程式表示降低土壤碱性的原因
可以降低土壤的碱性。用离子方程式表示降低土壤碱性的原因_______ 。
(2)酸碱中和滴定法在工农业生产和医药卫生等方面都有非常重要的作用。室温下用0.1 mol/L NaOH溶液滴定体积均为20.00 mL、浓度均为0.1 mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图:

①滴定前的上述三种溶液中,由水电离出的 最大的是
最大的是_______ 溶液(填化学式)。
②上述滴定曲线图为滴定醋酸溶液的是_______ (填“Ⅰ”或“Ⅱ”);用酚酞作指示剂,判断到达滴定终点的操作及现象_______ 。
③图中M点溶液的离子浓度由大到小顺序:_______ 。
(3)三氯化铁是一种重要的化合物,可用来腐蚀电路板。某温度下,腐蚀废液含有0.5 mol/L 和0.26 mol/L
和0.26 mol/L  ,使
,使 完全沉淀(
完全沉淀(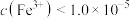 mol/L认为沉淀完全),而
mol/L认为沉淀完全),而 不沉淀,则需控制溶液pH的范围为
不沉淀,则需控制溶液pH的范围为_______ 。(某温度时,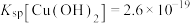 ;
;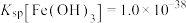 )
)
(1)盐碱地(含较多NaCl、
 )不利于作物生长,通过施加适量
)不利于作物生长,通过施加适量 可以降低土壤的碱性。用离子方程式表示降低土壤碱性的原因
可以降低土壤的碱性。用离子方程式表示降低土壤碱性的原因(2)酸碱中和滴定法在工农业生产和医药卫生等方面都有非常重要的作用。室温下用0.1 mol/L NaOH溶液滴定体积均为20.00 mL、浓度均为0.1 mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图:

①滴定前的上述三种溶液中,由水电离出的
 最大的是
最大的是②上述滴定曲线图为滴定醋酸溶液的是
③图中M点溶液的离子浓度由大到小顺序:
(3)三氯化铁是一种重要的化合物,可用来腐蚀电路板。某温度下,腐蚀废液含有0.5 mol/L
 和0.26 mol/L
和0.26 mol/L  ,使
,使 完全沉淀(
完全沉淀(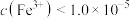 mol/L认为沉淀完全),而
mol/L认为沉淀完全),而 不沉淀,则需控制溶液pH的范围为
不沉淀,则需控制溶液pH的范围为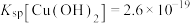 ;
;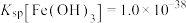 )
)
您最近一年使用:0次



