 是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。
是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。(1)用生物质热解气(主要成分CO、
 )将
)将 在高温下还原成单质硫。其中涉及到的主要反应有:
在高温下还原成单质硫。其中涉及到的主要反应有:反应1:
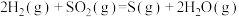
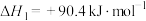
反应2:
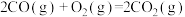
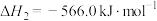
反应3:
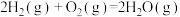
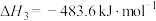
①反应1的平衡常数表达式为

②CO和
 反应生成S(g)和
反应生成S(g)和 的热化学方程式为
的热化学方程式为(2)烟气中
 可以用“亚硫酸铵吸收法”处理。
可以用“亚硫酸铵吸收法”处理。①吸收时发生反应的化学方程式为
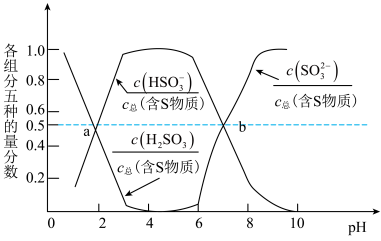
②测得25℃时溶液pH与各组份物质的量分数的变化关系如图所示。b点时溶液
 ,则
,则
(3)电解法脱硫:用
 溶液吸收
溶液吸收 气体,所得混合液用图所示的装置进行电解,可实现吸收剂的循环利用。
气体,所得混合液用图所示的装置进行电解,可实现吸收剂的循环利用。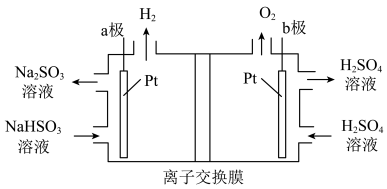
①图中a由极要连接电源的填
②电解装置中使用阴离子交换膜而不使用阳离子交换膜的原因是
22-23高二上·江苏南通·期末 查看更多[2]
更新时间:2023-01-16 13:56:36
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】二醚水蒸气重整制氢过程涉及的主要反应如下:
i CH3OCH3(g)+H2O(g)===2CH3OH(g) △H=+23. 6 kJ·mol-1
ii CH3OH (g)+ H2O (g)=CO2(g)+3H2(g) △H=+49. 5 kJ·mol-1
iii CH3OH (g)==CO(g)+2H2(g) △H=+90.7 kJ·mol-1
iv H2O (g)+ CO (g)= CO 2(g)+ H2(g) △H=-41.2 kJ·mol-1
各反应平衡常数与温度变化关系如下表:
(1)重整反应CH3OCH3(g)+3H2O(g)===2CO2(g)+6H2(g) △H=x kJ·mol-1,回答下列问题:
①x=___________
②有利于提高重整反应中CH3OCH3平衡转化率的条件为___________ (填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
③若在恒温刚性容器中进行重整反应,达到平衡时[CH3OCH3]=10mol·L-1,[H2O]=0.2mol·L-1,[H2]=10 mol·L-1,[CO2]=40 mol·L-1则反应温度约为___________ 。
④723K时,v=k·[c(CH3OCH3)]2·[c(CO2)]-1.5为重整反应速率方程。在相同条件下,c(CO2)分别为a、b、c时,H2产率随时间的变化关系如图,则a、b、c由小到大的顺序为___________ 。

(2)CO会造成燃料电池催化剂中毒,重整反应体系中CO体积分数随水醚比与温度的变化关系如右图。
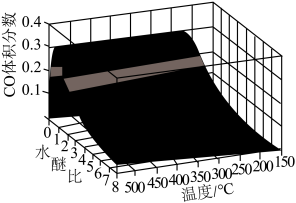
①相同温度下,水醚比为___________ 时CO体积分数最高。
②实际生产中选择反应温度为250℃的原因为___________ ;选择水醚比为3~6的原因为___________ 。
i CH3OCH3(g)+H2O(g)===2CH3OH(g) △H=+23. 6 kJ·mol-1
ii CH3OH (g)+ H2O (g)=CO2(g)+3H2(g) △H=+49. 5 kJ·mol-1
iii CH3OH (g)==CO(g)+2H2(g) △H=+90.7 kJ·mol-1
iv H2O (g)+ CO (g)= CO 2(g)+ H2(g) △H=-41.2 kJ·mol-1
各反应平衡常数与温度变化关系如下表:
温度 平衡常数 | 423K | 523K | 623K | 723K | 823K |
KⅠ | 1.7 10-2 10-2 | 5.8 10-2 10-2 | 1.3 10-1 10-1 | 2.3 10-1 10-1 | 3.4 10-1 10-1 |
KⅡ | 1.9×103 | 4.2×104 | 3.9×105 | 2.1×106 | 7.8×106 |
KⅢ | 2.5 | 4.7×102 | 1.8×104 | 2.8×105 | 2.2×106 |
KⅣ | 7.9×102 | 89 | 21 | 7.5 | 3.6 |
(1)重整反应CH3OCH3(g)+3H2O(g)===2CO2(g)+6H2(g) △H=x kJ·mol-1,回答下列问题:
①x=
②有利于提高重整反应中CH3OCH3平衡转化率的条件为
A.高温低压 B.低温高压 C.高温高压 D.低温低压
③若在恒温刚性容器中进行重整反应,达到平衡时[CH3OCH3]=10mol·L-1,[H2O]=0.2mol·L-1,[H2]=10 mol·L-1,[CO2]=40 mol·L-1则反应温度约为
④723K时,v=k·[c(CH3OCH3)]2·[c(CO2)]-1.5为重整反应速率方程。在相同条件下,c(CO2)分别为a、b、c时,H2产率随时间的变化关系如图,则a、b、c由小到大的顺序为

(2)CO会造成燃料电池催化剂中毒,重整反应体系中CO体积分数随水醚比与温度的变化关系如右图。

①相同温度下,水醚比为
②实际生产中选择反应温度为250℃的原因为
您最近一年使用:0次
【推荐2】建设生态美丽中国,减少雾霾等不利天气是重要内容,白磷燃烧、汽车尾气的排放都能造成雾霾天气。
I.已知白磷(P4)及其燃烧产物P4O10的结构如图所示。
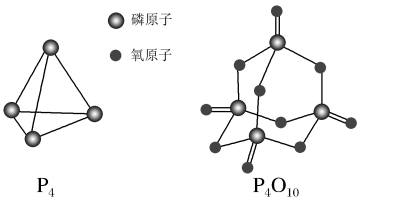
下列说法正确的是___
A.白磷通常保存在水中
B.白磷分子中的键角为109°28'
C.P4O10常用作干燥剂,它可以用来干燥氨气
D.P4O10中所有的原子都满足8电子稳定结构
II.已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g) 2NO(g) △H=+180.0kJ·mol-1
2NO(g) △H=+180.0kJ·mol-1
②CO(g)+ O2(g)
O2(g) CO2(g) △H2=-283.0kJ·mol-1
CO2(g) △H2=-283.0kJ·mol-1
③2CO(g)+2NO(g) N2(g)+2CO2(g) △H3
N2(g)+2CO2(g) △H3
请回答下列问题:(1)△H3=___ kJ·mol-1;
(2)下列能说明反应①已达平衡状态的是___ 。
A.单位时间内生成1molNO的同时消耗了0.5molN2
B.在绝热恒容的容器中,反应的平衡常数不再变化
C.在恒温恒容的容器中,混合气体的密度保持不变
D.在恒温恒压的容器中,NO的体积分数保持不变
(3)CO和NO2也可发生类似于反应③的变化,方程式为4CO(g)+2NO2(g) N2(g)+4CO2(g)△H<0。一定温度下,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,测得相关数据如表:
N2(g)+4CO2(g)△H<0。一定温度下,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,测得相关数据如表:

①5~10min,用CO2的浓度变化表示的反应速率为___ 。
②20min时,保持温度不变,继续向该容器中加入1.0molNO2和1.0molCO,在t1时反应再次达到平衡,则NO2的转化率比原平衡___ (填“增大”、“减小”或“不变”)。
③该温度下反应的化学平衡常数K=___ L·mol-1(保留两位有效数字)。
I.已知白磷(P4)及其燃烧产物P4O10的结构如图所示。

下列说法正确的是
A.白磷通常保存在水中
B.白磷分子中的键角为109°28'
C.P4O10常用作干燥剂,它可以用来干燥氨气
D.P4O10中所有的原子都满足8电子稳定结构
II.已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)
 2NO(g) △H=+180.0kJ·mol-1
2NO(g) △H=+180.0kJ·mol-1②CO(g)+
 O2(g)
O2(g) CO2(g) △H2=-283.0kJ·mol-1
CO2(g) △H2=-283.0kJ·mol-1③2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H3
N2(g)+2CO2(g) △H3请回答下列问题:(1)△H3=
(2)下列能说明反应①已达平衡状态的是
A.单位时间内生成1molNO的同时消耗了0.5molN2
B.在绝热恒容的容器中,反应的平衡常数不再变化
C.在恒温恒容的容器中,混合气体的密度保持不变
D.在恒温恒压的容器中,NO的体积分数保持不变
(3)CO和NO2也可发生类似于反应③的变化,方程式为4CO(g)+2NO2(g)
 N2(g)+4CO2(g)△H<0。一定温度下,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,测得相关数据如表:
N2(g)+4CO2(g)△H<0。一定温度下,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,测得相关数据如表:
①5~10min,用CO2的浓度变化表示的反应速率为
②20min时,保持温度不变,继续向该容器中加入1.0molNO2和1.0molCO,在t1时反应再次达到平衡,则NO2的转化率比原平衡
③该温度下反应的化学平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】甲醇是一种重要的可再生能源.
(1)已知2CH4(g)+O2(g)═2CO(g)+4H2(g) △H=akJ/mol
CO(g)+2H2(g)═CH3OH(g) △H=bkJ/mol
试写出由CH4和O2制取甲醇的热化学方程式:___ 。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g)⇌CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况.从反应开始到达平衡,用H2表示平均反应速率v(H2)=___ 。


(3)在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是___ 。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍数
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA___ PB(填“>、<、=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=___ L.
(1)已知2CH4(g)+O2(g)═2CO(g)+4H2(g) △H=akJ/mol
CO(g)+2H2(g)═CH3OH(g) △H=bkJ/mol
试写出由CH4和O2制取甲醇的热化学方程式:
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g)⇌CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况.从反应开始到达平衡,用H2表示平均反应速率v(H2)=


(3)在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是
A.H2的消耗速率等于CH3OH的生成速率的2倍数
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】汽车尾气中的主要污染物为NOx、CO等有害物质。目前,已研究出了多种消除汽车尾气污染的方法。
I.催化剂存在时用H2将NO还原为N2。
已知: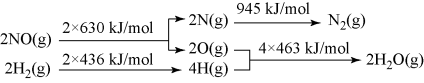
则H2还原NO生成氮气和水蒸气的热化学方程式是:______________________________ 。
II.用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) N2(g)+CO2(g)△H=QkJ/mol,在2L恒容密闭器中加入足量的C与NO反应,所得实验数据如表
N2(g)+CO2(g)△H=QkJ/mol,在2L恒容密闭器中加入足量的C与NO反应,所得实验数据如表
(1)写出该反应的平衡常数表达式________________________________________ 。
(2)结合表中数据,判断该反应的Q___ 0(填“>”或“<”),理由是________________________ 。.
(3)用电子式表示产物CO2的形成过程_________________________________________ 。
(4)判断该反应达到平衡的依据是____________
a.若容器内气体密度恒定,反应达到平衡状态
b.若容器内各气体浓度恒定,反应达到平衡状态
c.若容器内压强恒定,反应达到平衡状态
d.若2υ正(NO)=υ逆(N2),反应达到平衡状态
I.催化剂存在时用H2将NO还原为N2。
已知:

则H2还原NO生成氮气和水蒸气的热化学方程式是:
II.用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g)
 N2(g)+CO2(g)△H=QkJ/mol,在2L恒容密闭器中加入足量的C与NO反应,所得实验数据如表
N2(g)+CO2(g)△H=QkJ/mol,在2L恒容密闭器中加入足量的C与NO反应,所得实验数据如表| 实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
| 1 | 700 | 0.40 | 0.09 |
| 2 | 800 | 0.24 | 0.08 |
(1)写出该反应的平衡常数表达式
(2)结合表中数据,判断该反应的Q
(3)用电子式表示产物CO2的形成过程
(4)判断该反应达到平衡的依据是
a.若容器内气体密度恒定,反应达到平衡状态
b.若容器内各气体浓度恒定,反应达到平衡状态
c.若容器内压强恒定,反应达到平衡状态
d.若2υ正(NO)=υ逆(N2),反应达到平衡状态
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】合成氨是人工固氮的主要手段,对人类生存社会进步和经济发展都有着重大意义。该反应历程和能量变化如图所示,其中吸附在催化剂表面上的物种用“吸”标注。

(1)合成氨反应的平衡常数表达式为_______ 。
(2)下表为不同温度下合成氨反应的平衡常数。由此可推知,表中
_______ 572(填“>”“<”或“=”)。
(3)写出合成氨反应的热化学方程式_______ 。
(4)根据反应历程和能量变化图,计算反应 决速步骤的活化能
决速步骤的活化能_______ kJ/mol。
(5)在定温度下,将3mol 和1mol
和1mol 置于2L密闭容器中,反应达到平衡时,混合气体中
置于2L密闭容器中,反应达到平衡时,混合气体中 的体积分数为
的体积分数为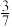 ,该反应的平衡常数K=
,该反应的平衡常数K=_______ 。(用分数表示)
(6)利用反应 构成电池,能实现有效消除氮氧化物的排放,减轻环境污染,装置如图所示:
构成电池,能实现有效消除氮氧化物的排放,减轻环境污染,装置如图所示:
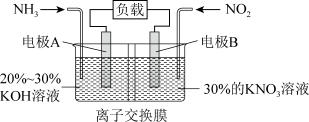
①写出电极B的电极反应式:_______ 。
②当溶液中有0.4mol 经过交换膜时,通过外电路的电子数为
经过交换膜时,通过外电路的电子数为_______ 。

(1)合成氨反应的平衡常数表达式为
(2)下表为不同温度下合成氨反应的平衡常数。由此可推知,表中

| T/K |  | 572 |  |
| K | 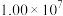 | 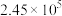 | 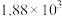 |
(4)根据反应历程和能量变化图,计算反应
 决速步骤的活化能
决速步骤的活化能(5)在定温度下,将3mol
 和1mol
和1mol 置于2L密闭容器中,反应达到平衡时,混合气体中
置于2L密闭容器中,反应达到平衡时,混合气体中 的体积分数为
的体积分数为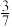 ,该反应的平衡常数K=
,该反应的平衡常数K=(6)利用反应
 构成电池,能实现有效消除氮氧化物的排放,减轻环境污染,装置如图所示:
构成电池,能实现有效消除氮氧化物的排放,减轻环境污染,装置如图所示:
①写出电极B的电极反应式:
②当溶液中有0.4mol
 经过交换膜时,通过外电路的电子数为
经过交换膜时,通过外电路的电子数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】工业合成氨反应为N2(g)+3H2(g)  2NH3(g),对其研究如下:
2NH3(g),对其研究如下:
(1)已知H—H键的键能为436 kJ·mol-1,N—H键的键能为391 kJ·mol-1,N≡N键的键能是945.6 kJ·mol-1,则上述反应的ΔH=_________________________ 。
(2)上述反应的平衡常数K的表达式为_______________________________ 。
若反应方程式改写为 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g),在该温度下的平衡常数K1=
NH3(g),在该温度下的平衡常数K1=_________ (用K表示)。
(3)在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
①该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正________ (填“大于”、“小于”或“等于”)v逆。
②由上表中的实验数据计算得到“浓度时间”的关系可用下图中的曲线表示,表示c(N2)t的曲线是_____ 。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)t的曲线上相应的点为________________ 。

 2NH3(g),对其研究如下:
2NH3(g),对其研究如下:(1)已知H—H键的键能为436 kJ·mol-1,N—H键的键能为391 kJ·mol-1,N≡N键的键能是945.6 kJ·mol-1,则上述反应的ΔH=
(2)上述反应的平衡常数K的表达式为
若反应方程式改写为
 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g),在该温度下的平衡常数K1=
NH3(g),在该温度下的平衡常数K1=(3)在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正
②由上表中的实验数据计算得到“浓度时间”的关系可用下图中的曲线表示,表示c(N2)t的曲线是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
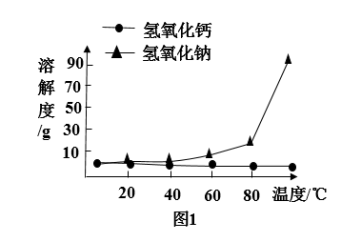
【推荐1】电解质溶液在生产、生活中应用广泛。CH3COOH、NaOH和CH3COONa是三种常见的电解质。
(1)CH3COOH在水溶液中的电离方程式为_______ 。常温下,pH=3的CH3COOH溶液中,由H2O电离产生的c(H+)=_______ mol·L-1。
(2)常温下,将物质的量浓度相同的CH3COOH溶液与NaOH溶液混合后,若溶液中c(Na+)=c(CH3COO—)。
①消耗CH3COOH溶液的体积_______ NaOH溶液的体积(填“>”“<”或“=”)。
②所得溶液呈_______ (填“酸性”“中性”或“碱性”)。
③向所得溶液中滴加2滴甲基橙,再逐滴加入1mol·L-1稀盐酸,溶液pH变化趋势应如_______ 图所示(填“甲”“乙”“丙”或“丁”),该过程中溶液的颜色变化为_______ 。

(3)常温下,将0.2mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液pH<7。下列关系式正确的是_______(填标号)。
(1)CH3COOH在水溶液中的电离方程式为
(2)常温下,将物质的量浓度相同的CH3COOH溶液与NaOH溶液混合后,若溶液中c(Na+)=c(CH3COO—)。
①消耗CH3COOH溶液的体积
②所得溶液呈
③向所得溶液中滴加2滴甲基橙,再逐滴加入1mol·L-1稀盐酸,溶液pH变化趋势应如

(3)常温下,将0.2mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液pH<7。下列关系式正确的是_______(填标号)。
| A.c(Na+)= c (CH3COO—)+ c (CH3COOH) |
| B. c (OH—)+c(CH3COO—)=c(H+)+c(CH3COOH) |
| C.c(CH3COO—)>c(Na+)>c(CH3COOH)>c(H+)>c(OH—) |
| D.c(CH3COO—)+c(CH3COOH)=0.1mol·L-1 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】研究电解质在水溶液中的平衡能了解它的存在形式。已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的下列四种溶液:①CH3COONa②Na2CO3③NaCN④NaHCO3 pH由小到大排列的顺序是___________。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___________。
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:___________ 。
(4)标准状况下将2.24LCO2,通入100mL2mol·L-1NaOH溶液中,所得溶液显___________ 性(填“酸”“碱”“中”),请用离子方程式解释原因:___________ 。用该溶液中微粒的浓度符号完成下列等式:c(Na+)+c(H+)=___________ 。
(5)25℃,氨水的浓度为2.0mol·L-1,溶液中的c(OH-)=___________ mol·L-1。根据已知条件可以推断,醋酸铵溶液显___________ 性(填“酸”“碱”“中”)。
| 化学式 | CH3COOH | H2CO3 | HCN | NH3·H2O |
| 电离平衡常数 | 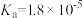 | 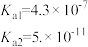 | 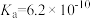 | 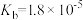 |
(1)物质的量浓度均为0.1mol·L-1的下列四种溶液:①CH3COONa②Na2CO3③NaCN④NaHCO3 pH由小到大排列的顺序是___________。
| A.①②③④ | B.①④③② |
| C.①④②③ | D.④①③② |
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___________。
A.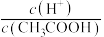 | B.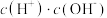 |
C. | D. |
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:
(4)标准状况下将2.24LCO2,通入100mL2mol·L-1NaOH溶液中,所得溶液显
(5)25℃,氨水的浓度为2.0mol·L-1,溶液中的c(OH-)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】根据化学平衡理论,请回答下列几个问题:
(1)某温度(t℃)时,水中c(H+)和c(OH-)的关系如图所示,a点水的离子积Kw=____ 。该温度下,pH=12的NaOH溶液与pH=2的H2SO4溶液等体积混合,溶液显____ (填“酸”、“碱”或“中”)性。

(2)向含有酚酞的0.1mol·L-1的氨水中加入少量NH4Cl固体,观察到的现象是____ ,请结合离子方程式分析产生该现象的主要原因是:____ 。
(3)将体积相等的NaOH稀溶液和CH3COOH溶液混合,若溶液呈中性,则溶液中c(Na+)____ c(CH3COO-)(填“>”、“<”或“=”),则混合前c(NaOH)____ c(CH3COOH)(填“>”、“<”或“=”)。
(4)为配制SbCl3溶液,取少量SbCl3固体溶于2~3mL水中,观察到有白色沉淀生成,为避免出现该现象,配制SbCl3溶液的正确方法是____ 。
(5)25℃时,已知Ksp[Cu(OH)2]=2×10-20,要使c(Cu2+)=0.2mol·L-1溶液中的Cu2+沉淀较完全[残留在溶液中的c(Cu2+)降低到2×10-4mol·L-1],则应加入NaOH溶液调节pH为____ 。
(6)用可溶性碳酸盐,可以浸取CaSO4固体,则溶液浸取过程中会发生反应:CaSO4(s)+CO (aq)
(aq) CaCO3(s)+SO
CaCO3(s)+SO (aq)。已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为
(aq)。已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为____ (计算结果保留三位有效数字)。
(1)某温度(t℃)时,水中c(H+)和c(OH-)的关系如图所示,a点水的离子积Kw=

(2)向含有酚酞的0.1mol·L-1的氨水中加入少量NH4Cl固体,观察到的现象是
(3)将体积相等的NaOH稀溶液和CH3COOH溶液混合,若溶液呈中性,则溶液中c(Na+)
(4)为配制SbCl3溶液,取少量SbCl3固体溶于2~3mL水中,观察到有白色沉淀生成,为避免出现该现象,配制SbCl3溶液的正确方法是
(5)25℃时,已知Ksp[Cu(OH)2]=2×10-20,要使c(Cu2+)=0.2mol·L-1溶液中的Cu2+沉淀较完全[残留在溶液中的c(Cu2+)降低到2×10-4mol·L-1],则应加入NaOH溶液调节pH为
(6)用可溶性碳酸盐,可以浸取CaSO4固体,则溶液浸取过程中会发生反应:CaSO4(s)+CO
 (aq)
(aq) CaCO3(s)+SO
CaCO3(s)+SO (aq)。已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为
(aq)。已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】氯碱厂电解饱和食盐水溶液制取氢氧化钠的工艺流程示意图如下:

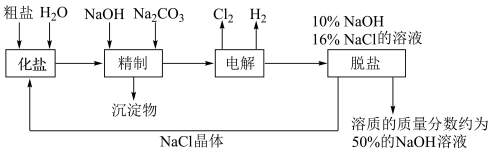
依据上图,完成下列填空:
(1)工业食盐水中含CaCl2、MgCl2杂质,精制过程中发生反应的化学方程式为___________ 、___________ 。
(2)如果粗盐中SO 离子含量较高,必须添加钡试剂除去SO
离子含量较高,必须添加钡试剂除去SO ,该钡试剂可以是
,该钡试剂可以是___________
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(3)为了有效地除去Ca2+、Mg2+、SO 离子,加入试剂的合理顺序为
离子,加入试剂的合理顺序为___________
A.先加入NaOH ,后加入Na2CO3,再加入钡试剂
B.先加入NaOH ,后加入钡试剂,再加入Na2CO3
C.先加入钡试剂,后加入NaOH,再加入Na2CO3
(4)在除杂过程中,要加稍过量的NaOH溶液,如何判断NaOH溶液已过量___________ ?
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过___________ 、冷却、___________ (填写操作名称)除去NaCl。
(6)用上述方法得到氯化钠,配制氯化钠饱和溶液进行如下图所示电解实验。
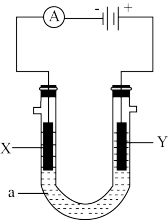 (a—饱和食盐水)
(a—饱和食盐水)
①写出该电解反应的化学方程式___________ 。
②电解时,将Y极(阳极)生成的物质通入盛有NaI溶液的试管中,再加入四氯化碳充分振荡,最后观察到的现象是___________ 。


依据上图,完成下列填空:
(1)工业食盐水中含CaCl2、MgCl2杂质,精制过程中发生反应的化学方程式为
(2)如果粗盐中SO
 离子含量较高,必须添加钡试剂除去SO
离子含量较高,必须添加钡试剂除去SO ,该钡试剂可以是
,该钡试剂可以是A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(3)为了有效地除去Ca2+、Mg2+、SO
 离子,加入试剂的合理顺序为
离子,加入试剂的合理顺序为A.先加入NaOH ,后加入Na2CO3,再加入钡试剂
B.先加入NaOH ,后加入钡试剂,再加入Na2CO3
C.先加入钡试剂,后加入NaOH,再加入Na2CO3
(4)在除杂过程中,要加稍过量的NaOH溶液,如何判断NaOH溶液已过量
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过
(6)用上述方法得到氯化钠,配制氯化钠饱和溶液进行如下图所示电解实验。
 (a—饱和食盐水)
(a—饱和食盐水)①写出该电解反应的化学方程式
②电解时,将Y极(阳极)生成的物质通入盛有NaI溶液的试管中,再加入四氯化碳充分振荡,最后观察到的现象是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】以天青石(主要成分为 ,还含有少量
,还含有少量 和
和 杂质)为原料生产具有光催化活性的钛酸锶
杂质)为原料生产具有光催化活性的钛酸锶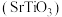 ,工艺流程如下:
,工艺流程如下: 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(2)“酸浸”时产生的有毒气体 可用
可用 溶液吸收,写出该反应的离子方程式
溶液吸收,写出该反应的离子方程式___________ 。
(3)“除杂”的方法是将溶液升温至95℃,同时加入 溶液调节
溶液调节 。经过“一系列操作”,包括:
。经过“一系列操作”,包括:___________ ,收滤液___________ ,即可得到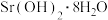 晶体。“滤渣”的成分为
晶体。“滤渣”的成分为___________ 。
(4)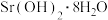 经“转化”、“共沉淀”,过滤、洗涤、干燥得到纯净的草酸氧钛锶晶体
经“转化”、“共沉淀”,过滤、洗涤、干燥得到纯净的草酸氧钛锶晶体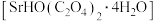 。请简述洗涤的操作
。请简述洗涤的操作___________ 。草酸氧钛锶晶体经“煅烧”分解成钛酸锶,写出对应的化学方程式___________ 。
(5)光催化技术具有高效、节能的优点,利用钛酸锶光催化还原 有利于实现“碳中和”,其质理如图2所示,写出铂电极的电极反应式
有利于实现“碳中和”,其质理如图2所示,写出铂电极的电极反应式___________ 。___________ 。
A.电解法 B.热分解法 C.热还原法
 ,还含有少量
,还含有少量 和
和 杂质)为原料生产具有光催化活性的钛酸锶
杂质)为原料生产具有光催化活性的钛酸锶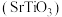 ,工艺流程如下:
,工艺流程如下: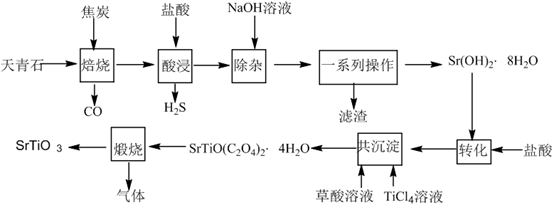
 发生反应的化学方程式为
发生反应的化学方程式为(2)“酸浸”时产生的有毒气体
 可用
可用 溶液吸收,写出该反应的离子方程式
溶液吸收,写出该反应的离子方程式(3)“除杂”的方法是将溶液升温至95℃,同时加入
 溶液调节
溶液调节 。经过“一系列操作”,包括:
。经过“一系列操作”,包括: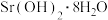 晶体。“滤渣”的成分为
晶体。“滤渣”的成分为(4)
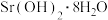 经“转化”、“共沉淀”,过滤、洗涤、干燥得到纯净的草酸氧钛锶晶体
经“转化”、“共沉淀”,过滤、洗涤、干燥得到纯净的草酸氧钛锶晶体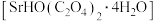 。请简述洗涤的操作
。请简述洗涤的操作(5)光催化技术具有高效、节能的优点,利用钛酸锶光催化还原
 有利于实现“碳中和”,其质理如图2所示,写出铂电极的电极反应式
有利于实现“碳中和”,其质理如图2所示,写出铂电极的电极反应式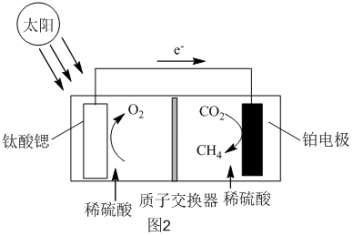
A.电解法 B.热分解法 C.热还原法
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如6Ag(s)+O3(g)=3Ag2O(s);△H=-235.8kJ·mol-1,已知2Ag2O(s)=4Ag(s)+O2(g);△H=+62.2kJ·mol-1,则O3转化为O2的热化学方程式为_________ 。
(2)臭氧在水中易分解,臭氧的浓度减少一半所需的时间如下图所示。

pH增大能加速O3分解,表明对O3分解起催化作用的是_________ 。
(3)电解法臭氧发生器具有臭氧浓度高、成分纯净、在水中溶解度高的优势,在医疗、食品加工与养殖业及家庭方面具有广泛应用前景。科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,其电极反应式为_______ ;阴极附近的氧气则生成过氧化氢,其电极反应式为_______ 。
(4)为测定大气中臭氧(O3)含量,将0℃、1.01×105Pa的空气VL慢慢通过足量KI溶液,使臭氧完全反应;然后将所得溶液用amL cmol/L的Na2S2O2溶液进行滴定恰好到达终点。
①O3与KI溶液反应生成两种单质,则反应的化学方程式_______ 。
②空气中臭氧的体积分数为_______ 。(已知:2Na2S2+I2=Na2S4O6+2NaI)
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如6Ag(s)+O3(g)=3Ag2O(s);△H=-235.8kJ·mol-1,已知2Ag2O(s)=4Ag(s)+O2(g);△H=+62.2kJ·mol-1,则O3转化为O2的热化学方程式为
(2)臭氧在水中易分解,臭氧的浓度减少一半所需的时间如下图所示。

pH增大能加速O3分解,表明对O3分解起催化作用的是
(3)电解法臭氧发生器具有臭氧浓度高、成分纯净、在水中溶解度高的优势,在医疗、食品加工与养殖业及家庭方面具有广泛应用前景。科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,其电极反应式为
(4)为测定大气中臭氧(O3)含量,将0℃、1.01×105Pa的空气VL慢慢通过足量KI溶液,使臭氧完全反应;然后将所得溶液用amL cmol/L的Na2S2O2溶液进行滴定恰好到达终点。
①O3与KI溶液反应生成两种单质,则反应的化学方程式
②空气中臭氧的体积分数为
您最近一年使用:0次



