 的排放是形成酸雨的重要原因之一,工业上可采用多种方法减少
的排放是形成酸雨的重要原因之一,工业上可采用多种方法减少 的排放。回答下列问题:
的排放。回答下列问题:(1)
 还原法:
还原法:已知:
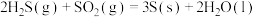
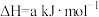 ;
; 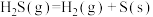
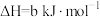 。
。则
 和
和 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为(2)碘循环法的循环过程如图所示,反应①的化学方程式为
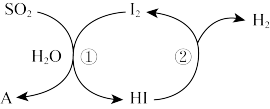
(3)钠碱循环法:用
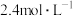 的
的 溶液吸收尾气中的
溶液吸收尾气中的 。
。①上述
 溶液中:
溶液中: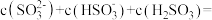
 ;
;
②室温下,当溶液的pH约为6时,
 溶液吸收
溶液吸收 能力显著下降,此时溶液中
能力显著下降,此时溶液中 的浓度是
的浓度是 ,则此时溶液中各离子浓度由大到小的顺序为
,则此时溶液中各离子浓度由大到小的顺序为(4)氨石灰水法:
第一步:用过量的浓氨水吸收
 ,并在空气中氧化;
,并在空气中氧化;第二步:加入澄清石灰水。
已知:室温下,
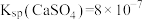 ,
,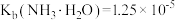 ,则室温下,第二步反应:
,则室温下,第二步反应: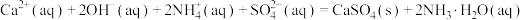 的平衡常数
的平衡常数
更新时间:2023-01-15 20:29:33
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】MgH2和Mg2Cu可用作贮氢材料,MgO可用作炉膛内脱硫脱硝的试剂。
(1)MgH2是一种离子化合物,其电子式为_______________ 。
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2,该反应的化学方程式为_____________ 。
(3)已知MgH2的有关热化学方程式如下:
MgH2(s) =Mg(s)+H2(g) △H1=+74.4kJ•mol-1;
H2(g)+l/2O2(g)=H2O(g) △H2=-241.8 kJ•mol-1;
Mg(s)+l/2O2(g)=MgO(s) △H3=-141.6 kJ•mol-1。
①氢化镁燃烧生成氧化镁和水蒸气的热化学方程式为______________ 。
②MgH2作贮氢材料时,单位贮氢材料释放出氢气的质量随时间的变化如图甲所示,其中温度T1、T2、T3由小到大的顺序为__________________ 。
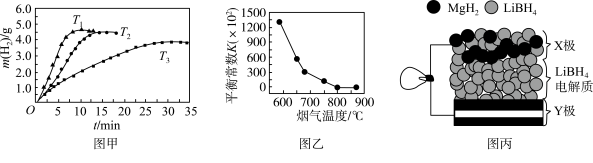
(4)炉膛内脱除 SO2、NO 反应为2MgO(s)+2SO2(g)+2NO(g) 2MgSO4(s)+N2(g) △H =akJ/mol,其平衡常数与温度的关系如图乙所示。
2MgSO4(s)+N2(g) △H =akJ/mol,其平衡常数与温度的关系如图乙所示。
①上述反应的平衡常数表达式为K=_________ 。
②a_________ 0(填“>”或“<”)。
(5)全固态锂离子电池的结构如图丙所示,放电时电池反应为2Li+MgH2=Mg+2LiH。放电时,X极的电极反应式为_________ 。充电时,Y极的电极反应式为______________ 。
(1)MgH2是一种离子化合物,其电子式为
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2,该反应的化学方程式为
(3)已知MgH2的有关热化学方程式如下:
MgH2(s) =Mg(s)+H2(g) △H1=+74.4kJ•mol-1;
H2(g)+l/2O2(g)=H2O(g) △H2=-241.8 kJ•mol-1;
Mg(s)+l/2O2(g)=MgO(s) △H3=-141.6 kJ•mol-1。
①氢化镁燃烧生成氧化镁和水蒸气的热化学方程式为
②MgH2作贮氢材料时,单位贮氢材料释放出氢气的质量随时间的变化如图甲所示,其中温度T1、T2、T3由小到大的顺序为

(4)炉膛内脱除 SO2、NO 反应为2MgO(s)+2SO2(g)+2NO(g)
 2MgSO4(s)+N2(g) △H =akJ/mol,其平衡常数与温度的关系如图乙所示。
2MgSO4(s)+N2(g) △H =akJ/mol,其平衡常数与温度的关系如图乙所示。①上述反应的平衡常数表达式为K=
②a
(5)全固态锂离子电池的结构如图丙所示,放电时电池反应为2Li+MgH2=Mg+2LiH。放电时,X极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】以锌锰废电池中的碳包(含碳粉、Fe、Cu、Ag和 等物质)为原料回收
等物质)为原料回收 的工艺流程如下:
的工艺流程如下:
Ⅰ.将碳包中物质烘干,用足量稀 溶解金属单质,过滤,得滤渣a;
溶解金属单质,过滤,得滤渣a;
Ⅱ.将滤渣a在空气中灼烧,得到粗 ;
;
Ⅲ.向粗 中加入酸性
中加入酸性 溶液,
溶液, 溶解生成
溶解生成 ,有气体生成;
,有气体生成;
Ⅳ.向Ⅲ所得溶液(pH约为6)中缓慢滴加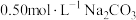 溶液(pH约为12),过滤,得滤渣b,其主要成分为
溶液(pH约为12),过滤,得滤渣b,其主要成分为 ;
;
Ⅴ.滤渣b经洗涤、干燥、灼烧,制得较纯的 。
。
(1)Ⅰ中Ag与足量稀 反应生成NO的化学方程式为
反应生成NO的化学方程式为___________ 。
(2)已知Ⅱ的灼烧过程中同时发生反应:
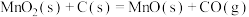
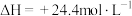

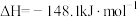
写出 和C反应生成MnO和
和C反应生成MnO和 的热化学方程式:
的热化学方程式:___________ 。
(3)将滤渣a在空气中灼烧的目的___________ 。
(4)Ⅲ中 溶解的离子方程式为
溶解的离子方程式为___________ ,溶解一定量的 ,
, 的实际消耗量比理论值高,用化学方程式解释原因:
的实际消耗量比理论值高,用化学方程式解释原因:___________ 。
(5)Ⅴ中 在空气中灼烧的化学方程式为
在空气中灼烧的化学方程式为___________ 。
 等物质)为原料回收
等物质)为原料回收 的工艺流程如下:
的工艺流程如下:Ⅰ.将碳包中物质烘干,用足量稀
 溶解金属单质,过滤,得滤渣a;
溶解金属单质,过滤,得滤渣a;Ⅱ.将滤渣a在空气中灼烧,得到粗
 ;
;Ⅲ.向粗
 中加入酸性
中加入酸性 溶液,
溶液, 溶解生成
溶解生成 ,有气体生成;
,有气体生成;Ⅳ.向Ⅲ所得溶液(pH约为6)中缓慢滴加
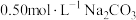 溶液(pH约为12),过滤,得滤渣b,其主要成分为
溶液(pH约为12),过滤,得滤渣b,其主要成分为 ;
;Ⅴ.滤渣b经洗涤、干燥、灼烧,制得较纯的
 。
。(1)Ⅰ中Ag与足量稀
 反应生成NO的化学方程式为
反应生成NO的化学方程式为(2)已知Ⅱ的灼烧过程中同时发生反应:
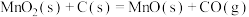
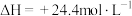

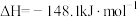
写出
 和C反应生成MnO和
和C反应生成MnO和 的热化学方程式:
的热化学方程式:(3)将滤渣a在空气中灼烧的目的
(4)Ⅲ中
 溶解的离子方程式为
溶解的离子方程式为 ,
, 的实际消耗量比理论值高,用化学方程式解释原因:
的实际消耗量比理论值高,用化学方程式解释原因:(5)Ⅴ中
 在空气中灼烧的化学方程式为
在空气中灼烧的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】我国提出“碳达峰”目标是在2030年前达到最高值,2060年前达到“碳中和”。因此,二氧化碳的综合利用尤为重要。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚( )也有广泛的应用。
)也有广泛的应用。
反应Ⅰ:
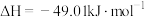
反应Ⅱ:
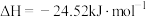
反应Ⅲ:
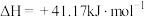
①结合计算分析反应 的自发性:
的自发性:___________ 。
②恒压、投料比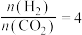 的情况下,不同温度下
的情况下,不同温度下 的平衡转化率和产物的选择性(选择性是指生成某物质消耗的
的平衡转化率和产物的选择性(选择性是指生成某物质消耗的 占
占 消耗总量的百分比)如下图所示:
消耗总量的百分比)如下图所示:
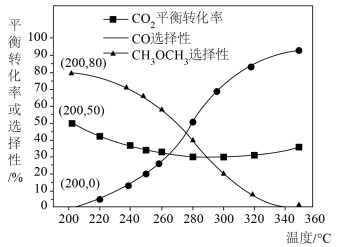
当温度超过 ,
, 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是___________ 。
③工业实际设计温度一般在 范围内变化,不能过高的原因是
范围内变化,不能过高的原因是___________ 。
(2)研究表明,在电解质水溶液中, 气体可被电化学还原。
气体可被电化学还原。
① 在碱性介质中电还原为正丙醇(
在碱性介质中电还原为正丙醇(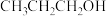 )的电极反应方程式为
)的电极反应方程式为___________ 。
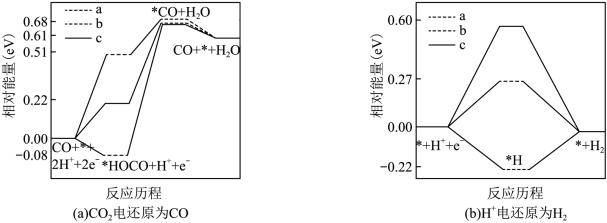
②在电解质水溶液中,三种不同催化剂( 、
、 、
、 )上
)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为___________ (用 、
、 、
、 字母排序)。
字母排序)。
(3) 参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( 、
、 表示乙苯分子中
表示乙苯分子中 或
或 原子的位置;
原子的位置; 、
、 为催化剂的活性位点,其中
为催化剂的活性位点,其中 位点带部分正电荷,
位点带部分正电荷,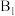 、
、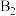 位点带部分负电荷)。
位点带部分负电荷)。

图中所示反应机理中步骤Ⅰ和步骤Ⅱ可描述为___________ 。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(
 )也有广泛的应用。
)也有广泛的应用。反应Ⅰ:

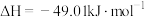
反应Ⅱ:

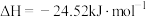
反应Ⅲ:

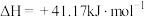
①结合计算分析反应
 的自发性:
的自发性:②恒压、投料比
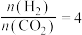 的情况下,不同温度下
的情况下,不同温度下 的平衡转化率和产物的选择性(选择性是指生成某物质消耗的
的平衡转化率和产物的选择性(选择性是指生成某物质消耗的 占
占 消耗总量的百分比)如下图所示:
消耗总量的百分比)如下图所示:
当温度超过
 ,
, 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是③工业实际设计温度一般在
 范围内变化,不能过高的原因是
范围内变化,不能过高的原因是(2)研究表明,在电解质水溶液中,
 气体可被电化学还原。
气体可被电化学还原。①
 在碱性介质中电还原为正丙醇(
在碱性介质中电还原为正丙醇(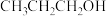 )的电极反应方程式为
)的电极反应方程式为②在电解质水溶液中,三种不同催化剂(
 、
、 、
、 )上
)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为 、
、 、
、 字母排序)。
字母排序)。
(3)
 参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( 、
、 表示乙苯分子中
表示乙苯分子中 或
或 原子的位置;
原子的位置; 、
、 为催化剂的活性位点,其中
为催化剂的活性位点,其中 位点带部分正电荷,
位点带部分正电荷, 、
、 位点带部分负电荷)。
位点带部分负电荷)。
图中所示反应机理中步骤Ⅰ和步骤Ⅱ可描述为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】氯化铁常用于污水处理、印染工业、电子工业等领域。氯化铁易升华、易潮解,某化学兴趣小组设计实验制备氯化铁并探究其性质,回答下列问题:
Ⅰ.制备 固体。
固体。
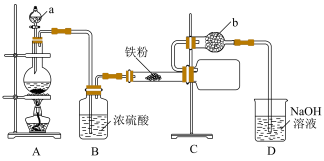
(1)仪器 的名称是
的名称是___________ ,仪器 中的试剂是
中的试剂是___________ 。
(2)装置 用浓盐酸和
用浓盐酸和 固体反应制备氯气,其反应的化学方程式为
固体反应制备氯气,其反应的化学方程式为___________ 。
(3)上述装置中有一处明显错误是___________ 。
Ⅱ.探究影响 水解平衡的因素。
水解平衡的因素。
提出假设:外界条件改变, 溶液水解平衡会发生移动
溶液水解平衡会发生移动
设计方案并完成实验
实验1:探究稀释 溶液对水解平衡移动的影响
溶液对水解平衡移动的影响
将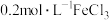 溶液分别稀释10倍和100倍,测定
溶液分别稀释10倍和100倍,测定 :
:
(4)实验证明稀释 溶液,水解平衡正向移动,结合表中数据,给出判断理由:
溶液,水解平衡正向移动,结合表中数据,给出判断理由:_______ 。
(5)计算实验ⅱ中 的水解度(转化率)为
的水解度(转化率)为______ (只列出计算式,忽略水自身电离的影响)。
实验2:探究温度对水解平衡移动的影响
已知: 水解程度越大,其溶液颜色越深,透光率越低。
水解程度越大,其溶液颜色越深,透光率越低。
分别将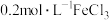 溶液和
溶液和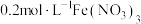 溶液持续加热,当温度上升至
溶液持续加热,当温度上升至 时停止加热,让溶液自然冷却,测定该过程中溶液透光率的变化,实验结果如下图:
时停止加热,让溶液自然冷却,测定该过程中溶液透光率的变化,实验结果如下图:

(6)结合图像分析,小组推测 溶液颜色(透光率)随温度变化的改变并不一定是仅由水解平衡所致,理由是
溶液颜色(透光率)随温度变化的改变并不一定是仅由水解平衡所致,理由是________ 。
查阅资料:溶液中存在配位平衡: (黄色);
(黄色); 不与
不与 配位,
配位, 稀溶液接近无色。
稀溶液接近无色。
优化实验与实验结论:向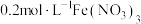 溶液(黄色)中,加入适量
溶液(黄色)中,加入适量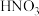 溶液酸化,溶液颜色变为无色,加热和降温过程中溶液透光率均无明显变化,对照图2,可证明酸化条件下,温度对
溶液酸化,溶液颜色变为无色,加热和降温过程中溶液透光率均无明显变化,对照图2,可证明酸化条件下,温度对 的水解平衡影响不大。
的水解平衡影响不大。
(7)上述实验中加入适量 溶液的目的是
溶液的目的是_______ ;请参考上述实验,设计实验证明 溶液颜色(透光率)随温度变化的改变与配位平衡的移动有关,简述实验方案并预测实验现象:
溶液颜色(透光率)随温度变化的改变与配位平衡的移动有关,简述实验方案并预测实验现象:___________ 。
Ⅰ.制备
 固体。
固体。
(1)仪器
 的名称是
的名称是 中的试剂是
中的试剂是(2)装置
 用浓盐酸和
用浓盐酸和 固体反应制备氯气,其反应的化学方程式为
固体反应制备氯气,其反应的化学方程式为(3)上述装置中有一处明显错误是
Ⅱ.探究影响
 水解平衡的因素。
水解平衡的因素。提出假设:外界条件改变,
 溶液水解平衡会发生移动
溶液水解平衡会发生移动设计方案并完成实验
实验1:探究稀释
 溶液对水解平衡移动的影响
溶液对水解平衡移动的影响将
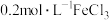 溶液分别稀释10倍和100倍,测定
溶液分别稀释10倍和100倍,测定 :
:| 实验序号 |  |  |
| ⅰ | 0.2 | 1.39 |
| ⅱ | 0.02 | 2.10 |
| ⅲ | 0.002 | 2.74 |
(4)实验证明稀释
 溶液,水解平衡正向移动,结合表中数据,给出判断理由:
溶液,水解平衡正向移动,结合表中数据,给出判断理由:(5)计算实验ⅱ中
 的水解度(转化率)为
的水解度(转化率)为实验2:探究温度对水解平衡移动的影响
已知:
 水解程度越大,其溶液颜色越深,透光率越低。
水解程度越大,其溶液颜色越深,透光率越低。分别将
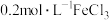 溶液和
溶液和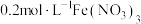 溶液持续加热,当温度上升至
溶液持续加热,当温度上升至 时停止加热,让溶液自然冷却,测定该过程中溶液透光率的变化,实验结果如下图:
时停止加热,让溶液自然冷却,测定该过程中溶液透光率的变化,实验结果如下图:
(6)结合图像分析,小组推测
 溶液颜色(透光率)随温度变化的改变并不一定是仅由水解平衡所致,理由是
溶液颜色(透光率)随温度变化的改变并不一定是仅由水解平衡所致,理由是查阅资料:溶液中存在配位平衡:
 (黄色);
(黄色); 不与
不与 配位,
配位, 稀溶液接近无色。
稀溶液接近无色。优化实验与实验结论:向
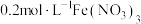 溶液(黄色)中,加入适量
溶液(黄色)中,加入适量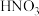 溶液酸化,溶液颜色变为无色,加热和降温过程中溶液透光率均无明显变化,对照图2,可证明酸化条件下,温度对
溶液酸化,溶液颜色变为无色,加热和降温过程中溶液透光率均无明显变化,对照图2,可证明酸化条件下,温度对 的水解平衡影响不大。
的水解平衡影响不大。(7)上述实验中加入适量
 溶液的目的是
溶液的目的是 溶液颜色(透光率)随温度变化的改变与配位平衡的移动有关,简述实验方案并预测实验现象:
溶液颜色(透光率)随温度变化的改变与配位平衡的移动有关,简述实验方案并预测实验现象:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】1.氨气是一种重要的工业原料。
(1)氨气的制备

①氨气的发生装置可以选择上图中的_______ ,反应的化学方程式为_______ 。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_______ (按气流方向,用小写字母表示)。
③新制的氨水中含氮元素的微粒有3种: 、
、 和
和 ,试用合理的方程式解释:
,试用合理的方程式解释:_______ 。
(2)设计实验,探究 对稀氨水中存在的溶质的电离平衡的影响。
对稀氨水中存在的溶质的电离平衡的影响。
已知:影响电离平衡的因素有浓度、温度等。
①限制试剂与仪器:0.1mol/L氨水、 、
、 、
、 、
、 、量筒、烧杯、玻璃棒、药匙、天平、pH计、恒温水浴槽(可控制温度)。
、量筒、烧杯、玻璃棒、药匙、天平、pH计、恒温水浴槽(可控制温度)。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量,数据用字母表示)。
③表中物理量“m(铵盐)/g”的铵盐是_______ (填字母)。
A. B.
B. C.
C. D.
D.
(已知25℃几种弱电解质的电离常数分别为:
 、醋酸
、醋酸 、碳酸
、碳酸 和
和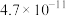 )
)
④按实验序号2所拟数据进行实验,则一水合氨的电离度(平衡转化率)为_______ 。(可忽略水的电离)
(1)氨气的制备

①氨气的发生装置可以选择上图中的
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→
③新制的氨水中含氮元素的微粒有3种:
 、
、 和
和 ,试用合理的方程式解释:
,试用合理的方程式解释:(2)设计实验,探究
 对稀氨水中存在的溶质的电离平衡的影响。
对稀氨水中存在的溶质的电离平衡的影响。已知:影响电离平衡的因素有浓度、温度等。
①限制试剂与仪器:0.1mol/L氨水、
 、
、 、
、 、
、 、量筒、烧杯、玻璃棒、药匙、天平、pH计、恒温水浴槽(可控制温度)。
、量筒、烧杯、玻璃棒、药匙、天平、pH计、恒温水浴槽(可控制温度)。②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量,数据用字母表示)。
| 物理量 实验序号 | V(0.1mol/L氨水)/mL | m(铵盐)/g | …… | ||
| 1 | 100 | 0 | …… | ||
| 2 | 100 | a | …… |
A.
 B.
B. C.
C. D.
D.
(已知25℃几种弱电解质的电离常数分别为:

 、醋酸
、醋酸 、碳酸
、碳酸 和
和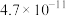 )
)④按实验序号2所拟数据进行实验,则一水合氨的电离度(平衡转化率)为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料。
(1)FeO 与水反应的方程式为:4FeO
与水反应的方程式为:4FeO + 10H2O
+ 10H2O  4Fe(OH)3 + 8OH-+ 3O2↑,K2FeO4在处理水的过程中所起的作用是
4Fe(OH)3 + 8OH-+ 3O2↑,K2FeO4在处理水的过程中所起的作用是________ 。
(2)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为____________________________ 。
(3)将适量K2FeO4配制成c(FeO42-)=1.0×10-3 mol/L(1.0mmol/L)的试样,FeO 在水溶液中的存在形态如右图所示。下列说法正确的是
在水溶液中的存在形态如右图所示。下列说法正确的是______ (填字母)。
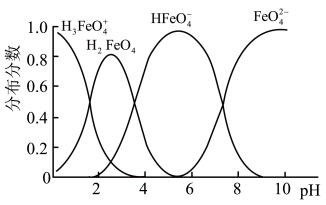
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO 的分布分数先增大后减小
的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO +H2O
+H2O
D.pH约为2.5 时,溶液中H3FeO 和HFeO
和HFeO 比例相当
比例相当
(4)HFeO
 H++FeO
H++FeO 的电离平衡常数表达式为K=
的电离平衡常数表达式为K=______________ ,其数值接近_______ (填字母)。
A.10-2.5 B.10-6 C.10-7 D.10-10
(5)25℃时,CaFeO4的Ksp = 4.536×10-9,若要使100mL1.0×10-3 mol/L的K2FeO4溶液中的c(FeO )完全沉淀,则理论上需控制溶液中Ca2+浓度至少为
)完全沉淀,则理论上需控制溶液中Ca2+浓度至少为__________ 。
(1)FeO
 与水反应的方程式为:4FeO
与水反应的方程式为:4FeO + 10H2O
+ 10H2O  4Fe(OH)3 + 8OH-+ 3O2↑,K2FeO4在处理水的过程中所起的作用是
4Fe(OH)3 + 8OH-+ 3O2↑,K2FeO4在处理水的过程中所起的作用是(2)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为
(3)将适量K2FeO4配制成c(FeO42-)=1.0×10-3 mol/L(1.0mmol/L)的试样,FeO
 在水溶液中的存在形态如右图所示。下列说法正确的是
在水溶液中的存在形态如右图所示。下列说法正确的是
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO
 的分布分数先增大后减小
的分布分数先增大后减小C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO
 +H2O
+H2OD.pH约为2.5 时,溶液中H3FeO
 和HFeO
和HFeO 比例相当
比例相当(4)HFeO

 H++FeO
H++FeO 的电离平衡常数表达式为K=
的电离平衡常数表达式为K=A.10-2.5 B.10-6 C.10-7 D.10-10
(5)25℃时,CaFeO4的Ksp = 4.536×10-9,若要使100mL1.0×10-3 mol/L的K2FeO4溶液中的c(FeO
 )完全沉淀,则理论上需控制溶液中Ca2+浓度至少为
)完全沉淀,则理论上需控制溶液中Ca2+浓度至少为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】铬及其化合物在催化、金属防腐等方面具有重要应用。
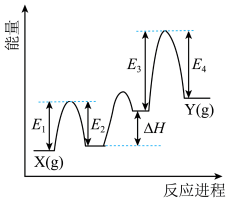
(1)催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。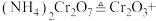
_______ +_______ 。
②Cr2O3催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为___________ (列式表示)。
③Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线__________________ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为____________ 。
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)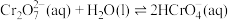
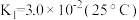
(ⅱ)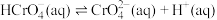

 溶液的说法正确的有
溶液的说法正确的有_______ 。
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时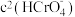 与
与 的比值保持不变
的比值保持不变
②25℃时,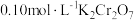 溶液中
溶液中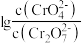 随pH的变化关系如图。当
随pH的变化关系如图。当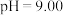 时,设
时,设 、
、 与
与 的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为____________  ;计算溶液中
;计算溶液中 的平衡浓度
的平衡浓度__________ (写出计算过程,结果保留两位有效数字)。
(1)催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。
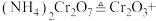
②Cr2O3催化丙烷脱氢过程中,部分反应历程如图,
 过程的焓变为
过程的焓变为③Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线
(2)
 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(ⅰ)
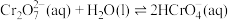
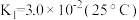
(ⅱ)
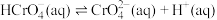

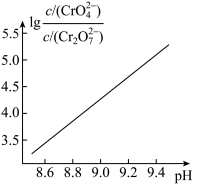
 溶液的说法正确的有
溶液的说法正确的有A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时
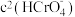 与
与 的比值保持不变
的比值保持不变②25℃时,
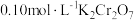 溶液中
溶液中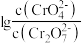 随pH的变化关系如图。当
随pH的变化关系如图。当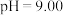 时,设
时,设 、
、 与
与 的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为 ;计算溶液中
;计算溶液中 的平衡浓度
的平衡浓度
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸常温下的电离常数如下表:
①常温下pH相同的三种溶液HA、 、
、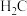 ,物质的量浓度最大的是
,物质的量浓度最大的是___________ (填化学式)。
②将过量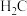 通入
通入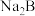 溶液,反应的离子方程式是
溶液,反应的离子方程式是___________ 。
(2)二元弱酸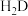 溶液中
溶液中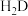 、
、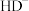 、
、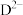 的物质的量分数
的物质的量分数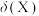 随pH的变化如图所示。
随pH的变化如图所示。
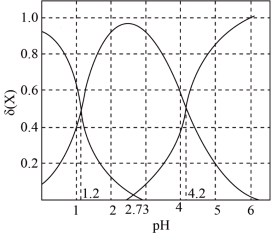
[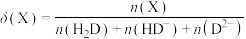 ,X为
,X为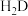 、
、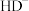 或
或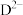 ]。
]。
则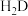 的电离平衡常数
的电离平衡常数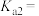
___________ 。
(3)常温下,用 的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,盐酸滴加至20.00mL时与氨水恰好完全中和(d点,pH约为5)。
的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,盐酸滴加至20.00mL时与氨水恰好完全中和(d点,pH约为5)。
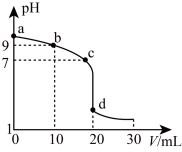
①依据变色pH范围判断下列试剂不适合 作该实验终点指示剂的是:___________ 。
A.甲基橙(变色pH范围3.1-4.4) B.甲基红(变色pH范围3.4-6.2)
C.酚酞(变色pH范围8.2-10.0) D.刚果红(变色pH范围3.0~5.2)
②___________ (填序号)溶液中的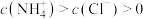 。
。
A.a点 B.b点 C.c点 D.d点
(4)滴淀法常用于物质含量的测定,以下为测量市售食醋总酸含量的方法(食醋总酸含量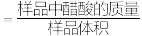 ,单位
,单位 )。
)。
取25mL市售食醋(假设其中酸均为醋酸)配成250mL溶液。每次取25.00mL于锥形瓶中,滴加2~3滴酚酞,在碱式滴定管中装入 的NaOH溶液进行滴定至终点,三次滴定的数据记录如表。(均在常温下测定)
的NaOH溶液进行滴定至终点,三次滴定的数据记录如表。(均在常温下测定)
滴定终点的现象为_____ 。求算食醋总酸含量______ 。(要求:写出计算过程,结果单位为 )
)
(1)已知部分弱酸常温下的电离常数如下表:
| 化学式 | HA |  | 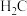 |
| 电离常数K | 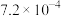 | 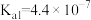 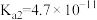 | 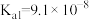 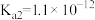 |
 、
、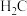 ,物质的量浓度最大的是
,物质的量浓度最大的是②将过量
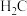 通入
通入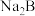 溶液,反应的离子方程式是
溶液,反应的离子方程式是(2)二元弱酸
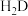 溶液中
溶液中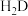 、
、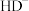 、
、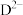 的物质的量分数
的物质的量分数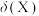 随pH的变化如图所示。
随pH的变化如图所示。
[
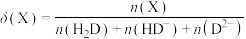 ,X为
,X为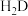 、
、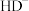 或
或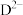 ]。
]。则
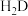 的电离平衡常数
的电离平衡常数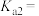
(3)常温下,用
 的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,盐酸滴加至20.00mL时与氨水恰好完全中和(d点,pH约为5)。
的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,盐酸滴加至20.00mL时与氨水恰好完全中和(d点,pH约为5)。
①依据变色pH范围判断下列试剂
A.甲基橙(变色pH范围3.1-4.4) B.甲基红(变色pH范围3.4-6.2)
C.酚酞(变色pH范围8.2-10.0) D.刚果红(变色pH范围3.0~5.2)
②
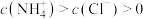 。
。A.a点 B.b点 C.c点 D.d点
(4)滴淀法常用于物质含量的测定,以下为测量市售食醋总酸含量的方法(食醋总酸含量
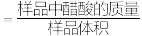 ,单位
,单位 )。
)。取25mL市售食醋(假设其中酸均为醋酸)配成250mL溶液。每次取25.00mL于锥形瓶中,滴加2~3滴酚酞,在碱式滴定管中装入
 的NaOH溶液进行滴定至终点,三次滴定的数据记录如表。(均在常温下测定)
的NaOH溶液进行滴定至终点,三次滴定的数据记录如表。(均在常温下测定)| 序号 | 滴定前读数/mL | 滴定终点读数/mL |
| 1 | 0.22 | 25.20 |
| 2 | 2.24 | 27.26 |
| 3 | 0.14 | 27.08 |
 )
)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】NaOH、Na2CO3、NaHCO3之间在一定条件下能相互转化。
(1)若使碳酸氢钠溶液中 的比值变小,可加入的物质是___________。
的比值变小,可加入的物质是___________。
(2)碳酸钠溶液吸收CO2的离子反应方程式为___________ 。
(3)将100mL1mol/L的NaHCO3溶液等分为两份,其中一份加入少许冰醋酸,另外一份加入少许Ba(OH)2固体,忽略溶液体积变化。两份溶液中c(CO )的变化分别是
)的变化分别是___________ 、___________ (选填“增大”、“减小”或“不变”)。
(4)往部分变质的氢氧化钠溶液中通入二氧化碳,碳酸根的浓度随通入的CO2物质的量变化如图所示。
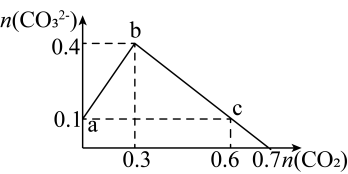
① 点:
点: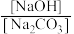 =
=___________ ;
②b点对应的溶液中所有的离子按浓度由大到小排序为___________ ;
③a、b、c三点水的电离程度由大到小的顺序为___________ 。
④往c的溶液中加入足量盐酸、将此过程中发生的离子方程式补充完整:________+HCO + CO
+ CO +H+=________,
+H+=________,________
(1)若使碳酸氢钠溶液中
 的比值变小,可加入的物质是___________。
的比值变小,可加入的物质是___________。| A.通入HCl | B.KOH固体 | C.通入CO2 | D.NaHCO3固体 |
(3)将100mL1mol/L的NaHCO3溶液等分为两份,其中一份加入少许冰醋酸,另外一份加入少许Ba(OH)2固体,忽略溶液体积变化。两份溶液中c(CO
 )的变化分别是
)的变化分别是(4)往部分变质的氢氧化钠溶液中通入二氧化碳,碳酸根的浓度随通入的CO2物质的量变化如图所示。

①
 点:
点: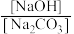 =
=②b点对应的溶液中所有的离子按浓度由大到小排序为
③a、b、c三点水的电离程度由大到小的顺序为
④往c的溶液中加入足量盐酸、将此过程中发生的离子方程式补充完整:________+HCO
 + CO
+ CO +H+=________,
+H+=________,
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
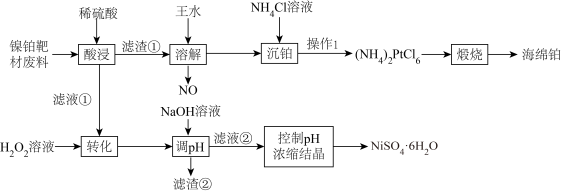
【推荐1】在材料科学的广阔领域中,靶材扮演着一个关键角色。镍铂靶主要用于半导体行业中的二极管和超大规模集成电路镀膜。现利用镍铂靶材废料(主要成分为Ni、Pt以及微量Fe、Al的单质)采用选择性溶解法回收铂并制备硫酸镍晶体的一种工艺流程如下:
①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
②王水是按浓盐酸和浓硝酸的体积比为3∶1配制而成;
③六水合硫酸镍( )在280℃时失去结晶水生成黄绿色无水物,当温度更高开始分解,释放出三氧化硫,变成氧化镍。
)在280℃时失去结晶水生成黄绿色无水物,当温度更高开始分解,释放出三氧化硫,变成氧化镍。
④室温: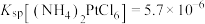 ;
;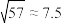
(1)铂在王水中生成二元强酸 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(2)滤液①中金属阳离子有___________ ,调pH过程中,若 为0.01mol/L,则pH的控制范围为
为0.01mol/L,则pH的控制范围为___________ 。
(3)在“沉铂”过程中,若向 的溶液里加入等体积的
的溶液里加入等体积的 溶液,恰好使
溶液,恰好使 沉淀完全,则加入
沉淀完全,则加入 溶液的浓度为
溶液的浓度为___________ mol/L(结果保留两位小数,忽略溶液混合后体积的变化)。
(4)沉铂过程中, 的沉淀率随温度的升高而增大,结合平衡移动原理解释
的沉淀率随温度的升高而增大,结合平衡移动原理解释 沉淀率随温度变化的主要原因
沉淀率随温度变化的主要原因___________ 。
(5)隔绝空气锻烧 时有两种单质生成,分别是Pt和
时有两种单质生成,分别是Pt和 ,当制得金属铂58.5g时,理论上可收集到
,当制得金属铂58.5g时,理论上可收集到
___________ L(标准状况)。
(6)通过对滤液控制pH浓缩结晶得到 晶体,而不是蒸发结晶的原因是
晶体,而不是蒸发结晶的原因是___________ 。
①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀时(c=0.01mol/L)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时(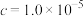 mol/L)的pH mol/L)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
③六水合硫酸镍(
 )在280℃时失去结晶水生成黄绿色无水物,当温度更高开始分解,释放出三氧化硫,变成氧化镍。
)在280℃时失去结晶水生成黄绿色无水物,当温度更高开始分解,释放出三氧化硫,变成氧化镍。④室温:
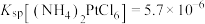 ;
;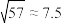
(1)铂在王水中生成二元强酸
 ,该反应的离子方程式为
,该反应的离子方程式为(2)滤液①中金属阳离子有
 为0.01mol/L,则pH的控制范围为
为0.01mol/L,则pH的控制范围为(3)在“沉铂”过程中,若向
 的溶液里加入等体积的
的溶液里加入等体积的 溶液,恰好使
溶液,恰好使 沉淀完全,则加入
沉淀完全,则加入 溶液的浓度为
溶液的浓度为(4)沉铂过程中,
 的沉淀率随温度的升高而增大,结合平衡移动原理解释
的沉淀率随温度的升高而增大,结合平衡移动原理解释 沉淀率随温度变化的主要原因
沉淀率随温度变化的主要原因(5)隔绝空气锻烧
 时有两种单质生成,分别是Pt和
时有两种单质生成,分别是Pt和 ,当制得金属铂58.5g时,理论上可收集到
,当制得金属铂58.5g时,理论上可收集到
(6)通过对滤液控制pH浓缩结晶得到
 晶体,而不是蒸发结晶的原因是
晶体,而不是蒸发结晶的原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】Mg(OH)2可用作塑料的阻燃剂。现以某矿石(主要成分为 3MgO·2SiO2·2H2O,还有少量 Fe2O3、FeO、CaO 和Al2O3)为原料生产 Mg(OH)2,其工艺流程如图:
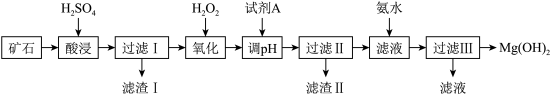
已知:生成氢氧化物沉淀的 pH
回答下列问题:
(1)酸浸时,为提高矿石的浸出率可采取的措施为_______ (任写一条)。该过程H2SO4适当过量的目的除了使固体充分溶解外还有_______
(2)写出氧化过程加H2O2发生反应的离子方程式_______
(3)为了提高产品纯度加入试剂A 为_______ (填化学式),为控制 Mg2+浓度为1.0mol/L,调节溶液 pH 范围为_______ ;得到滤渣 II 的成分是_______ (填化学式)
(4)实际生产中,可由 Mg(OH)2为原料制备单质镁,请写出制备过程中涉及氧化还原的方程式方法_______ 。

已知:生成氢氧化物沉淀的 pH
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的 pH | 7.6 | 1.9 | 3.4 | 9.0 |
| 完全沉淀的 pH (c=1.0×10-5 mol/L) | 9.6 | 3.2 | 4.8 | 11.1 |
(1)酸浸时,为提高矿石的浸出率可采取的措施为
(2)写出氧化过程加H2O2发生反应的离子方程式
(3)为了提高产品纯度加入试剂A 为
(4)实际生产中,可由 Mg(OH)2为原料制备单质镁,请写出制备过程中涉及氧化还原的方程式方法
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
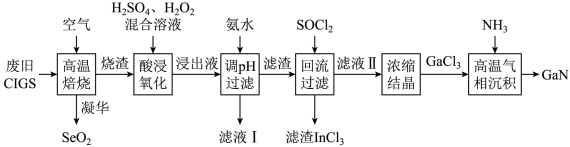
【推荐3】氮化镓是一种新型的半导体,常用于紫光的激光二极管( )。某小组以废旧薄膜太阳能电池(
)。某小组以废旧薄膜太阳能电池( )为原料(主要成分为
)为原料(主要成分为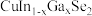 )制备氮化镓,工艺流程如图:
)制备氮化镓,工艺流程如图:
已知:①硒属于氧族元素,镓、铟与铝位于同主族;
②氨水过量时,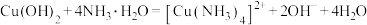 ;
;
③常温下,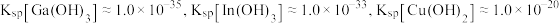 。当金属离子浓度
。当金属离子浓度 时认为金属离子已完全沉淀。
时认为金属离子已完全沉淀。
回答下列问题:
(1)“烧渣”的主要成分是 和
和 ,已知
,已知 ,在“高温焙烧”条件下,
,在“高温焙烧”条件下, 与氧气反应时铜转化成
与氧气反应时铜转化成 ,不生成
,不生成 ,其主要原因可能是
,其主要原因可能是___________ (用结构理论解释)。“双氧水”的作用是___________ (用离子方程式表示)。
(2)“调 过滤”后的“滤渣”主要成分是
过滤”后的“滤渣”主要成分是___________ (填化学式)。
(3)“回流过滤”中 的作用是
的作用是___________ (用镓相关的化学方程式表示)。“滤液Ⅰ”加入足量烧碱,加热可以制备一种气体,该气体可以用于上述“___________ ”工序(填名称)。
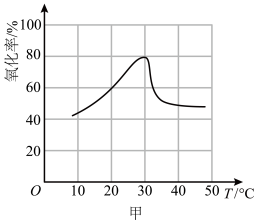
(4)在一定硫酸和双氧水、固体颗粒不变的条件下,单位时间内“酸浸氧化”率与温度的关系如图甲所示(氧化率等于被氧化的元素质量与该元素总质量之比)。 时达到峰值的原因是
时达到峰值的原因是___________ 。
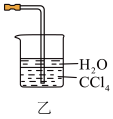
(5)“高温气相沉积”中尾气常选用如图乙所示装置吸收,其原理是___________ 。
 )。某小组以废旧薄膜太阳能电池(
)。某小组以废旧薄膜太阳能电池(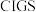 )为原料(主要成分为
)为原料(主要成分为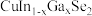 )制备氮化镓,工艺流程如图:
)制备氮化镓,工艺流程如图:
已知:①硒属于氧族元素,镓、铟与铝位于同主族;
②氨水过量时,
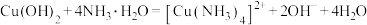 ;
;③常温下,
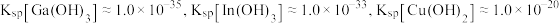 。当金属离子浓度
。当金属离子浓度 时认为金属离子已完全沉淀。
时认为金属离子已完全沉淀。回答下列问题:
(1)“烧渣”的主要成分是
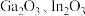 和
和 ,已知
,已知 ,在“高温焙烧”条件下,
,在“高温焙烧”条件下, 与氧气反应时铜转化成
与氧气反应时铜转化成 ,不生成
,不生成 ,其主要原因可能是
,其主要原因可能是(2)“调
 过滤”后的“滤渣”主要成分是
过滤”后的“滤渣”主要成分是(3)“回流过滤”中
 的作用是
的作用是(4)在一定硫酸和双氧水、固体颗粒不变的条件下,单位时间内“酸浸氧化”率与温度的关系如图甲所示(氧化率等于被氧化的元素质量与该元素总质量之比)。
 时达到峰值的原因是
时达到峰值的原因是
(5)“高温气相沉积”中尾气常选用如图乙所示装置吸收,其原理是

您最近一年使用:0次



