工业合成氨是人类科技的重大突破。已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol。
2NH3(g) △H=-92.4kJ/mol。
(1)理论上有利于提高合成氨平衡产率的条件有_____ 。
A.高压 B.低压 C.高温 D.低温 E.使用高效催化剂
(2)在实际生产中,选择的温度为400~500℃,其重要原因是_____ 。
(3)t℃下,在容积为1L的刚性容器中,通入2molN2和6molH2,在一定条件下反应达到平衡时,容器中剩余1molN2,达到平衡时生成NH3的物质的量为_____ mol,反应放出的热量为_____ kJ,t℃下,平衡后向同一容器中再充入1molN2、1molH2、2molNH3,平衡_____ (填“不”“正向”或“逆向”)移动。
(4)已知:在25℃,101kPa时:反应I.2Na(s)+ O2(g)=Na2O(s) △H=-412kJ•mol-1;反应Ⅱ.2Na(s)+O2(g)=Na2O2(s) △H=-511kJ•mol-1。写出Na2O2与Na反应生成Na2O的热化学方程式
O2(g)=Na2O(s) △H=-412kJ•mol-1;反应Ⅱ.2Na(s)+O2(g)=Na2O2(s) △H=-511kJ•mol-1。写出Na2O2与Na反应生成Na2O的热化学方程式______ 。
 2NH3(g) △H=-92.4kJ/mol。
2NH3(g) △H=-92.4kJ/mol。(1)理论上有利于提高合成氨平衡产率的条件有
A.高压 B.低压 C.高温 D.低温 E.使用高效催化剂
(2)在实际生产中,选择的温度为400~500℃,其重要原因是
(3)t℃下,在容积为1L的刚性容器中,通入2molN2和6molH2,在一定条件下反应达到平衡时,容器中剩余1molN2,达到平衡时生成NH3的物质的量为
(4)已知:在25℃,101kPa时:反应I.2Na(s)+
 O2(g)=Na2O(s) △H=-412kJ•mol-1;反应Ⅱ.2Na(s)+O2(g)=Na2O2(s) △H=-511kJ•mol-1。写出Na2O2与Na反应生成Na2O的热化学方程式
O2(g)=Na2O(s) △H=-412kJ•mol-1;反应Ⅱ.2Na(s)+O2(g)=Na2O2(s) △H=-511kJ•mol-1。写出Na2O2与Na反应生成Na2O的热化学方程式
22-23高二上·浙江杭州·期中 查看更多[2]
更新时间:2023-01-25 17:59:21
|
相似题推荐
【推荐1】在庆祝祖国成立70周年的大阅兵上,我国航空领域的发展成就得到了充分展示,钼及其合金在冶金和航空等方面有着广泛的应用。请回答下列有关问题:
Ⅰ.已知: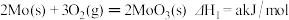

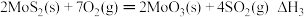
则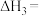
________ (用含 、
、 的代数式表示)。
的代数式表示)。
Ⅱ.用氢气还原辉钼矿制取钼的原理为:
 。
。

(1)一定温度下,在容积固定的密闭容器中进行该反应,下列能说明反应已达到平衡状态的是________ (填序号)。
A.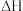 不再发生变化 B.气体密度不再发生变化 C.
不再发生变化 B.气体密度不再发生变化 C.
D. 的体积分数保持不变 E.混合气体的平均相对分子质量不再发生变化
的体积分数保持不变 E.混合气体的平均相对分子质量不再发生变化
(2)在密闭容器中进行该反应,实验测得正、逆反应的平衡常数 与温度
与温度 的关系变化曲线如图1所示,则温度为
的关系变化曲线如图1所示,则温度为 时,该反应的平衡常数
时,该反应的平衡常数
________ 。
(3)在密闭容器中进行该反应,不同压强下,氢气的平衡转化率与温度的关系如图2所示。
① 点的正反应速率
点的正反应速率________  点的逆反应速率(填“>”、“=”或“<”);理由是
点的逆反应速率(填“>”、“=”或“<”);理由是_________ 。
② 点对应的平衡常数
点对应的平衡常数
_________ 。(用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数)
Ⅲ.电氧化法提纯钼的原理为:将已经浆化的辉钼矿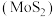 加入到装有氯化钠溶液的电解槽中,在电氧化过程中,阳极产物
加入到装有氯化钠溶液的电解槽中,在电氧化过程中,阳极产物 又与水反应,生成次氯酸根,次氯酸根再把
又与水反应,生成次氯酸根,次氯酸根再把 氧化为
氧化为 和
和 形态进入溶液中。
形态进入溶液中。
(1)辉钼矿应放入电解槽的_________ (填“阴极区”或“阳极区”)。
(2)写出 被氧化的离子方程式
被氧化的离子方程式_________ 。
Ⅰ.已知:
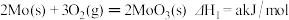

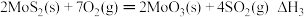
则
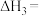
 、
、 的代数式表示)。
的代数式表示)。Ⅱ.用氢气还原辉钼矿制取钼的原理为:
 。
。
(1)一定温度下,在容积固定的密闭容器中进行该反应,下列能说明反应已达到平衡状态的是
A.
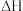 不再发生变化 B.气体密度不再发生变化 C.
不再发生变化 B.气体密度不再发生变化 C.
D.
 的体积分数保持不变 E.混合气体的平均相对分子质量不再发生变化
的体积分数保持不变 E.混合气体的平均相对分子质量不再发生变化(2)在密闭容器中进行该反应,实验测得正、逆反应的平衡常数
 与温度
与温度 的关系变化曲线如图1所示,则温度为
的关系变化曲线如图1所示,则温度为 时,该反应的平衡常数
时,该反应的平衡常数
(3)在密闭容器中进行该反应,不同压强下,氢气的平衡转化率与温度的关系如图2所示。
①
 点的正反应速率
点的正反应速率 点的逆反应速率(填“>”、“=”或“<”);理由是
点的逆反应速率(填“>”、“=”或“<”);理由是②
 点对应的平衡常数
点对应的平衡常数
Ⅲ.电氧化法提纯钼的原理为:将已经浆化的辉钼矿
 加入到装有氯化钠溶液的电解槽中,在电氧化过程中,阳极产物
加入到装有氯化钠溶液的电解槽中,在电氧化过程中,阳极产物 又与水反应,生成次氯酸根,次氯酸根再把
又与水反应,生成次氯酸根,次氯酸根再把 氧化为
氧化为 和
和 形态进入溶液中。
形态进入溶液中。(1)辉钼矿应放入电解槽的
(2)写出
 被氧化的离子方程式
被氧化的离子方程式
您最近一年使用:0次
【推荐2】随着人们的物质生活水平的不断提高和工业化快速发展,环境污染也日益加重,空气中有毒气体主要包括SO2、CO、NOx、烃类等等。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和水。已知CH4和S的燃烧热ΔH分别为-890 kJ /mol 和-297 kJ /mol,则CH4和SO2反应的热化学方程式为_______________ 。
(2)在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应:CO(g)+2H2(g) CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。
CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。
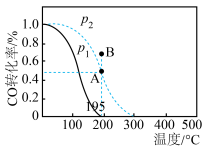
①P2及195℃下,在B点时,v(正)_____ v(逆)(填“>”、“<”或“=”)。
②该反应的ΔH_________ 0(填“>”、“<”或“=”),原因是______________________________ 。
③在0~2 min,平均反应速率v(H2)=______________________ 。(数值用小数形式表示)
④在P2及195 ℃时,该反应的平衡常数Kp=__________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结果用含P2的分式表示)。
(3)某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见图所示。
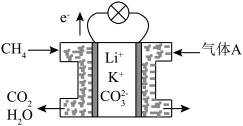
①气体A中除了O2外,一定还含有的气体是________ 。
②该电池的负极反应式为__________________________ 。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和水。已知CH4和S的燃烧热ΔH分别为-890 kJ /mol 和-297 kJ /mol,则CH4和SO2反应的热化学方程式为
(2)在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应:CO(g)+2H2(g)
 CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。
CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。
P2及195 | |||||
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2)mol | 8 | 6 | 5 | 4 | 4 |
②该反应的ΔH
③在0~2 min,平均反应速率v(H2)=
④在P2及195 ℃时,该反应的平衡常数Kp=
(3)某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见图所示。

①气体A中除了O2外,一定还含有的气体是
②该电池的负极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】甲醇( )是一种可再生能源,在日用化工、制药、农药等方面均有广泛用途。催化合成甲醇的反应为
)是一种可再生能源,在日用化工、制药、农药等方面均有广泛用途。催化合成甲醇的反应为 。回答下列问题:
。回答下列问题:
(1)已知反应①: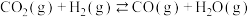
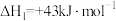
反应②:
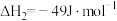
则

_______  。
。
(2)某温度下,向2L恒容密闭容器中充入1 mol CO和2 mol ,加入催化剂反应合成
,加入催化剂反应合成 ,测得
,测得 的物质的员随时间(t)的变化如下表:
的物质的员随时间(t)的变化如下表:
①0〜20min内,用 表示该反应的平均速率为
表示该反应的平均速率为_______ ;
②CO的平衡转化率为_______ ;
③该温度下的平衡常数K=_______ 。
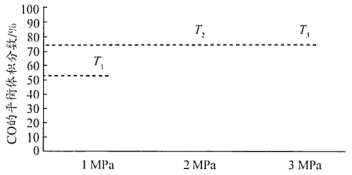
(3)在不同温度和压强下发生反应: ,测得平衡时CO的体积分数(%)与温度(T)和压强的关系如图所示,判断T1、T2、T3由大到小的顺序为
,测得平衡时CO的体积分数(%)与温度(T)和压强的关系如图所示,判断T1、T2、T3由大到小的顺序为____ ,理由是____ 。
 )是一种可再生能源,在日用化工、制药、农药等方面均有广泛用途。催化合成甲醇的反应为
)是一种可再生能源,在日用化工、制药、农药等方面均有广泛用途。催化合成甲醇的反应为 。回答下列问题:
。回答下列问题:(1)已知反应①:
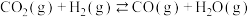
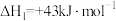
反应②:

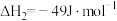
则


 。
。(2)某温度下,向2L恒容密闭容器中充入1 mol CO和2 mol
 ,加入催化剂反应合成
,加入催化剂反应合成 ,测得
,测得 的物质的员随时间(t)的变化如下表:
的物质的员随时间(t)的变化如下表:| t/min | 0 | 5 | 10 | 15 | 20 | 25 |
 /mol /mol | 1.00 | 0.79 | 0.63 | 0.54 | 0.50 | 0.50 |
①0〜20min内,用
 表示该反应的平均速率为
表示该反应的平均速率为②CO的平衡转化率为
③该温度下的平衡常数K=
(3)在不同温度和压强下发生反应:
 ,测得平衡时CO的体积分数(%)与温度(T)和压强的关系如图所示,判断T1、T2、T3由大到小的顺序为
,测得平衡时CO的体积分数(%)与温度(T)和压强的关系如图所示,判断T1、T2、T3由大到小的顺序为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】肼是一种高能燃料。已知各共价键键能(断裂或形成1mol共价键时吸收或释放的能量)如表:
(1)N2H4(g)+O2(g)⇌N2(g)+2H2O(l) ∆H=________ kJ•mol﹣1。
(2)密闭容器中进行反应:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g) ∆H<0反应的化学平衡表达式为K=
Fe3O4(s)+4H2(g) ∆H<0反应的化学平衡表达式为K=________ 。
(3)已知:600℃时,上述反应的平衡常数K=16。现有如图甲(恒温恒压)和如图乙(恒温恒容)两容器:
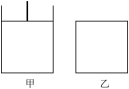
起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡。
①关于甲、乙容器,下列说法正确的是________ 。
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=________ 。
③平衡后若将乙容器体系温度突然降低100℃,图象中能正确反映平衡移动过程中容器内变化情况的是________ 。
A. B.
B. C.
C.
(4)如图为恒容绝热容器:

进行上述反应,起始与平衡时的各物质的量见表:
若在达到平衡后的容器丙中,分别按照下列A、B、C三种情况继续添加各物质,则再次达平衡时,容器丙中H2的百分含量按由大到小的顺序______ (用A、B、C表示)。
| N≡N | O=O | N-N | N-H | O-H | |
| 键能(KJ•mol﹣1) | 946 | 497 | 154 | 391 | 463 |
(1)N2H4(g)+O2(g)⇌N2(g)+2H2O(l) ∆H=
(2)密闭容器中进行反应:3Fe(s)+4H2O(g)
 Fe3O4(s)+4H2(g) ∆H<0反应的化学平衡表达式为K=
Fe3O4(s)+4H2(g) ∆H<0反应的化学平衡表达式为K=(3)已知:600℃时,上述反应的平衡常数K=16。现有如图甲(恒温恒压)和如图乙(恒温恒容)两容器:

起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡。
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
| 乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |
①关于甲、乙容器,下列说法正确的是
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=
③平衡后若将乙容器体系温度突然降低100℃,图象中能正确反映平衡移动过程中容器内变化情况的是
A.
 B.
B. C.
C.
(4)如图为恒容绝热容器:

进行上述反应,起始与平衡时的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 3.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 3.0 | 0 | 0 |
| B/mol | 0 | 0 | 3.0 | 3.0 |
| C/mol | m | n | p | q |
若在达到平衡后的容器丙中,分别按照下列A、B、C三种情况继续添加各物质,则再次达平衡时,容器丙中H2的百分含量按由大到小的顺序
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】(一)(1)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:Bodensteins研究了下列反应:2HI(g) H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
①根据上述实验结果,该反应的平衡常数K的计算式为:___________ 。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k正为________ (以K和k逆表示)。若k正= 0.0027min-1,在t=40min时,v正=________ min-1。
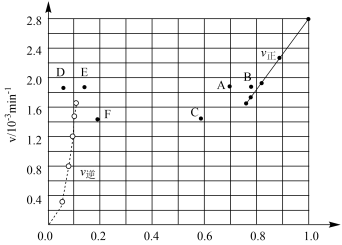
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________ (填字母)。
(二)常温下,将0.01 mol·L-1的Ba(OH)2溶液200mL和0.01 mol·L-1的NaHSO4溶液100mL混合,反应后溶液的pH值为______________________ 。
 H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k正为
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为

(二)常温下,将0.01 mol·L-1的Ba(OH)2溶液200mL和0.01 mol·L-1的NaHSO4溶液100mL混合,反应后溶液的pH值为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,
CH3OH(g)=CH3OH(l) ΔH=-37.3kJ/mol
则CO2(g)+3H2(g) CH3OH(g)+H2O(l)ΔH=
CH3OH(g)+H2O(l)ΔH=__ kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图1两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系。

其中a点的平衡常数表达式为:__ 。
②a,b两点化学反应速率分别用Va、Vb表示,则Va__ Vb(填“大于”、“小于”或“等于”)。
(3)在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是__ 。
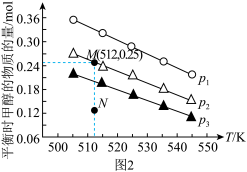
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用CO生产甲醇
(4)已知:CO(g)+2H2(g) CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
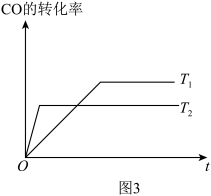
①该反应的焓变ΔH__ 0(填“ ”、“ ”或“ ”)。
②T1和T2温度下的平衡常数大小关系是K1___ K2(填“>”、“<”或“=”)。
Ⅲ.甲醇的应用
(5)甲醇制氢气。甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下,将[n(H2O):n(CH3OH)]=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为___ 。
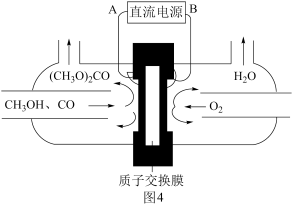
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图4所示。阳极的电极反应式为__ 。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,
CH3OH(g)=CH3OH(l) ΔH=-37.3kJ/mol
则CO2(g)+3H2(g)
 CH3OH(g)+H2O(l)ΔH=
CH3OH(g)+H2O(l)ΔH=(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图1两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系。

其中a点的平衡常数表达式为:
②a,b两点化学反应速率分别用Va、Vb表示,则Va
(3)在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用CO生产甲醇
(4)已知:CO(g)+2H2(g)
 CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
①该反应的焓变ΔH
②T1和T2温度下的平衡常数大小关系是K1
Ⅲ.甲醇的应用
(5)甲醇制氢气。甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下,将[n(H2O):n(CH3OH)]=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图4所示。阳极的电极反应式为

您最近一年使用:0次
【推荐1】汽车尾气中的NO和CO在催化转化器中反应生成两种无毒无害的气体:2NO+2CO N2+2CO2,可减少尾气中有害气体排放。已知该反应的v正=k正c2(NO)c2(CO),v逆=k逆c(N2)c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2+2CO2,可减少尾气中有害气体排放。已知该反应的v正=k正c2(NO)c2(CO),v逆=k逆c(N2)c2(CO2) (k正、k逆为速率常数,只与温度有关)。
(1)已知:碳的燃烧热为393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ∆H1=+190.5 kJ/mol
2C(s)+O2(g)=2CO(g) ∆H2=-231 kJ/mol
则:2NO(g)+2CO(g) N2(g)+2CO2(g) ∆H=
N2(g)+2CO2(g) ∆H=___________ kJ/mol。若平衡后升高温度,则
___________ (填“增大”、“不变”或“减小”)
(2)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g) CH3OH(g) ∆H。在密闭容器中充入1 mol CO和2 mol H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。
CH3OH(g) ∆H。在密闭容器中充入1 mol CO和2 mol H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。
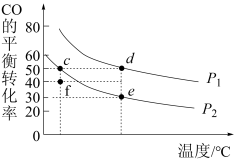
①∆H___________ 0(填“>”“<”);
②f点,v(正)___________ v(逆) (填“大于”、“等于”或“小于”)。
③P1:P2=___________ ;
④如果想进一步提高CO的转化率,除改变温度﹑压强外,还可以采取的措施有___________ 。
(3)在两个容积为2 L的恒容密闭容器中均充入2 mol CO和2 mol NO,在不同条件下发生反应2CO(g)+2NO(g) 2CO2(g)+N2(g),实验测得反应体系的压强与时间t的变化曲线如图所示。
2CO2(g)+N2(g),实验测得反应体系的压强与时间t的变化曲线如图所示。
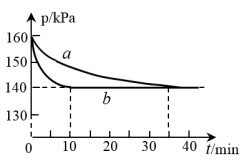
①与实验a相比,实验b采取的措施可能是___________ ;
②实验a条件下,达到平衡时,压强平衡常数KP=___________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③上述反应达到平衡后,再向容器中加入CO、NO、CO2、N2各1 mol,保持该温度下继续反应,此时平衡将___________ (填“正向”、“逆向”或“不”)移动
 N2+2CO2,可减少尾气中有害气体排放。已知该反应的v正=k正c2(NO)c2(CO),v逆=k逆c(N2)c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2+2CO2,可减少尾气中有害气体排放。已知该反应的v正=k正c2(NO)c2(CO),v逆=k逆c(N2)c2(CO2) (k正、k逆为速率常数,只与温度有关)。(1)已知:碳的燃烧热为393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ∆H1=+190.5 kJ/mol
2C(s)+O2(g)=2CO(g) ∆H2=-231 kJ/mol
则:2NO(g)+2CO(g)
 N2(g)+2CO2(g) ∆H=
N2(g)+2CO2(g) ∆H=
(2)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)
 CH3OH(g) ∆H。在密闭容器中充入1 mol CO和2 mol H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。
CH3OH(g) ∆H。在密闭容器中充入1 mol CO和2 mol H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。
①∆H
②f点,v(正)
③P1:P2=
④如果想进一步提高CO的转化率,除改变温度﹑压强外,还可以采取的措施有
(3)在两个容积为2 L的恒容密闭容器中均充入2 mol CO和2 mol NO,在不同条件下发生反应2CO(g)+2NO(g)
 2CO2(g)+N2(g),实验测得反应体系的压强与时间t的变化曲线如图所示。
2CO2(g)+N2(g),实验测得反应体系的压强与时间t的变化曲线如图所示。
①与实验a相比,实验b采取的措施可能是
②实验a条件下,达到平衡时,压强平衡常数KP=
③上述反应达到平衡后,再向容器中加入CO、NO、CO2、N2各1 mol,保持该温度下继续反应,此时平衡将
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】研究NO2、SO2、CH4等气体的处理和利用在治理大气污染、建设生态文明和应对能源危机等具有重要意义。
请回答:
(1)已知:反应Ⅰ: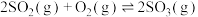
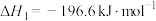
反应Ⅱ: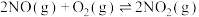

反应Ⅲ:

一定温度下将 与
与 以体积比1∶2置于1L的恒容密闭容器中只发生反应Ⅲ,达到平衡时
以体积比1∶2置于1L的恒容密闭容器中只发生反应Ⅲ,达到平衡时 的体积分数为25%。
的体积分数为25%。
①
______  ;
;
②计算该反应的平衡常数
______ ;
③到达平衡后,其他条件不变,下列措施一定能提高NO2平衡转化率的是______ 。
A.使用催化剂 B.降低温度
C.增大投料比 D.按物质的量比2∶5继续充入NO与SO2
D.按物质的量比2∶5继续充入NO与SO2
(2)以 、水蒸气、生石灰为原料可以大规模制取氢气:
、水蒸气、生石灰为原料可以大规模制取氢气:
水气重整: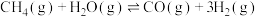
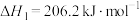
水汽变换:
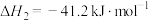
吸附反应:
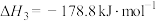
图1为一定条件下,相同时间内无CaO、微米级CaO参与的制氢反应氢气体积分数对比曲线图,图2为其他条件不变,相同时间内830℃下不同级别CaO对氢气体积分数的影响柱状图:

①下列关于图1的叙述不正确的是______ 。
A.图中虚线是有CaO参与的制氢过程
B.加入生石灰的作用之一是吸收 可以使水汽变换限度增大
可以使水汽变换限度增大
C.吸附反应过程可以实现系统能量互补,降低制氢能耗
D.图中实线与虚线随着温度升高会逐渐靠拢,主要原因是高温下水汽变换反应不自发
②根据图1、图2并结合反应的化学方程式,分析由微米级CaO改为纳米级CaO后为何 体积分数上升?
体积分数上升?______ 。
③因为普通纳米级CaO在533℃会因烧结而完全丧失吸附性,故图2中的纳米CaO采用的是 改性的CaO,在图1中画出
改性的CaO,在图1中画出未经改性 的纳米级CaO参与吸附的450~550℃范围内的氢气体积分数变化曲线______ 。
请回答:
(1)已知:反应Ⅰ:
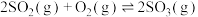
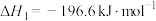
反应Ⅱ:
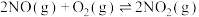

反应Ⅲ:


一定温度下将
 与
与 以体积比1∶2置于1L的恒容密闭容器中只发生反应Ⅲ,达到平衡时
以体积比1∶2置于1L的恒容密闭容器中只发生反应Ⅲ,达到平衡时 的体积分数为25%。
的体积分数为25%。①

 ;
;②计算该反应的平衡常数

③到达平衡后,其他条件不变,下列措施一定能提高NO2平衡转化率的是
A.使用催化剂 B.降低温度
C.增大投料比
 D.按物质的量比2∶5继续充入NO与SO2
D.按物质的量比2∶5继续充入NO与SO2(2)以
 、水蒸气、生石灰为原料可以大规模制取氢气:
、水蒸气、生石灰为原料可以大规模制取氢气:水气重整:
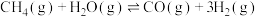
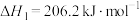
水汽变换:

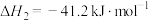
吸附反应:

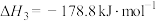
图1为一定条件下,相同时间内无CaO、微米级CaO参与的制氢反应氢气体积分数对比曲线图,图2为其他条件不变,相同时间内830℃下不同级别CaO对氢气体积分数的影响柱状图:

①下列关于图1的叙述不正确的是
A.图中虚线是有CaO参与的制氢过程
B.加入生石灰的作用之一是吸收
 可以使水汽变换限度增大
可以使水汽变换限度增大C.吸附反应过程可以实现系统能量互补,降低制氢能耗
D.图中实线与虚线随着温度升高会逐渐靠拢,主要原因是高温下水汽变换反应不自发
②根据图1、图2并结合反应的化学方程式,分析由微米级CaO改为纳米级CaO后为何
 体积分数上升?
体积分数上升?③因为普通纳米级CaO在533℃会因烧结而完全丧失吸附性,故图2中的纳米CaO采用的是
 改性的CaO,在图1中画出
改性的CaO,在图1中画出
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,常用乙苯为原料合成。
(1)以 和乙苯为原料合成苯乙烯,其过程有“途径1”和“途径2”两种,如图所示。
和乙苯为原料合成苯乙烯,其过程有“途径1”和“途径2”两种,如图所示。
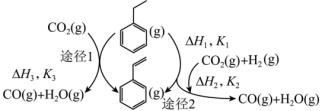
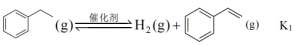
则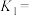
_______ (用含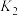 、
、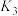 的代数式表示)
的代数式表示)
(2)乙苯直接脱氢制苯乙烯,反应原理如下:
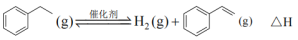
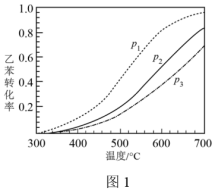
①不同压强下,实验测得乙苯的平衡转化率随温度(T)的变化关系如图1所示,△H_______ 0(填>或<),压强( 、
、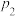 、
、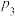 )由小到大的顺序为
)由小到大的顺序为_______ 。
②实际过程中,通常向乙苯中掺入水蒸气,保持体系总压为100kPa。乙苯平衡转化率与温度、投料比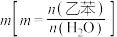 的关系如图2所示。则投料比
的关系如图2所示。则投料比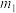 、
、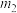 、
、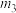 由小到大的顺序为
由小到大的顺序为_______ 。
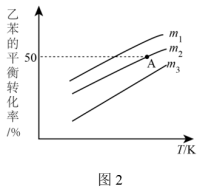
③若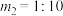 ,则A点温度下,该反应的平衡常数
,则A点温度下,该反应的平衡常数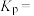
_______ kPa。
(3)含苯乙烯的废水肆意排放会对环境造成严重的污染,现采用电解法进行处理,其工作原理如图(电解液是含苯乙烯和硫酸的废水, )。已知:
)。已知: (羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成
(羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成 和
和 。
。
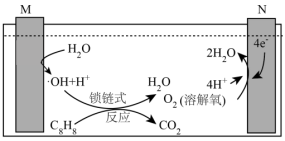
N连接电源的_______ (填“正极”或“负极”),若电路中通过4mol电子,则有_______ g苯乙烯被羟基自由基完全氧化成 和
和 。
。
(1)以
 和乙苯为原料合成苯乙烯,其过程有“途径1”和“途径2”两种,如图所示。
和乙苯为原料合成苯乙烯,其过程有“途径1”和“途径2”两种,如图所示。
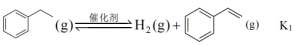
则
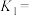
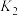 、
、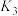 的代数式表示)
的代数式表示)(2)乙苯直接脱氢制苯乙烯,反应原理如下:
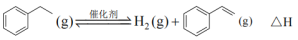
①不同压强下,实验测得乙苯的平衡转化率随温度(T)的变化关系如图1所示,△H
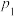 、
、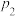 、
、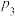 )由小到大的顺序为
)由小到大的顺序为
②实际过程中,通常向乙苯中掺入水蒸气,保持体系总压为100kPa。乙苯平衡转化率与温度、投料比
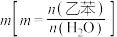 的关系如图2所示。则投料比
的关系如图2所示。则投料比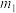 、
、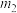 、
、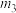 由小到大的顺序为
由小到大的顺序为
③若
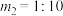 ,则A点温度下,该反应的平衡常数
,则A点温度下,该反应的平衡常数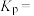
(3)含苯乙烯的废水肆意排放会对环境造成严重的污染,现采用电解法进行处理,其工作原理如图(电解液是含苯乙烯和硫酸的废水,
 )。已知:
)。已知: (羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成
(羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成 和
和 。
。
N连接电源的
 和
和 。
。
您最近一年使用:0次

 时n(H2)随时间变化
时n(H2)随时间变化

