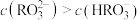常温下,向 溶液中滴加
溶液中滴加 的盐酸,混合溶液的
的盐酸,混合溶液的 与所加盐酸的体积的关系如图所示,下列说法正确的是(已知,常温下
与所加盐酸的体积的关系如图所示,下列说法正确的是(已知,常温下 的电离平衡常数:
的电离平衡常数: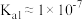 、
、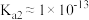 ,忽略混合溶液体积和温度的变化)
,忽略混合溶液体积和温度的变化)
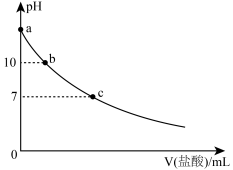
 溶液中滴加
溶液中滴加 的盐酸,混合溶液的
的盐酸,混合溶液的 与所加盐酸的体积的关系如图所示,下列说法正确的是(已知,常温下
与所加盐酸的体积的关系如图所示,下列说法正确的是(已知,常温下 的电离平衡常数:
的电离平衡常数: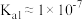 、
、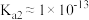 ,忽略混合溶液体积和温度的变化)
,忽略混合溶液体积和温度的变化)
A.a点对应的 为13 为13 | B.b点溶液中,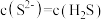 |
| C.c点溶液中,共含有7种不同的微粒 | D.a→c的过程中,溶液中水的电离程度一直增大 |
22-23高二上·辽宁辽阳·期末 查看更多[2]
辽宁省辽阳市协作校2022-2023学年高二上学期期末考试化学试题(已下线)题型02 溶液中粒子浓度大小比较-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)
更新时间:2023-02-14 13:43:00
|
相似题推荐
单选题
|
较难
(0.4)
解题方法
【推荐1】常温下,向500mL一定物质的量浓度KAl(SO4)2溶液中逐滴加入0.1mol·L-1Ba(OH)2溶液,加入Ba(OH)2溶液的体积和所得沉淀的质量关系如图,(忽略混合时溶液体积的变化),已知:Ksp(BaSO4)=1.1×10-10。下列说法正确的是


A.ab段发生离子反应有:SO +Ba2+=BaSO4↓、Al3++3OH-=Al(OH)3↓ +Ba2+=BaSO4↓、Al3++3OH-=Al(OH)3↓ |
| B.a点、b点、c点三点所对应的溶液的水的电离程度:a>b>c |
C.若V2=1;V3=1.5时,c点溶液中c(SO )=4.4×10-9mol·L-1 )=4.4×10-9mol·L-1 |
| D.若V2=1时,m2=27.2 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】常温下,向含少量盐酸的0.1mol/L的CrCl3溶液中逐滴滴加NaOH溶液,所加NaOH溶液的体积与溶液pH变化如图所示。

已知:Cr(OH)3为灰绿色的沉淀,当Cr3+浓度为10-5mol/L时,可认为沉淀完全,碱过量时生成[Cr(OH)4]-离子。下列说法正确的是

已知:Cr(OH)3为灰绿色的沉淀,当Cr3+浓度为10-5mol/L时,可认为沉淀完全,碱过量时生成[Cr(OH)4]-离子。下列说法正确的是
A.AB段发生反应的离子方程式为: |
| B.A到D过程中,溶液中水的电离程度先减小后增大 |
C.当溶液pH=5时,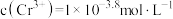 |
D.D点溶液中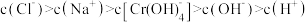 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】常温下,用0.1 mol/L的NaOH溶液滴定20 mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是
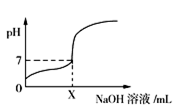

| A.X=20 |
B.HA溶液加水稀释后,溶液中 的值减小 的值减小 |
| C.0.1 mol/L的NaOH溶液中,由水电离出的c(OH−)=0.1 mol/L |
| D.加入NaOH溶液体积为X mL时,溶液中c(A−)=0.05 mol/L |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】下列说法正确的是
A.25℃时,水电离出的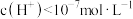 溶液,其pH>7 溶液,其pH>7 |
| B.25℃时,pH=3的HCl与pH=11的MOH溶液混合,测得pH>7,则MOH为弱碱 |
| C.25℃时,若测得HR溶液pH=a,取该溶液10.0mL,滴入10.0mLNaR浓溶液,测得pH=b,b>a,则HR是弱酸 |
D.25℃时,物质的量浓度相等的盐溶液NaX与NaY,若 ,则HX为强酸 ,则HX为强酸 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】某温度时,分别调节0. 01 mol· L-1 HCOOH溶液、0.01 mol· L-1氨水的pH,系统中各种粒子浓度的负对数值(-lg c)与pH的关系如图所示。下列说法不正确的是
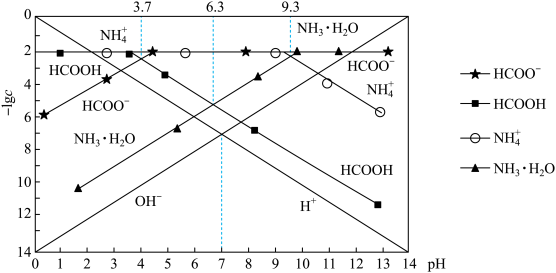
| A.该温度下氨水的电离平衡常数Kb=10-4.7 |
| B.该温度下,0.01 mol· L-1 HCOOH溶液的pH为3.7 |
| C.用标准HCOOH溶液滴定一定浓度的NH3·H2O溶液用甲基橙作指示剂 |
D.向HCOONa溶液中加入KHSO3溶液至溶液呈中性:c(HCOOH) +c(H2SO3)= c(SO ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,离子不存在。图为H3PO4 (图中用H3A 表示) 在加入强酸或强碱溶液后,平衡时溶液中各微粒浓度的对数值(lgc)-pH图。下列说法不正确的是
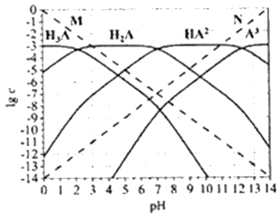

| A.H3PO4、H2PO4-、HPO42-、PO43-不能在同一溶液中大量共存 |
| B.H3PO4电离平衡常数Ka2≈1×10-7 |
| C.图中虚线M、N 分别代表H+和OH- |
| D.pH=10时,溶液中存在关系:c(HPO42-)>c(OH-)>c(PO43-)>c(H2PO4-)>c(H3PO4)>c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】常温下,向NaOH溶液中逐滴滴入亚磷酸(H3PO3),反应中只能生成Na2HPO3和NaH2PO3两种盐,含磷各微粒的分布分数X(平衡时某微粒的浓度占各微粒浓度之和的分数)与pOH[pOH=-lgc(OH-)]的关系如图所示。下列说法不正确的是


A.曲线a代表X(HPO ) ) |
B.pOH=7时,c(Na+)=c(H2PO )+2c(HPO )+2c(HPO ) ) |
C.H2PO 的电离平衡常数Ka=1×10-6.7mol·L-1 的电离平衡常数Ka=1×10-6.7mol·L-1 |
D.等浓度Na2HPO3和NaH2PO3混合溶液: c(Na+)>c(HPO )>c(H2PO )>c(H2PO )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列比较中正确的是
| A.相同浓度的三种溶液:①(NH4)2CO3溶液、②NH4HCO3溶液、③NH4NO3溶液中 c(NH4+):③>①>② |
| B.相同pH的溶液:①NaClO溶液、②NaHCO3溶液、③CH3COONa溶液中 c(Na+):③>②>① |
| C.同浓度、同体积的溶液:①CH3COONa溶液、②NH4Cl溶液、③NaNO3溶液中 pH:②>③>① |
| D.相同浓度的溶液:①氨水、②NaOH溶液、③Ba(OH)2溶液 c(H+):③>②>① |
您最近一年使用:0次
【推荐2】室温下,下列实验探究方案不能 达到实验目的的是
选项 | 探究方案 | 探究目的 |
A | 室温下,向一定量饱和Na2CO3溶液中通入足量CO2气体,观察是否有晶体析出 | 室温下固体在水中的溶解性: |
B | 向FeBr2溶液中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色的变化 | Fe2+的还原性比Br-的强 |
C | 用 计测量相同温度、相同浓度NaClO溶液、 计测量相同温度、相同浓度NaClO溶液、 溶液的pH,比较pH大小 溶液的pH,比较pH大小 | HClO的酸性比 的强 的强 |
D | 向 溶液中滴入2滴 溶液中滴入2滴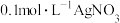 溶液,有沉淀生成,再滴入4滴 溶液,有沉淀生成,再滴入4滴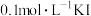 溶液,观察沉淀颜色变化 溶液,观察沉淀颜色变化 | 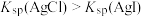 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

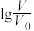 的变化如图所示,下列说法正确的是( )
的变化如图所示,下列说法正确的是( )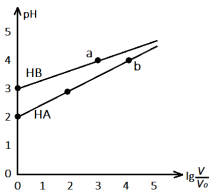
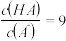
 的某一元酸HA溶液与
的某一元酸HA溶液与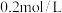 的NaOH溶液等体积混合后
的NaOH溶液等体积混合后 忽略混合前后溶液体积变化
忽略混合前后溶液体积变化 ,则混合后溶液中的下列关系正确的是
,则混合后溶液中的下列关系正确的是

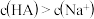
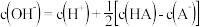
 可能大于
可能大于 溶液滴加到
溶液滴加到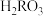 溶液中,混合溶液中
溶液中,混合溶液中 或
或 与pH的关系如图所示。下列叙述正确的是
与pH的关系如图所示。下列叙述正确的是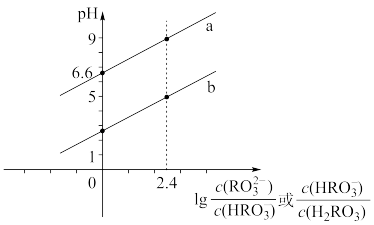
 的数量级为
的数量级为
 时,酸碱恰好完全反应
时,酸碱恰好完全反应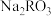 溶液和
溶液和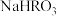 溶液混合后,溶液中
溶液混合后,溶液中