从某废旧电池正极材料(主要含钴酸锂( )及少量炭黑、有机黏合剂、铝、铁、锰等)制备
)及少量炭黑、有机黏合剂、铝、铁、锰等)制备 、
、 的工艺流程如图:
的工艺流程如图:

已知:
①“萃取”与“反萃取”可简单表示为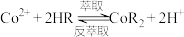
②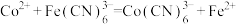
(1)“高温煅烧”的目的是_______ 。
(2)“酸浸”后滤液中含有的金属阳离子有 、
、 、
、 、
、 、
、 ,酸浸时
,酸浸时 发生反应的离子方程式为
发生反应的离子方程式为_______ 。硫酸用量不宜太多的原因是_______ 。
(3)“滤渣”的主要成分除 外,还有
外,还有_______ 。
(4)“反萃取”的目的是将有机层中的 转移到水层。为使
转移到水层。为使 尽可能多地发生上述转移,可采取的措施有
尽可能多地发生上述转移,可采取的措施有_______ (填一种)。
(5)“沉锂”时反应的离子方程式为_______ 。
(6)采用电位滴定法测定产品中钴的含量:称取m g样品配成100mL溶液,移取10.00mL溶液于锥形瓶中,加入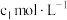 铁氰化钾标准溶液
铁氰化钾标准溶液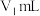 ,置于自动电位滴定仪上。在搅拌下滴加
,置于自动电位滴定仪上。在搅拌下滴加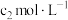 Co(Ⅱ)标准液至终点电位,消耗Co(Ⅱ)标准液体积
Co(Ⅱ)标准液至终点电位,消耗Co(Ⅱ)标准液体积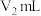 产品中钴的质量分数=
产品中钴的质量分数=_______ (列计算式)。
 )及少量炭黑、有机黏合剂、铝、铁、锰等)制备
)及少量炭黑、有机黏合剂、铝、铁、锰等)制备 、
、 的工艺流程如图:
的工艺流程如图:
已知:
①“萃取”与“反萃取”可简单表示为
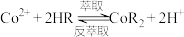
②
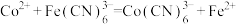
(1)“高温煅烧”的目的是
(2)“酸浸”后滤液中含有的金属阳离子有
 、
、 、
、 、
、 、
、 ,酸浸时
,酸浸时 发生反应的离子方程式为
发生反应的离子方程式为(3)“滤渣”的主要成分除
 外,还有
外,还有(4)“反萃取”的目的是将有机层中的
 转移到水层。为使
转移到水层。为使 尽可能多地发生上述转移,可采取的措施有
尽可能多地发生上述转移,可采取的措施有(5)“沉锂”时反应的离子方程式为
(6)采用电位滴定法测定产品中钴的含量:称取m g样品配成100mL溶液,移取10.00mL溶液于锥形瓶中,加入
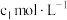 铁氰化钾标准溶液
铁氰化钾标准溶液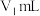 ,置于自动电位滴定仪上。在搅拌下滴加
,置于自动电位滴定仪上。在搅拌下滴加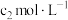 Co(Ⅱ)标准液至终点电位,消耗Co(Ⅱ)标准液体积
Co(Ⅱ)标准液至终点电位,消耗Co(Ⅱ)标准液体积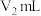 产品中钴的质量分数=
产品中钴的质量分数=
更新时间:2023-05-07 15:18:09
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
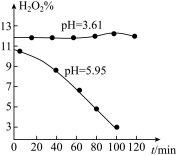
【推荐1】双氧水是常用试剂。某小组设竍如下实验探究H2O2的性质:
(1)该组同学需先将10g10%的H2O2溶液稀释为5%,需要用到的玻璃仪器为量筒、烧杯、玻璃棒、________ 。他从文献查得H2O2的稳定性与pH的关系如图甲所示(已知溶液酸性越强pH越小),则他需要向稀释后的H2O2溶液中滴入几滴_________ (填“稀硫酸”或“氨水”)。
(2)该小组使用上述配制好的H2O2溶液,探究H2O2的性质,实验过程如表:
①实验i的现象为_______________________________ ,能证明H2O2具有____ 性(填“氧化”或“还原”);若该反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为________ 。
②实验ii的离子方程式为________________ 。
(3)已知I-、Fe2+、SO2、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为SO2>I-> H2O2>Fe2+>Cl-,则下列反应不能发生的是_________。
(1)该组同学需先将10g10%的H2O2溶液稀释为5%,需要用到的玻璃仪器为量筒、烧杯、玻璃棒、

(2)该小组使用上述配制好的H2O2溶液,探究H2O2的性质,实验过程如表:
| 实验 | 操作 | 现象 |
| i | 向5%H2O2溶液中滴加酸性KMnO4溶液 | |
| ii | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | 溶液变蓝 |
①实验i的现象为
②实验ii的离子方程式为
(3)已知I-、Fe2+、SO2、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为SO2>I-> H2O2>Fe2+>Cl-,则下列反应不能发生的是_________。
A.2Fe3++SO2+2H2O=2Fe2++ +4H+ +4H+ |
| B.I2+SO2+2H2O=H2SO4+2HI |
| C.H2O2+H2SO4=SO2+O2+2H2O |
| D.2Fe3++2I-=2Fe2++I2 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】海水是巨大的资源宝库,甲工厂从海水中提取食盐和溴的工艺流程如图:
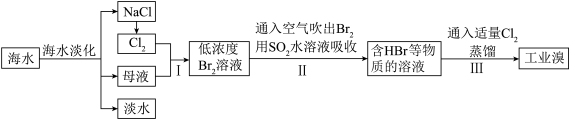
已知:Br2的沸点为59℃,微溶于水,有毒。
(1)海水淡化得到淡水的方法主要有___________ 。(写出两种即可)
(2)为了将粗盐(含杂质Mg2+、 、
、 )提纯,加入的试剂顺序可行的是
)提纯,加入的试剂顺序可行的是___________
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(3)制备钠单质的方法之一是电解熔融NaCl,写出电解的化学方程式___________ 。
(4)步骤Ⅱ在此流程中作用是___________ 。
(5)乙工厂在甲工厂的流程设计基础上进行了改进,步骤Ⅱ中用Na2CO3溶液吸收空气中Br2.充分反应后,得到含NaBr、NaBrO3等物质的混合溶液。步骤Ⅲ向所得溶液中滴加稀硫酸,蒸馏即得到液溴。请写出步骤Ⅲ滴加稀硫酸的离子方程式______________________ 。
(6)与甲工厂相比,乙工厂设计流程的优点为___________ 。

已知:Br2的沸点为59℃,微溶于水,有毒。
(1)海水淡化得到淡水的方法主要有
(2)为了将粗盐(含杂质Mg2+、
 、
、 )提纯,加入的试剂顺序可行的是
)提纯,加入的试剂顺序可行的是A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(3)制备钠单质的方法之一是电解熔融NaCl,写出电解的化学方程式
(4)步骤Ⅱ在此流程中作用是
(5)乙工厂在甲工厂的流程设计基础上进行了改进,步骤Ⅱ中用Na2CO3溶液吸收空气中Br2.充分反应后,得到含NaBr、NaBrO3等物质的混合溶液。步骤Ⅲ向所得溶液中滴加稀硫酸,蒸馏即得到液溴。请写出步骤Ⅲ滴加稀硫酸的离子方程式
(6)与甲工厂相比,乙工厂设计流程的优点为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某化学小组欲测定KClO3溶液与NaHSO3溶液反应的化学反应速率,所用试剂为10 mL 0.1 mol/LKClO3溶液和10 mL 0.3 mol/L NaHSO3溶液,所得实验数据如图所示。
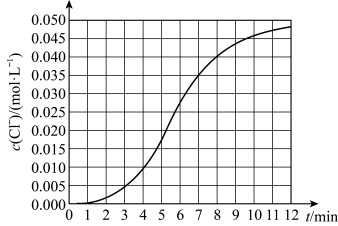
(1)写出该反应的离子方程式_____ 。
(2)该反应在 的平均化学反应速率:v(Cl-)=
的平均化学反应速率:v(Cl-)=_____ 。
(3)某同学仔细分析实验数据后发现,在反应过程中该反应的化学反应速率先增大后减小。
ⅰ.小组同学针对这一现象,通过测定c(Cl-)随时间变化的情况,进一步探究该反应的反应速率影响因素,具体情况见下表。
①方案1中的假设为_____ 。
②补全方案2中的实验操作:_____ 。
③除方案1、2、3中的假设外,还可以提出的假设是_____ 。
④在已知方案1的假设不成立的情况下,某同学从控制变量的角度思考,认为方案3中实验操作设计不严谨,请进行改进:_____ 。
ⅱ.反应后期,化学反应速率降低的原因是_____ 。

(1)写出该反应的离子方程式
(2)该反应在
 的平均化学反应速率:v(Cl-)=
的平均化学反应速率:v(Cl-)=(3)某同学仔细分析实验数据后发现,在反应过程中该反应的化学反应速率先增大后减小。
ⅰ.小组同学针对这一现象,通过测定c(Cl-)随时间变化的情况,进一步探究该反应的反应速率影响因素,具体情况见下表。
| 方案 | 假设 | 实验操作 |
| 1 | _____ | 向烧杯中加入10 mL 0.1 mol/LKClO3溶液和10 mL 0.3 mol/L NaHSO3溶液,测量反应体系温度的变化。 |
| 2 | 反应生成的Cl-是该反应的催化剂,使反应加快。 | 取10 mL 0.1 mol/LKClO3溶液加入烧杯中,向其中加入_____,再加入10 mL 0.3 mol/L NaHSO3溶液。 |
| 3 | 溶液酸性增强,加快了化学反应速率。 | 分别向标号为①②的两只烧杯中加入10 mL 0.1 mol/LKClO3溶液;向烧杯①中加入1 mL水,向烧杯②中加入1 mL0.2 mol/L盐酸;然后分别向这两只烧杯中加入10 mL 0.3 mol/L NaHSO3溶液。 |
②补全方案2中的实验操作:
③除方案1、2、3中的假设外,还可以提出的假设是
④在已知方案1的假设不成立的情况下,某同学从控制变量的角度思考,认为方案3中实验操作设计不严谨,请进行改进:
ⅱ.反应后期,化学反应速率降低的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】从砷化镓废料(主要成分为GaAs,含Fe2O3、SiO2和CaCO3等杂质)中回收镓和砷的工艺流程如下:
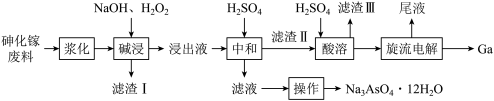
已知:镓(Ga)既能溶于酸也能溶于碱,与NaOH溶液反应生成NaGaO2和H2。
回答下列问题:
(1)“浆化”是将砷化镓废料转变成悬浊液的过程,其目的是___________ 。
(2)砷化镓(GaAs)在“碱浸”时,砷转化为Na3AsO4进入溶液,该反应的化学方程式为___________ 。
(3)“碱浸”的温度控制在70℃左右,温度不能过高或过低的原因是___________ ;“滤渣I”的成分为___________ (填化学式)。
(4)向浸出液中加H2SO4进行“中和”,调节pH使镓和硅共沉淀,不同pH时沉淀率如下表所示。根据表中数据可知,“中和”的pH应调节至___________ 范围内,沉淀的效果最好。

(5)“旋流电解”时用惰性电极,则所得“尾液”的溶质主要是___________ (填化学式),可进行循环利用,提高经济效益。
(6)若用240kg含镓3%的砷化镓废料回收镓,得到纯度为99%的镓7.10kg,则镓的回收率为___________ %(结果保留一位小数)。

已知:镓(Ga)既能溶于酸也能溶于碱,与NaOH溶液反应生成NaGaO2和H2。
回答下列问题:
(1)“浆化”是将砷化镓废料转变成悬浊液的过程,其目的是
(2)砷化镓(GaAs)在“碱浸”时,砷转化为Na3AsO4进入溶液,该反应的化学方程式为
(3)“碱浸”的温度控制在70℃左右,温度不能过高或过低的原因是
(4)向浸出液中加H2SO4进行“中和”,调节pH使镓和硅共沉淀,不同pH时沉淀率如下表所示。根据表中数据可知,“中和”的pH应调节至

(5)“旋流电解”时用惰性电极,则所得“尾液”的溶质主要是
(6)若用240kg含镓3%的砷化镓废料回收镓,得到纯度为99%的镓7.10kg,则镓的回收率为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用化学用语答题)
(1)R的元素符号为________ ; M在元素周期表中的位置为________________ 。
(2)X与M按原子个数比1∶1构成的物质为______________ 。
(3)X+、 Y2-、M2-离子半径大小顺序为____________________________________ 。
(4)将YM2通入FeCl3溶液中的离子方程式:_________________________________
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)R的元素符号为
(2)X与M按原子个数比1∶1构成的物质为
(3)X+、 Y2-、M2-离子半径大小顺序为
(4)将YM2通入FeCl3溶液中的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】锰锌铁氧体可制备隐形飞机上吸收雷达波的涂料。以废旧锌锰电池为原料制备锰锌铁氧体(MnxZn1-xFe2O4)的主要流程如下,请回答下列问题:
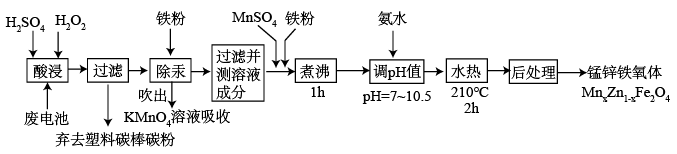
(1)酸浸时,二氧化锰被双氧水还原的化学方程式为______ 。
(2)活性铁粉除汞时,铁粉的作用是______ (填“氧化剂”或“还原剂”或“吸附剂”)。
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸汽经KMnO4溶液进行吸收而实现的。下图是KMnO4溶液处于不同pH时对应Hg的单位时间去除率变化图,图中物质为Hg与 MnO4- 在该pH范围内反应的主要产物。
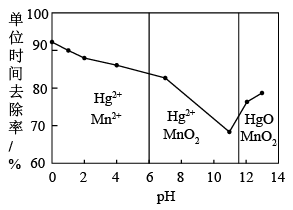
①pH<6时反应的离子方程式为______ 。
②请根据该图给出pH对汞去除率影响的变化规律:______ 。
③试猜想在强酸性环境下汞的单位时间去除率高的原因:______ 。(不考虑KMnO4在酸性条件下氧化性增强的因素)
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该锰锌铁氧体的组成______ 。
(5)经测定滤液成分后,需加入一定量的MnSO4和铁粉,其目的是______ 。

(1)酸浸时,二氧化锰被双氧水还原的化学方程式为
(2)活性铁粉除汞时,铁粉的作用是
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸汽经KMnO4溶液进行吸收而实现的。下图是KMnO4溶液处于不同pH时对应Hg的单位时间去除率变化图,图中物质为Hg与 MnO4- 在该pH范围内反应的主要产物。

①pH<6时反应的离子方程式为
②请根据该图给出pH对汞去除率影响的变化规律:
③试猜想在强酸性环境下汞的单位时间去除率高的原因:
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该锰锌铁氧体的组成
(5)经测定滤液成分后,需加入一定量的MnSO4和铁粉,其目的是
您最近一年使用:0次
【推荐1】废旧锡铬合金主要含Sn、Cr、SnO、Cr2O3,还有少量的Pb。采用如图工艺流程回收锡并制备K2Cr2O7。
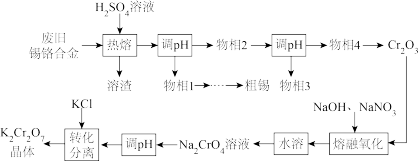
已知:“熔融氧化”反应的还原产物为NaNO2。
回答下列问题:
(1)Cr是24号元素,它的价层电子排布式是____ 。
(2)“热熔”获得的熔渣主要是____ (填化学式)。
(3)物相4在转化为Cr2O3前需要洗涤干燥,检查是否洗涤干净的试剂是____ 。
(4)“熔融氧化”的化学方程式是____ 。
(5)Na2CrO4溶液“调pH”是将pH调____ (填“大”或“小”),原因是____ 。
(6)“转化分离”中通过蒸发浓缩、降温至10℃,结晶过滤的方法分离得到产物,其原因是____ 。

已知:“熔融氧化”反应的还原产物为NaNO2。
回答下列问题:
(1)Cr是24号元素,它的价层电子排布式是
(2)“热熔”获得的熔渣主要是
(3)物相4在转化为Cr2O3前需要洗涤干燥,检查是否洗涤干净的试剂是
(4)“熔融氧化”的化学方程式是
(5)Na2CrO4溶液“调pH”是将pH调
(6)“转化分离”中通过蒸发浓缩、降温至10℃,结晶过滤的方法分离得到产物,其原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】在一定条件下的下列可逆反应达到平衡时,试填出:xA+yB zC
zC
(1)若A、B、C都是气体,增大压强,平衡向正反应方向移动,则x+y与z关系是___________ ;
(2)若B、C是气体,A是固体,增大A的浓度,平衡___________ (填“正向移动”、“逆向移动”或“不移动”);
(3)若升高温度后,C的百分含量减小,则正反应是___________ (填“吸热”或“放热”)反应。
(4)若该可逆反应达到平衡时加入催化剂,平衡___________ (填“正向移动”、“逆向移动”或“不移动”);
 zC
zC(1)若A、B、C都是气体,增大压强,平衡向正反应方向移动,则x+y与z关系是
(2)若B、C是气体,A是固体,增大A的浓度,平衡
(3)若升高温度后,C的百分含量减小,则正反应是
(4)若该可逆反应达到平衡时加入催化剂,平衡
您最近一年使用:0次
【推荐3】Ⅰ.制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为____________________ ;
②下列能提高碳的平衡转化率的措施是____________________ 。
E.将碳研成粉末
Ⅱ.研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量。则石墨与氧气反应生成CO的热化学方程式为:
________________________________________________________________ 。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是:
________________________________________________________________ 。
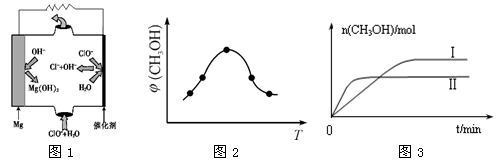
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图1所示,该电池反应的离子方程式为:_____________________________________________________________ 。
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH__________ (填“>” “<”或“=”)0。
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ 对应的平衡常数大小关系为KⅠ__________________ KⅡ(填“>” “<”或“=”)。
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为____________________ 。
 CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为
②下列能提高碳的平衡转化率的措施是
| A.加入C(s) |
| B.加入H2O(g) |
| C.升高温度 |
| D.增大压强 |
E.将碳研成粉末
Ⅱ.研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量。则石墨与氧气反应生成CO的热化学方程式为:
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是:
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图1所示,该电池反应的离子方程式为:

(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H ①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ 对应的平衡常数大小关系为KⅠ
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
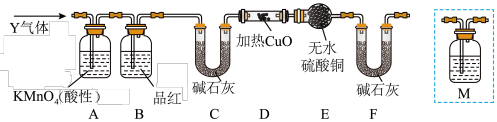
【推荐1】硫化锂(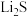 )易潮解,加热条件下易被空气中的
)易潮解,加热条件下易被空气中的 氧化。某小组选择下列装置(装置可重复使用)制备
氧化。某小组选择下列装置(装置可重复使用)制备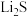 。回答下列问题:
。回答下列问题:
已知:①粗锌中含少量Cu和FeS;
②装置C中发生的反应为 。
。
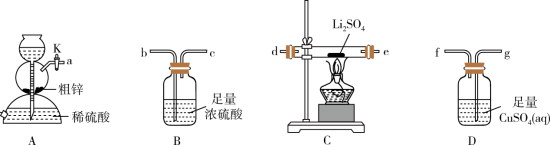
(1)装置A的名称是_______ ,停止装置A中反应的操作是_______ (填“打开”或“关闭”)K。
(2)气流从左至右,导管口连接顺序是a→_______ →_______ →_______ →_______ →d→e→_______ →_______ 。_______
(3)其他条件相同,粗锌与稀硫酸反应比纯锌_______ (填“快”或“慢”),实验中观察到装置D中产生黑色沉淀,其离子方程式为_______ 。
(4)实验完毕后,选择图1、图2装置对装置A中混合物进行分离。先选择图1装置过滤,再将滤液进行蒸发浓缩、降温结晶,再选择图2装置过滤,得到粗皓矾(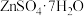 )。
)。
下列有关说法正确的是_______(填标号)。
(5)探究 产品成分:
产品成分:
①由实验Ⅱ知, 样品中还含有
样品中还含有_______ (填化学式),产生该杂质的可能原因是_______ (填标号)。
A.通入的氢气过量 B. 未反应完 C.温度过高
未反应完 C.温度过高
②测定产品纯度:向wg样品(设杂质只有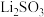 )中加入过量的
)中加入过量的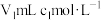 稀硫酸,充分反应后(设没有S单质生成),煮沸溶液以除去残留的酸性气体;滴加的酚酞溶液作指示剂,用标准
稀硫酸,充分反应后(设没有S单质生成),煮沸溶液以除去残留的酸性气体;滴加的酚酞溶液作指示剂,用标准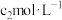 的NaOH溶液滴定过量的硫酸,消耗NaOH溶液
的NaOH溶液滴定过量的硫酸,消耗NaOH溶液 。
。 样品的纯度为
样品的纯度为_______ (列出计算式)。
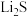 )易潮解,加热条件下易被空气中的
)易潮解,加热条件下易被空气中的 氧化。某小组选择下列装置(装置可重复使用)制备
氧化。某小组选择下列装置(装置可重复使用)制备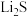 。回答下列问题:
。回答下列问题:已知:①粗锌中含少量Cu和FeS;
②装置C中发生的反应为
 。
。
(1)装置A的名称是
(2)气流从左至右,导管口连接顺序是a→
(3)其他条件相同,粗锌与稀硫酸反应比纯锌
(4)实验完毕后,选择图1、图2装置对装置A中混合物进行分离。先选择图1装置过滤,再将滤液进行蒸发浓缩、降温结晶,再选择图2装置过滤,得到粗皓矾(
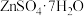 )。
)。
下列有关说法正确的是_______(填标号)。
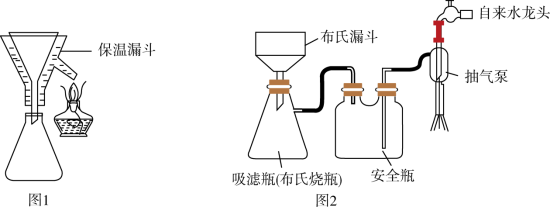
A.选择图1装置过滤的优点是避免析出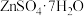 |
B.选择图1装置过滤,主要是分离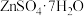 和 和 溶液 溶液 |
| C.粗皓矾中可能含胆矾 |
| D.选择图2装置过滤的优点是过滤速率快 |
 产品成分:
产品成分:| 实验 | 操作与现象 | 结论 |
| Ⅰ | 取少量 样品溶于水,滴加足量的稀盐酸,将气体通入品红溶液中,溶液褪色 样品溶于水,滴加足量的稀盐酸,将气体通入品红溶液中,溶液褪色 | 样品中含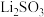 |
| Ⅱ | 向实验Ⅰ的溶液中滴加 溶液,产生白色沉淀 溶液,产生白色沉淀 | 样品中含_______ |
 样品中还含有
样品中还含有A.通入的氢气过量 B.
 未反应完 C.温度过高
未反应完 C.温度过高②测定产品纯度:向wg样品(设杂质只有
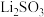 )中加入过量的
)中加入过量的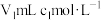 稀硫酸,充分反应后(设没有S单质生成),煮沸溶液以除去残留的酸性气体;滴加的酚酞溶液作指示剂,用标准
稀硫酸,充分反应后(设没有S单质生成),煮沸溶液以除去残留的酸性气体;滴加的酚酞溶液作指示剂,用标准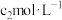 的NaOH溶液滴定过量的硫酸,消耗NaOH溶液
的NaOH溶液滴定过量的硫酸,消耗NaOH溶液 。
。 样品的纯度为
样品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是___ 。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用___ (选填序号)。
a.KSCN溶液和氯水 b.K3Fe(CN)6溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为___ 。分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体(Q不考虑水蒸气)。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是___ 。
(4)如果气体Y中含有H2,预计实验现象应是___ 。
(5)认为气体Y中还含有Q的理由是___ (用化学方程式表示)。
(6)为确认Q的存在,需在装置中添加M于___ (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用
a.KSCN溶液和氯水 b.K3Fe(CN)6溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为

(3)装置B中试剂的作用是
(4)如果气体Y中含有H2,预计实验现象应是
(5)认为气体Y中还含有Q的理由是
(6)为确认Q的存在,需在装置中添加M于
a.A之前 b.A-B间 c.B-C间 d.C-D间
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某氯化铁样品含有FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
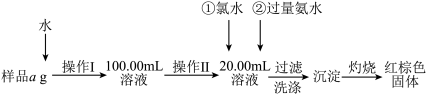
(1)操作I所用到的玻璃仪器除烧杯、量筒、100mL的容量瓶外,还必须有_________ (填仪器名称)。容量瓶使用前必须进行的操作是_________ (填序号)
A.干燥 B.验漏 C.润湿
(2)写出加入氯水发生反应的离子方程式_______________________________________ 。该反应若不用氯水,可用下列试剂中的______________ 代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(3)检验沉淀已经洗涤干净的操作及现象是__________________________ 。
(4)坩埚质量为W1g,加热后坩埚与红棕色固体总质量为W2g,则样品中铁元素的质量分数是____________________ (列出原始算式,不需化简)

(1)操作I所用到的玻璃仪器除烧杯、量筒、100mL的容量瓶外,还必须有
A.干燥 B.验漏 C.润湿
(2)写出加入氯水发生反应的离子方程式
A.H2O2 B.碘水 C.NaClO
(3)检验沉淀已经洗涤干净的操作及现象是
(4)坩埚质量为W1g,加热后坩埚与红棕色固体总质量为W2g,则样品中铁元素的质量分数是
您最近一年使用:0次



