25℃时,将0.01mol•L-1的盐酸逐滴加到10mL0.01mol•L-1NaA溶液中,A-、HA物质的量所占分数(δ)、pH变化曲线如甲、乙图所示。下列溶液中微粒的物质的量浓度关系正确的是


| A.溶液显中性时:c(Cl-)=c(HA) |
| B.图甲中a点对应的溶液:c(A-)<c(Cl-) |
| C.图乙中b点对应的溶液:c(Cl-)>c(HA) >c(A-)>c(OH-)>c(H+) |
| D.a点对应的pH=9.5,则常温下,HA的电离平衡常数:Ka(HA)=10-4.5 |
更新时间:2023-06-10 22:55:25
|
相似题推荐
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】在一定的温度和压强下,将按一定比例混合的CO2和H2通过装有催化剂的反应器可得到甲烷。
已知:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=﹣165kJ·mol-1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH= +41kJ·mol-1
催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测CO2转化率和生成CH4选择性随温度变化的影响如图所示。
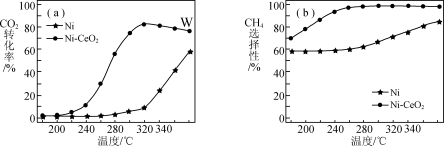
CH4选择性=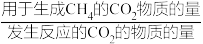 ×100%
×100%
下列有关说法正确的是
已知:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=﹣165kJ·mol-1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH= +41kJ·mol-1
催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测CO2转化率和生成CH4选择性随温度变化的影响如图所示。

CH4选择性=
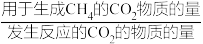 ×100%
×100%下列有关说法正确的是
| A.CO(g)+3H2(g)=CH4(g)+H2O(g) ΔH=+206kJ·mol-1 |
| B.延长W点的反应时间,一定能提高CO2的转化率 |
| C.在260℃~320℃间,以Ni-CeO2为催化剂,升高温度CH4的产率增大 |
| D.高于320℃后,以Ni为催化剂,随温度的升高CO2转化率上升的原因是平衡正向移动 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】对于可逆反应mA(s)+nB(g) eC(g)+fD(g),当反应过程中其他条件不变时,C的质量分数(c%)与温度(T)和压强(p)的关系如图所示。下列叙述正确的是
eC(g)+fD(g),当反应过程中其他条件不变时,C的质量分数(c%)与温度(T)和压强(p)的关系如图所示。下列叙述正确的是
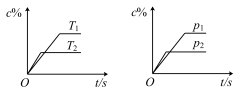
 eC(g)+fD(g),当反应过程中其他条件不变时,C的质量分数(c%)与温度(T)和压强(p)的关系如图所示。下列叙述正确的是
eC(g)+fD(g),当反应过程中其他条件不变时,C的质量分数(c%)与温度(T)和压强(p)的关系如图所示。下列叙述正确的是
| A.达到平衡后,若使用催化剂,C的质量分数将增大 |
| B.达到平衡后,增加A的量有利于化学平衡向正方向移动 |
| C.化学方程式中n>e+f |
| D.达到平衡后,若升高温度,化学平衡向逆方向移动 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】磷酸是生产磷肥和饲料营养剂的原料,同时还是常用的食品添加剂。常温下H3PO4在水中各级电离的过程如下图所示。已知:pK=-1gK

下列相关说法正确的是

下列相关说法正确的是
A.反应H3PO4+2PO  3HPO 3HPO pK=16 pK=16 |
B.Na2HPO4溶液中:c(PO )>2c(H3PO4)+c(H2PO )>2c(H3PO4)+c(H2PO ) ) |
| C.用NaOH溶液滴定NaH2PO4溶液时宜选用甲基橙做指示剂 |
D.H3PO4和Na3PO4组成的混合溶液pH=6时,溶液中:c(H2PO )>c(HPO )>c(HPO ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,向0.1mol·L−1二元弱酸H2A溶液中加入氢氧化钾固体改变溶液的pH,溶液中的H2A、HA−、A2−的物质的量分数 (X)随pH的变化如图所示[已知
(X)随pH的变化如图所示[已知 (X) =
(X) = ]。下列叙述错误的是
]。下列叙述错误的是

 (X)随pH的变化如图所示[已知
(X)随pH的变化如图所示[已知 (X) =
(X) = ]。下列叙述错误的是
]。下列叙述错误的是
| A.pH=1.2时,c(K+)+c(H+)=c(H2A)+c(OH−) |
| B.常温下,H2A的电离平衡常数Ka2=10−42 |
| C.pH=2.7时,c(HA−)>c(H2A)=c(A2−) |
| D.KHA溶液中离子浓度为c(K+)>c(HA−)>c(OH−)>c(H2A)>c(H+)>c(A2−) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液分别滴定20.00 mL浓度均为0.100 0 mol·L-1的HX,HY溶液,pH随NaOH溶液体积的变化如图所示。下列说法正确的是


| A.当V(NaOH)=0 mL时,c(X-)>c(Y-) |
| B.a点时:c(Y-)+c(HY)=0.100 0 mol·L-1 |
| C.b点时:c(HX)>c(Na+)>c(X-)>c(OH-)>c(H+) |
| D.当V(NaOH)=20.00 mL时,NaX、NaY两溶液中的阴离子总数相对大小:N前者>N后者 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】下列实验操作、现象及结论均正确的是
| 选项 | 操作和现象 | 结论 |
| A | 常温下,用 计分别测定等体积 计分别测定等体积 溶液和 溶液和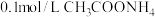 溶液的 溶液的 , , 均为7 均为7 | 两种 溶液中水的电离程度相同 溶液中水的电离程度相同 |
| B | 常温下,向 的 的 溶液中滴加酚酞溶液,溶液变为浅红色 溶液中滴加酚酞溶液,溶液变为浅红色 | 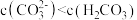 |
| C | 向溶有 的 的 的溶液中通入气体X,出现白色沉淀 的溶液中通入气体X,出现白色沉淀 | X具有强氧化性 |
| D | 向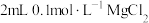 溶液中滴入3滴 溶液中滴入3滴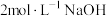 溶液,再滴入4滴 溶液,再滴入4滴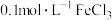 溶液,先产生白色沉淀,后产生红褐色沉淀 溶液,先产生白色沉淀,后产生红褐色沉淀 | 同温度下的 : :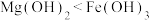 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】25℃时,向20.00 ml 0.1000mol·L-1MOH溶液中滴加0.1000mol·L-1HR溶液,混合溶液的pH与所加HR溶液体积的关系如图所示。下列说法正确的是


| A.Kh(M+)的数量级为10-6 |
| B.HR属于强酸 |
C.P点溶液中 |
D.Q点溶液中 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】室温下,0.1mol/L的某二元酸H2A溶液中,可能存在的所有含A粒子的物质的量分数随pH变化的关系如图所示。下列说法正确的是
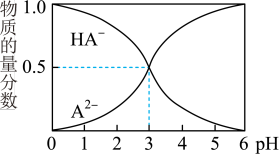

A.H2A的电离方程式:H2A H+ +HA- H+ +HA- |
| B.pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100 |
| C.等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-) |
| D.NaHA溶液显碱性 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】已知室温下,
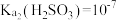
 ,用氨水吸收
,用氨水吸收 并探究吸收后溶液的性质,吸收过程中所引起的溶液体积变化和挥发可忽略。下列说法正确的是
并探究吸收后溶液的性质,吸收过程中所引起的溶液体积变化和挥发可忽略。下列说法正确的是

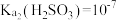
 ,用氨水吸收
,用氨水吸收 并探究吸收后溶液的性质,吸收过程中所引起的溶液体积变化和挥发可忽略。下列说法正确的是
并探究吸收后溶液的性质,吸收过程中所引起的溶液体积变化和挥发可忽略。下列说法正确的是| 序号 | 实验操作和现象 |
| 实验1 | 向10 mL 0.1 mol·L 氨水中通入0.0005 mol 氨水中通入0.0005 mol  ,测得反应后溶液 ,测得反应后溶液 |
| 实验2 | 向“实验1”所得溶液中继续通入0.0005 mol  ,测得反应后溶液 ,测得反应后溶液 |
| 实验3 | 取“实验2”所得溶液,向其中加入过量 溶液,产生白色沉淀 溶液,产生白色沉淀 |
| 实验4 | 取“实验2”所得溶液,向其中加入 至溶液 至溶液 |
A.“实验1”得到的溶液中: |
B.实验2”得到的溶液中: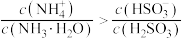 |
C.“实验3”发生反应的离子方程式: |
D.“实验4”得到的溶液中: |
您最近一年使用:0次

 和
和 为原料可合成尿素
为原料可合成尿素 ,反应为:
,反应为: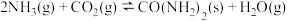 。达到平衡时,
。达到平衡时, 随温度变化的情况如下图。下列说法不正确的是(
随温度变化的情况如下图。下列说法不正确的是(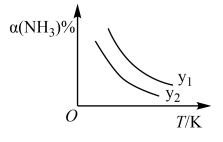

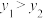
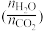 ,则
,则 和
和 ,达到平衡时,恒温恒容体系中氨气的转化率大于绝热恒容体系中氨气的转化率
,达到平衡时,恒温恒容体系中氨气的转化率大于绝热恒容体系中氨气的转化率 ]。
]。


 时,三种溶液中:
时,三种溶液中:

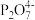 )常用于洗涤剂、软水剂和电镀工业,焦磷酸(H4P2O7)为两分子磷酸脱水而成的多元酸,不同型体的分布分数(δ)与pH的关系如图所示。下列说法正确的是
)常用于洗涤剂、软水剂和电镀工业,焦磷酸(H4P2O7)为两分子磷酸脱水而成的多元酸,不同型体的分布分数(δ)与pH的关系如图所示。下列说法正确的是
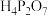 的分布分数曲线
的分布分数曲线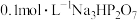 溶液中:
溶液中: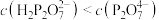
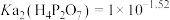
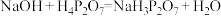 趋于完全
趋于完全

