向5mL 0.10mol·L-1 H2A溶液滴加一定浓度的NaOH溶液,滴定过程中溶液pH和温度随 的变化曲线如图所示。下列说法正确的是
的变化曲线如图所示。下列说法正确的是

 的变化曲线如图所示。下列说法正确的是
的变化曲线如图所示。下列说法正确的是
| A.Z点为第二反应终点,可选用甲基橙作为指示剂 |
| B.从W至Z点,水的电离程度逐渐增大,Kw不变 |
C.当 =1.5时,c(H2A) > =1.5时,c(H2A) >  c(A2−) − c(A2−) −  c(HA−) c(HA−) |
| D.25 ℃时,H2A的电离常数Ka1=10-2.3,Ka2=10-9.7 |
2023·吉林·模拟预测 查看更多[2]
更新时间:2023-07-14 17:47:56
|
相似题推荐
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】下列有关滴定操作的说法正确的是
| A.用25 mL滴定管进行中和滴定时,用去标准液的体积为21.7 mL |
| B.用未知浓度的盐酸滴定标准KOH溶液时,若读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏高 |
| C.用标准KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中含有NaOH杂质,则测定结果偏高 |
| D.用标准KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,则测定结果偏低 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸滴定10.00 mL0.1mol/L的碱MOH,滴定过程中加入醋酸的体积(V) 与溶液中lg[C(H+)/c(OH-)]的关系如图所示。下列说法正确的是


A.MOH的电离方程式为MOH M++OH- M++OH- |
| B.a 点:V(CH3COOH)= 10.00mL |
| C.b点:c(CH3COO-)>c(H+ )>c(M+)>c(OH-) |
| D.25℃,时,CH3COO-的水解平衡常数为(10/17)×10-9 |
您最近一年使用:0次
单选题
|
较难
(0.4)
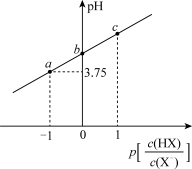
【推荐1】已知 。室温下,向20.00mL 0.10mol·L−1 HX溶液中逐滴滴加0.10mol·L−1 NaOH溶液,溶液pH随
。室温下,向20.00mL 0.10mol·L−1 HX溶液中逐滴滴加0.10mol·L−1 NaOH溶液,溶液pH随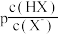 变化关系如图所示。下列说法错误的是
变化关系如图所示。下列说法错误的是
 。室温下,向20.00mL 0.10mol·L−1 HX溶液中逐滴滴加0.10mol·L−1 NaOH溶液,溶液pH随
。室温下,向20.00mL 0.10mol·L−1 HX溶液中逐滴滴加0.10mol·L−1 NaOH溶液,溶液pH随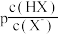 变化关系如图所示。下列说法错误的是
变化关系如图所示。下列说法错误的是
A.当 时,溶液的c(H+)=1.0×10−5.75mol·L−1 时,溶液的c(H+)=1.0×10−5.75mol·L−1 |
B.当 时,加入NaOH溶液的体积大于10.00mL 时,加入NaOH溶液的体积大于10.00mL |
| C.当加入10.00mL NaOH溶液时:c(Na+)+c(OH-)=c(H+)+c(HX) |
| D.如图所示各点对应溶液中水电离出来的H+浓度:a<b<c |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的一元酸HX溶液和HY溶液(两溶液水的电离程度:HX>HY,当Ka≤10-5时可以认为电解质达到电离平衡时的浓度近似等于起始浓度),其滴定曲线如图所示
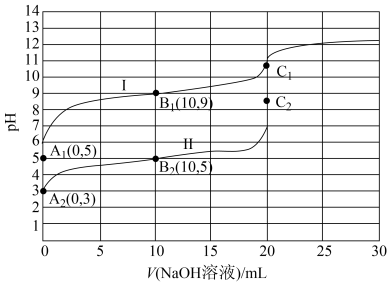
已知:弱电解质在溶液里达到电离平衡时,已电离的电解质分子数占起始时总分子数的百分数称为电离度,下列说法正确的是

已知:弱电解质在溶液里达到电离平衡时,已电离的电解质分子数占起始时总分子数的百分数称为电离度,下列说法正确的是
| A.曲线I和II对应的酸分别为HY和HX |
| B.相比曲线I,曲线II选用酚酞作终点指示剂误差更小 |
| C.把曲线上加入40mLNaOH溶液的点称为E点,则B1、C1和E三点溶液中由水电离出的c(H+)大小关系为C1>E>B1 |
| D.0.10mol/L弱酸HX和HY电离度之比为1:10 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确 的是
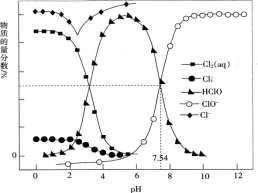

| A.氯水中的Cl2、ClO-、HClO均能与KI发生反应 |
B.常温下反应Cl2(aq)+Cl-(aq)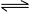 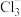 (aq)的K=0.191,当pH增大时,K减小 (aq)的K=0.191,当pH增大时,K减小 |
C.pH=1的氯水中,c(Cl2)>c(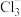 )>c(HClO)>c(ClO-) )>c(HClO)>c(ClO-) |
D.该温度下,HClO H++ClO-的电离常数Ka的对值lgKa=-7.54 H++ClO-的电离常数Ka的对值lgKa=-7.54 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】图(1)和图(2)分别为二元酸H2A和乙二胺(H2NCH2CH2NH2)溶液中各微粒的百分含量δ(即物质的量百分数)随溶液pH的变化曲线(25℃)。下列有关说法正确的是
已知:H2NCH2CH2NH2+H2O [H3NCH2CH2NH2]++OH-
[H3NCH2CH2NH2]++OH-

已知:H2NCH2CH2NH2+H2O
 [H3NCH2CH2NH2]++OH-
[H3NCH2CH2NH2]++OH-
| A.[H3NCH2CH2NH3]A溶液显碱性 |
| B.NaHA溶液中各离子浓度大小关系为:c(Na+)>c(HA-)>c(OH-)>c(A2-)>(H+) |
| C.乙二胺(H2NCH2CH2NH2)的Kb2=10-7.15 |
| D.向[H3NCH2CH2NH2][HA]溶液中通入一定量的HCl气体,则c(H2NCH2CH2NH2)c(H2A)/[c([H2NCH2CH2NH3]+)c(HA-)]可能增大也可能减小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】25℃时,向 1L 0.01mol/L H2B 溶液中滴加 NaOH 溶液,溶液中 c(H2B)、c(HB-)、c(B2-)、c(OH-)、c(H+)的负对数值(-lgc)与 pH 的关系如图所示。下列说法错误的是


| A.曲线 c 表示-lgc(HB-)与 pH 的关系 |
| B.随 pH 增加,c(H2B)·c(OH-)先增大后减小 |
| C.M 点溶液中 n(Na+)+ n(H+) −n(B2-)=0.01mol |
| D.0.01 mol/L NaHB 溶液中,c(Na+)>c(HB-)>c(B2-)>c(H+)>c(H2B) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】室温下,向浓度为0.1mol·L-1的氨水中缓缓通入HCl,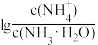 ,随pOH[pOH=-lgc(OH-)]的变化曲线如图所示。假设溶液体积没有变化,下列推断不正确的是:
,随pOH[pOH=-lgc(OH-)]的变化曲线如图所示。假设溶液体积没有变化,下列推断不正确的是:

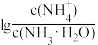 ,随pOH[pOH=-lgc(OH-)]的变化曲线如图所示。假设溶液体积没有变化,下列推断不正确的是:
,随pOH[pOH=-lgc(OH-)]的变化曲线如图所示。假设溶液体积没有变化,下列推断不正确的是:
| A.室温下NH3·H2O的电离常数为10-4.7 |
| B.pOH=6的溶液中:c(NH3·H2O)+c(Cl-)>0.1mol·L-1 |
C.b点溶液中:c(NH )<c(NH3·H2O) )<c(NH3·H2O) |
| D.室温下,a、b、c三点溶液中,c点溶液中水的电离程度最大 |
您最近一年使用:0次

 NaOH溶液滴定20.00mLHCl和
NaOH溶液滴定20.00mLHCl和 混合溶液,滴定过程中
混合溶液,滴定过程中 分布系数
分布系数 及pH随NaOH溶液体积变化如图。下列说法不正确的是
及pH随NaOH溶液体积变化如图。下列说法不正确的是

 时,
时,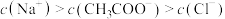
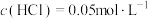
 盐酸的烧杯中匀速滴加
盐酸的烧杯中匀速滴加 蒸馏水、
蒸馏水、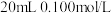 醋酸铵溶液,滴加过程用
醋酸铵溶液,滴加过程用 传感器测得溶液
传感器测得溶液 。下列说法
。下列说法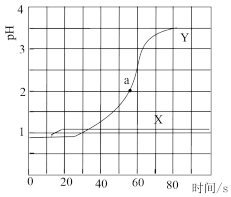
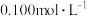 盐酸中水电离的
盐酸中水电离的

 与
与 结合成了
结合成了
 常数,下列说法错误的是
常数,下列说法错误的是



 间的关系:
间的关系:
 的硫酸溶液与
的硫酸溶液与 的KOH溶液等体积混合后,溶液显碱性
的KOH溶液等体积混合后,溶液显碱性


