湿法提银工艺中,浸出Ag+需加Cl-沉淀。25℃,平衡体系中含Ag微粒的分布系数δ随lgc(Cl-)的变化曲线如图所示。已知:lgKsp(AgCl)=-9.75,下列叙述正确的是
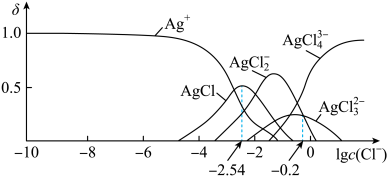
| A.25℃时,AgCl的溶解度随c(Cl-)增大而减小 |
| B.沉淀最彻底时,溶液中c(Ag+)=10-7.21mol•L-1 |
C.25℃时,AgCl +Cl- +Cl- AgCl AgCl 的平衡常数K=10-0.2 的平衡常数K=10-0.2 |
D.当c(Cl-)=10-2.54mol•L-1时,溶液中c(Ag+)>c(Cl-)>c(AgCl ) ) |
2023·河南郑州·模拟预测 查看更多[4]
新疆维吾尔自治区喀什地区2024届高三4月适应性检测理综-化学试题(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第32讲难溶电解质的溶解平衡河南省郑州外国语学校2023届高三下学期全真模拟五理综化学试题
更新时间:2023-06-18 20:31:34
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】以酚酞为指示剂,用0.1000mol/LNaOH溶液滴定20.00mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液VNaOH的变化关系如图所示。
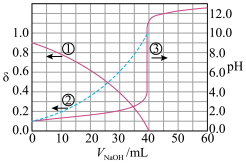
比如A2-的分布系数:[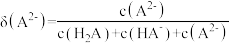 ]下列说法正确的是
]下列说法正确的是

比如A2-的分布系数:[
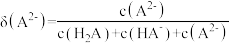 ]下列说法正确的是
]下列说法正确的是| A.H2A的电离方程式为:H2A⇌H++HA-,HA-⇌H++A2- |
| B.HA-的电离常数Ka=1.0×10-2 |
| C.H2A的浓度为0.2000mol/L |
| D.滴定终点时,溶液中2c(Na+)=c(A2-)+c(HA-)+c(H2A) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】25℃,浓度为 的几种弱电解质的电离度a如下表。下列说法
的几种弱电解质的电离度a如下表。下列说法不正确 的是
 的几种弱电解质的电离度a如下表。下列说法
的几种弱电解质的电离度a如下表。下列说法| 电解质 |  |  | HF |  |
| a/% | 1.3 | 7.0 | 7.8 | 1.3 |
A.电离常数从大到小顺序为: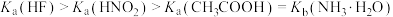 |
B.溶液的pH大小顺序为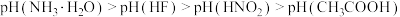 |
C. 溶液呈酸性 溶液呈酸性 |
D.等浓度的 、 、 、NaF溶液,pH最大是 、NaF溶液,pH最大是 溶液 溶液 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】常温下,向20.00mL0.1000mol·L-1的醋酸溶液中逐滴加入0.1000mol·L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示。下列说法不正确的是( )
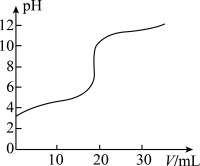

| A.在滴定过程中,c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| B.pH=5时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C.pH=7时,消耗NaOH溶液的体积小于20.00mL |
| D.在滴定过程中,随NaOH溶液滴加c(CH3COO-)持续增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】天然溶洞的形成与水体中含碳物种的浓度有密切关系。已知K(CaCO3)=10-8.7,某溶洞水体中lgc(X)(X为HCO 、CO
、CO 或Ca2+)与pH变化的关系如下图所示。下列说法错误的是
或Ca2+)与pH变化的关系如下图所示。下列说法错误的是
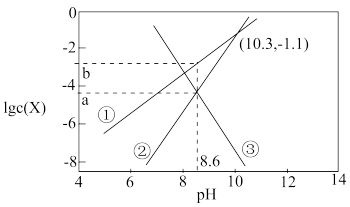
 、CO
、CO 或Ca2+)与pH变化的关系如下图所示。下列说法错误的是
或Ca2+)与pH变化的关系如下图所示。下列说法错误的是
A.曲线②代表CO | B.H2CO3的第二级电离常数为10-10.3 |
| C.a=-4.35,b=-2.75 | D.pH=10.3时,c(Ca2+)=10-7.6 mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列事实不能用勒夏特列原理解释的是
| A.工业上SO2和O2在常压下生成SO3 |
| B.新制氯水在光照下颜色变浅 |
| C.加热浓氨水制取氨气 |
| D.碳酸钙不溶于水,但溶于盐酸 |
您最近一年使用:0次
【推荐1】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0×10-18,其沉淀溶解平衡曲线如图所示(图中R表示Ni或Fe),下列说法正确的是
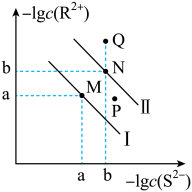
(已知: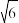 ≈2.4,
≈2.4,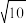 ≈3.2)
≈3.2)

(已知:
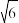 ≈2.4,
≈2.4,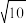 ≈3.2)
≈3.2)| A.曲线I代表NiS |
B.FeS+Ni2+ NiS+Fe2+的平衡常数K=60000 NiS+Fe2+的平衡常数K=60000 |
| C.与P点相对应的FeS的分散系是均一稳定的 |
| D.M点对应的溶液中,c(S2-)≈3.2×10-11 mol•L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】①已知t ℃时AgCl的Ksp=2×10-10;②Ag2CrO4是一种橙红色的固体。在t ℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
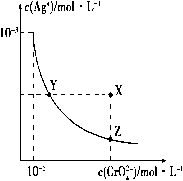

| A.在t℃时,用AgNO3标准溶液滴定20mL未知浓度的KCl溶液,可以采用K2CrO4溶液为指示剂 |
| B.在饱和Ag2CrO4溶液中加入K2CrO4固体可使溶液由Y点到X点 |
| C.在t ℃时,以0.01 mol·L-1 AgNO3溶液滴定20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液, CrO42-先沉淀 |
D.在t ℃时,反应Ag2CrO4(s)+2Cl-(aq) 2AgCl(s)+ CrO42- (aq)的平衡常数K=2.5×105 2AgCl(s)+ CrO42- (aq)的平衡常数K=2.5×105 |
您最近一年使用:0次
【推荐3】常温下,用 AgNO3溶液分别滴定浓度均为 0.01 mol/L 的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑 C2O42-的水解)。已知 Ksp(AgCl) 数量级为 10-10。下列叙述正确的是
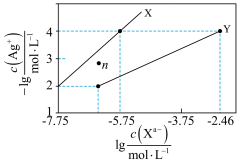

| A.图中 Y 线代表的 AgCl |
| B.n 点表示 Ag2C2O4的过饱和溶液 |
| C.向 c(Cl-)=c(C2O42-)的混合液中滴入 AgNO3溶液时,先生成 AgCl 沉淀 |
| D.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为 10-0.71 |
您最近一年使用:0次

 在不同浓度
在不同浓度 溶液中的溶解度如图所示。下列说法正确的是
溶液中的溶解度如图所示。下列说法正确的是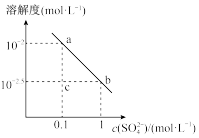
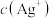 相同
相同
 固体,溶液可变为b点
固体,溶液可变为b点

