NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1mol·L-1NH4Al(SO4)2溶液中的c( )
)___________ (填“等于”“大于”或“小于”)0.1mol·L-1NH4HSO4溶液中的c( )。
)。
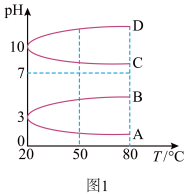
(2)浓度均为0.1mol·L-1的几种电解质溶液的pH随温度变化的曲线如图1所示:___________ ,导致pH随温度变化的原因是___________ 。
②25℃时,0.1mol·L-1NH4Al(SO4)2溶液中2c( )-c(
)-c( )-3c(Al3+)=
)-3c(Al3+)=___________ mol·L-1(填精确 数值表达式)
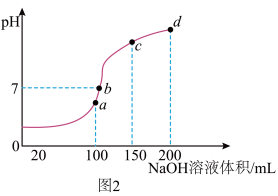
(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是___________ 点;在b点,溶液中各离子浓度由大到小的排列顺序是___________ 。___________ 。(25℃时,Al(OH)3的Ksp=1×10-34)
(5)向AgNO3溶液中加入过量NaCl溶液,会有白色沉淀产生,接着加入NaI溶液,发现白色沉淀变为黄色,请用平衡移动原理来解释颜色变化与溶液中c(Cl-)升高的原因:___________ 。
(1)相同条件下,0.1mol·L-1NH4Al(SO4)2溶液中的c(
 )
) )。
)。(2)浓度均为0.1mol·L-1的几种电解质溶液的pH随温度变化的曲线如图1所示:
②25℃时,0.1mol·L-1NH4Al(SO4)2溶液中2c(
 )-c(
)-c( )-3c(Al3+)=
)-3c(Al3+)=(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是
(5)向AgNO3溶液中加入过量NaCl溶液,会有白色沉淀产生,接着加入NaI溶液,发现白色沉淀变为黄色,请用平衡移动原理来解释颜色变化与溶液中c(Cl-)升高的原因:
更新时间:2023/07/02 19:40:30
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲烷水蒸气催化重整是制备高纯氢的方法之一。反应如下:
反应i.
反应ii.
回答下列问题:
(1)反应iii. ,
,
____________  ;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高
;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高 平衡转化率的措施有
平衡转化率的措施有____________ (写出一条即可).
(2)对于反应i,向体积为 的恒容密闭溶液中,按
的恒容密闭溶液中,按 投料。
投料。

①若在恒温条件下,反应达到平衡时 的转化率为50%,则平衡时容器内的压强与起始压强之比为
的转化率为50%,则平衡时容器内的压强与起始压强之比为______ (最简单整数比)。
②其他条件相同时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间, 的转化率随反应温度的变化如图所示。
的转化率随反应温度的变化如图所示。 点
点______ (填“是”或“不是”)化学平衡状态, 的转化率:
的转化率: 点>
点> 点,原因是
点,原因是____________ 。
③三条曲线在约 后会重合,原因是
后会重合,原因是____________ 。
利用 可以合成草酸(
可以合成草酸( )。草酸是二元弱酸,具有较强还原性。
)。草酸是二元弱酸,具有较强还原性。
(3)常温下, 的
的 溶液的物质的量浓度为
溶液的物质的量浓度为 ,水电离出的
,水电离出的 为
为 ;
; 的
的 溶液的量浓度为
溶液的量浓度为 ,水电离出的
,水电离出的 为
为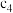 。则
。则
____________ 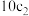 (填“>”“<”或“=”,下同);
(填“>”“<”或“=”,下同);
____________ 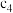 。
。
(4) ,配制一组:
,配制一组: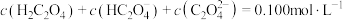 的
的 和
和 混合溶液,溶液中部分微粒的浓度随
混合溶液,溶液中部分微粒的浓度随 的变化如图所示。在下列空格中填入“>”,“=”或“<”。
的变化如图所示。在下列空格中填入“>”,“=”或“<”。

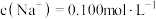 的溶液中:
的溶液中: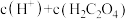
____________ 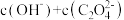 。
。
② 的溶液中:
的溶液中:
____________ 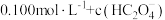 。
。
反应i.

反应ii.

回答下列问题:
(1)反应iii.
 ,
,
 ;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高
;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高 平衡转化率的措施有
平衡转化率的措施有(2)对于反应i,向体积为
 的恒容密闭溶液中,按
的恒容密闭溶液中,按 投料。
投料。
①若在恒温条件下,反应达到平衡时
 的转化率为50%,则平衡时容器内的压强与起始压强之比为
的转化率为50%,则平衡时容器内的压强与起始压强之比为②其他条件相同时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间,
 的转化率随反应温度的变化如图所示。
的转化率随反应温度的变化如图所示。 点
点 的转化率:
的转化率: 点>
点> 点,原因是
点,原因是③三条曲线在约
 后会重合,原因是
后会重合,原因是利用
 可以合成草酸(
可以合成草酸( )。草酸是二元弱酸,具有较强还原性。
)。草酸是二元弱酸,具有较强还原性。(3)常温下,
 的
的 溶液的物质的量浓度为
溶液的物质的量浓度为 ,水电离出的
,水电离出的 为
为 ;
; 的
的 溶液的量浓度为
溶液的量浓度为 ,水电离出的
,水电离出的 为
为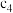 。则
。则
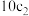 (填“>”“<”或“=”,下同);
(填“>”“<”或“=”,下同);
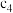 。
。(4)
 ,配制一组:
,配制一组: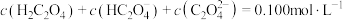 的
的 和
和 混合溶液,溶液中部分微粒的浓度随
混合溶液,溶液中部分微粒的浓度随 的变化如图所示。在下列空格中填入“>”,“=”或“<”。
的变化如图所示。在下列空格中填入“>”,“=”或“<”。
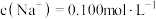 的溶液中:
的溶液中: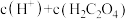
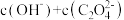 。
。②
 的溶液中:
的溶液中:
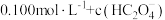 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】乙二酸 俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。回答下列问题:
俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。回答下列问题:
(1)我国国标推荐的食品、药品中钙元素含量的测定方法之一为:利用草酸钠将样品中的 沉淀,洗涤过滤,然后将所得
沉淀,洗涤过滤,然后将所得 溶于强酸,用已知浓度的高锰酸钾溶液滴定草酸测定溶液中钙离子的含量。
溶于强酸,用已知浓度的高锰酸钾溶液滴定草酸测定溶液中钙离子的含量。
①滴定过程中滴加 溶液的操作正确的是
溶液的操作正确的是__________ (填标号)。

②用已知浓度的高锰酸钾溶液进行滴定时,当滴入最后半滴高锰酸钾溶液时,观察到__________ ,则为滴定终点。
③利用 将样品中的
将样品中的 沉淀,
沉淀, 沉淀完全时(实验中
沉淀完全时(实验中 浓度小于
浓度小于 ,则认为沉淀完全),溶液中
,则认为沉淀完全),溶液中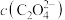 至少为
至少为__________ 。(已知草酸钙的 )
)
(2)25℃时,向 溶液中逐滴加入
溶液中逐滴加入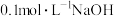 溶液,溶液中含碳微粒的物质的量分数随溶液pH变化如图所示:
溶液,溶液中含碳微粒的物质的量分数随溶液pH变化如图所示:

①溶液中 的物质的量分数随溶液pH变化曲线用
的物质的量分数随溶液pH变化曲线用__________ 表示。(填“Ⅰ”“Ⅱ”或“Ⅲ”);25℃时,草酸的电离平衡常数分别是 、
、 ,则
,则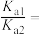
__________ 。
②a点溶液中,
______  (填“>”“=”或“<”),此时溶液的
(填“>”“=”或“<”),此时溶液的
__________ 。
 俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。回答下列问题:
俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。回答下列问题:(1)我国国标推荐的食品、药品中钙元素含量的测定方法之一为:利用草酸钠将样品中的
 沉淀,洗涤过滤,然后将所得
沉淀,洗涤过滤,然后将所得 溶于强酸,用已知浓度的高锰酸钾溶液滴定草酸测定溶液中钙离子的含量。
溶于强酸,用已知浓度的高锰酸钾溶液滴定草酸测定溶液中钙离子的含量。①滴定过程中滴加
 溶液的操作正确的是
溶液的操作正确的是
②用已知浓度的高锰酸钾溶液进行滴定时,当滴入最后半滴高锰酸钾溶液时,观察到
③利用
 将样品中的
将样品中的 沉淀,
沉淀, 沉淀完全时(实验中
沉淀完全时(实验中 浓度小于
浓度小于 ,则认为沉淀完全),溶液中
,则认为沉淀完全),溶液中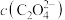 至少为
至少为 )
)(2)25℃时,向
 溶液中逐滴加入
溶液中逐滴加入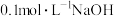 溶液,溶液中含碳微粒的物质的量分数随溶液pH变化如图所示:
溶液,溶液中含碳微粒的物质的量分数随溶液pH变化如图所示:
①溶液中
 的物质的量分数随溶液pH变化曲线用
的物质的量分数随溶液pH变化曲线用 、
、 ,则
,则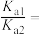
②a点溶液中,

 (填“>”“=”或“<”),此时溶液的
(填“>”“=”或“<”),此时溶液的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】化学原理是中学化学学习的重要内容。请回答下列问题:
(1)①已知:CH4、H2的燃烧热(△H)分别为﹣890.3kJ/mol、﹣285.8kJ/mol,则CO2和H2反应生成CH4的热化学方程式是__________________________ 。
②有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是________ ,A是____ 。

(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇,反应为CO(g)+2H2(g) CH3OH(g),某温度下在容积为2L的密闭容器中进行该反应,其相关数据见图:
CH3OH(g),某温度下在容积为2L的密闭容器中进行该反应,其相关数据见图:
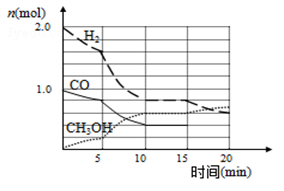
①从反应开始至平衡时,用CO表示化学反应速率为________ ,该温度下的平衡常数为__ ;
②5min至10min时速率变化的原因可能是__________________ ;
(3)①常温下,将V mL、0.1000mol/L氢氧化钠溶液逐滴加入到20.00mL、0.1000mol/L醋酸溶液中,充分反应(忽略溶液体积的变化);如果溶液pH=7,此时V的取值___ 20.00(填“>”、“=”或“<”),溶液中c(Na+)、c(CH3COO﹣)、c(H+)、c(OH﹣)的大小关系是_____________________ ;
②常温下,将a mol/L的醋酸与b mol/L的氢氧化钠溶液等体积混合,反应后,溶液呈中性,则醋酸的电离常数为_______ (用含有a、b字母的代数式表示)。
(1)①已知:CH4、H2的燃烧热(△H)分别为﹣890.3kJ/mol、﹣285.8kJ/mol,则CO2和H2反应生成CH4的热化学方程式是
②有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是

(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇,反应为CO(g)+2H2(g)
 CH3OH(g),某温度下在容积为2L的密闭容器中进行该反应,其相关数据见图:
CH3OH(g),某温度下在容积为2L的密闭容器中进行该反应,其相关数据见图:
①从反应开始至平衡时,用CO表示化学反应速率为
②5min至10min时速率变化的原因可能是
(3)①常温下,将V mL、0.1000mol/L氢氧化钠溶液逐滴加入到20.00mL、0.1000mol/L醋酸溶液中,充分反应(忽略溶液体积的变化);如果溶液pH=7,此时V的取值
②常温下,将a mol/L的醋酸与b mol/L的氢氧化钠溶液等体积混合,反应后,溶液呈中性,则醋酸的电离常数为
您最近一年使用:0次
【推荐1】铜镉渣主要含锌、铜、铁、镉(Cd)、钻(Co)等单质。湿法炼锌产生的铜镉渣用于生产金属镉的工艺流程如图:

表中列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol·L-1)
(1)酸浸铜镉渣时,加快反应速率的措施有_______ (写一条)。
(2)操作Ⅲ中先加入适量H2O2,发生反应的离子方程式_______ ;再加入ZnO控制反应液的pH,pH范围为_______ ﹔选择_______ (填“铁氰化钾”或“硫氰化钾”)试剂,能证明添加的H2O2已过量。
(3)常用沉淀转化法处理含Cd2+废水,写出碳酸钙处理Cd2+的离子方程式_______ ;若反应达到平衡后溶液中c(Ca2+)=0.1mol·L-1,溶液中c(Cd2+)=_______ mol·L-1。[已知25℃,Ksp(CdCO3)=5.6×10-12,Ksp(CaCO3)=2.8×10-9]
(4)电解后的废液可用于电镀锌,电镀锌时阴极反应式为_______ 。

表中列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol·L-1)
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.0 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 | 11.1 |
(1)酸浸铜镉渣时,加快反应速率的措施有
(2)操作Ⅲ中先加入适量H2O2,发生反应的离子方程式
(3)常用沉淀转化法处理含Cd2+废水,写出碳酸钙处理Cd2+的离子方程式
(4)电解后的废液可用于电镀锌,电镀锌时阴极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】某工厂采用如下工艺处理镍钴矿硫酸浸取液含(Ni2+、Co2+、Fe2+、Fe3+、Mg2+和Mn2+)。实现镍、钴、镁元素的回收。

已知:
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为___________ (答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),1 mol H2SO5中过氧键的数目为___________ 。
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为___________ (H2SO5的电离第一步完全,第二步微弱);滤渣的成分为MnO2、CaSO4和___________ (填化学式)。
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如下。SO2体积分数为___________ 时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是___________ 。

(5)25℃时,“沉镁”中为使Mg2+沉淀完全(Mg2+浓度小于10-5mol/L),需控制pH不低于___________ (精确至0.1)。

已知:
| 物质 | Fe(OH)3 | Co(OH)2 | Ni(OH)2 | Mg(OH)2 |
| Ksp | 10-37.4 | 10-14.7 | 10-14.7 | 10-10.8 |
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),1 mol H2SO5中过氧键的数目为
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如下。SO2体积分数为

(5)25℃时,“沉镁”中为使Mg2+沉淀完全(Mg2+浓度小于10-5mol/L),需控制pH不低于
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】处理废旧铅酸电池中的含铅浆液(主要含 、
、 )的一种流程示意图如下。
)的一种流程示意图如下。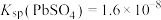 ,
,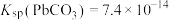 ,
,
ii. 和
和 均为可溶于水的强电解质。
均为可溶于水的强电解质。
(1)向含铅浆液中加入过量的 实现转化脱硫。
实现转化脱硫。
①结合离子方程式说明 溶液显碱性的原因:
溶液显碱性的原因:________ 。
②转化脱硫反应的离子方程式是________ 。
③检验 ,证明固体a已洗涤干净,操作和现象是
,证明固体a已洗涤干净,操作和现象是________ 。
(2)受热时, 分解产生
分解产生 ,最终生成PbO。
,最终生成PbO。
将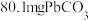 样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中
样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中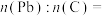
________ 。[ 、
、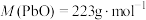 ]
]
(3)“还原”时加入 溶液,反应的化学方程式是
溶液,反应的化学方程式是________ 。
(4)“浸出”反应的离子方程式是________ 。
(5)以惰性电极电解 溶液制得Pb,溶液b中可循环利用的物质是
溶液制得Pb,溶液b中可循环利用的物质是________ 。
 、
、 )的一种流程示意图如下。
)的一种流程示意图如下。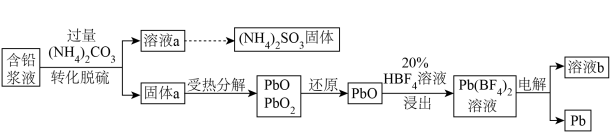
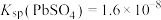 ,
,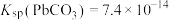 ,
,ii.
 和
和 均为可溶于水的强电解质。
均为可溶于水的强电解质。(1)向含铅浆液中加入过量的
 实现转化脱硫。
实现转化脱硫。①结合离子方程式说明
 溶液显碱性的原因:
溶液显碱性的原因:②转化脱硫反应的离子方程式是
③检验
 ,证明固体a已洗涤干净,操作和现象是
,证明固体a已洗涤干净,操作和现象是(2)受热时,
 分解产生
分解产生 ,最终生成PbO。
,最终生成PbO。将
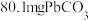 样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中
样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中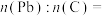
 、
、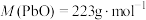 ]
](3)“还原”时加入
 溶液,反应的化学方程式是
溶液,反应的化学方程式是(4)“浸出”反应的离子方程式是
(5)以惰性电极电解
 溶液制得Pb,溶液b中可循环利用的物质是
溶液制得Pb,溶液b中可循环利用的物质是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】以含锂电解铝废渣(主要含 AlF3、 NaF、LiF、CaO ) 和浓硫酸为原料,制备电池级碳酸锂,同时得副产品冰晶石,其工艺流程如下:
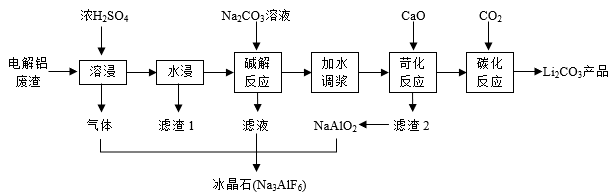
已知 LiOH 易溶于水,Li2CO3微溶于水。回答下列问题:
(1)电解铝废渣与浓硫酸反应产生的气体化学式为_________________ 。滤渣 2 的主要成分是(写化学式) __________________________ 。
(2)碱解反应中, 同时得到气体和沉淀反应的离子方程式为_____________________ 。
(3)一般地说 K>105时,该反应进行得就基本完全了。苛化反应中存在如下平衡:Li2CO3(s)+Ca2+(aq)⇌2Li+(aq)+ CaCO3(s)通过计算说明该反应是否进行完全________ (已知 Ksp(Li2CO3) = 8.64×10-4、Ksp(CaCO3)= 2.5×10-9)。
(4)碳化反应后的溶液得到 Li2CO3的具体实验操作有:加热浓缩、__________ 、过滤、洗涤、干燥。
(5)上述流程得到副产品冰晶石的化学方程式为_________________________________ 。

已知 LiOH 易溶于水,Li2CO3微溶于水。回答下列问题:
(1)电解铝废渣与浓硫酸反应产生的气体化学式为
(2)碱解反应中, 同时得到气体和沉淀反应的离子方程式为
(3)一般地说 K>105时,该反应进行得就基本完全了。苛化反应中存在如下平衡:Li2CO3(s)+Ca2+(aq)⇌2Li+(aq)+ CaCO3(s)通过计算说明该反应是否进行完全
(4)碳化反应后的溶液得到 Li2CO3的具体实验操作有:加热浓缩、
(5)上述流程得到副产品冰晶石的化学方程式为
您最近一年使用:0次
【推荐2】钪(Sc)及其化合物在电子、宇航、超导等方面有着广泛的应用。某工厂的钛白水解工业废酸中Sc3+浓度为18mg/L,还含有大量的TiO2+、Fe3+、H+、 等。下图为从该工业废酸中提取Sc2O3的一种流程。
等。下图为从该工业废酸中提取Sc2O3的一种流程。
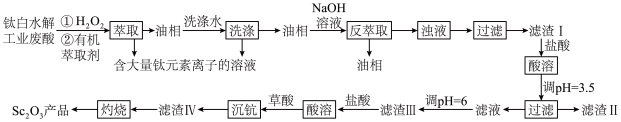
回答下列问题:
(1)在钛白水解工业废酸中,加入双氧水是为了使TiO2+转化为难萃取的[Ti(O2)(OH)(H2O)4]+。[Ti(O2)(OH)(H2O)4]+中Ti的化合价为+4价,其中非极性键的数目为______________ 。
(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比的关系如下图,应选择的合适O/A值为__________ ;温度对钪、钛的萃取率影响情况见下表,合适的萃取温度为10~150C,其理由是________________________________________ 。

(3)洗涤“油相”可除去大量的钛离子。洗涤水是用浓硫酸、双氧水和水按一定比例混合而成。混合过程的实验操作为__________________ 。
(4)25℃时,用氨水调节滤液的pH,当pH=3.5时,滤渣Ⅱ的主要成分是_________ ,当pH=6时,滤液中Sc3+的浓度为_________ 。(Ksp[Fe(OH)3]=2.6×10-39;Ksp[Sc(OH)3]=9.0×10-31)
(5)写出用草酸(H2C2O4)“沉钪”得到Sc2(C2O4)3的离子方程式__________________ 。
(6)若从1m3该工厂的钛白水解废酸中提取得到24.4gSc2O3,则钪的提取率为_________ (保留三位有效数字)
 等。下图为从该工业废酸中提取Sc2O3的一种流程。
等。下图为从该工业废酸中提取Sc2O3的一种流程。
回答下列问题:
(1)在钛白水解工业废酸中,加入双氧水是为了使TiO2+转化为难萃取的[Ti(O2)(OH)(H2O)4]+。[Ti(O2)(OH)(H2O)4]+中Ti的化合价为+4价,其中非极性键的数目为
(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比的关系如下图,应选择的合适O/A值为

T/℃ | 5 | 10 | 15 | 25 | 30 |
钪的萃取率/% | 91.3 | 96.0 | 97.1 | 97.3 | 98.0 |
钛的萃取率/% | 0.94 | 0.95 | 2.10 | 3.01 | 4.20 |
(4)25℃时,用氨水调节滤液的pH,当pH=3.5时,滤渣Ⅱ的主要成分是
(5)写出用草酸(H2C2O4)“沉钪”得到Sc2(C2O4)3的离子方程式
(6)若从1m3该工厂的钛白水解废酸中提取得到24.4gSc2O3,则钪的提取率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣 主要成分为ZnO,还含有铁、铝、铜的氧化物,
主要成分为ZnO,还含有铁、铝、铜的氧化物, 、
、 、
、 等
等 制取氧化锌的工艺流程如图所示:
制取氧化锌的工艺流程如图所示: 生成氢氧化物沉淀的pH如下表所示:
生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)为调节溶液的pH,则试剂X为_________  填化学式
填化学式 ,
,
(2)除杂时加入高锰酸钾的作用是______ ,发生反应的离子方程式为________ 。
(3)“过滤”所得滤渣的主要成分是_________  填化学式
填化学式 。
。
(4)写出“碳化合成”的化学方程式:________ ;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________ 。
 主要成分为ZnO,还含有铁、铝、铜的氧化物,
主要成分为ZnO,还含有铁、铝、铜的氧化物, 、
、 、
、 等
等 制取氧化锌的工艺流程如图所示:
制取氧化锌的工艺流程如图所示: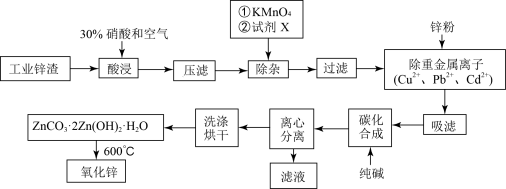
 生成氢氧化物沉淀的pH如下表所示:
生成氢氧化物沉淀的pH如下表所示:| Fe3+ | Fe2+ | Al3+ | Mn2+ | Zn2+ | Cu2+ | Cd2+ | |
| 开始沉淀的pH | 1.5 | 6.3 | 3.4 | 8.1 | 6.2 | 6.0 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 4.7 | 10.1 | 8.2 | 8.0 | 9.4 |
(1)为调节溶液的pH,则试剂X为
 填化学式
填化学式 ,
,(2)除杂时加入高锰酸钾的作用是
(3)“过滤”所得滤渣的主要成分是
 填化学式
填化学式 。
。(4)写出“碳化合成”的化学方程式:
您最近一年使用:0次



