CO2的转化和利用是实现碳中和的有效途径。其中CO2转换为CH3OH被认为是最可能利用的路径,该路径涉及反应如下:
反应I: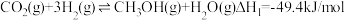
反应Ⅱ: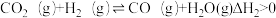
请回答下列问题:
(1)若已知H2和CO的燃烧热,计算反应Ⅱ的 H2,还需要的一个数据为
H2,还需要的一个数据为_______ 。
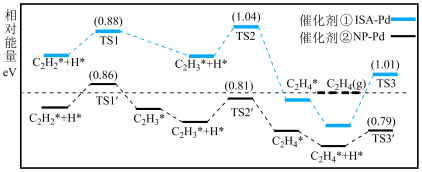
(2)在催化剂条件下,反应I的反应机理和相对能量变化如图(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
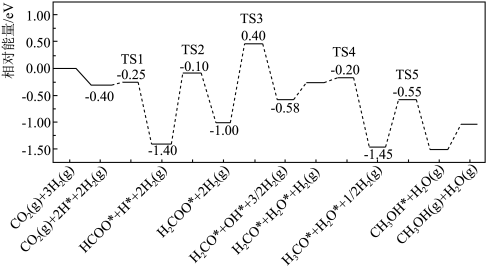
完善该反应机理中相关的化学反应方程式:
_______ ;以TS2为过渡态的反应,其正反应活化能为_______ eV。
(3)在恒温恒压下,CO2和H2按体积比1:3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如表。
已知:①分子筛膜催化反应器(B)具有催化反应、分离出部分水蒸气的双重功能;
②CH3OH的选择性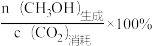
①在普通反应器(A)中,下列不能作为反应(反应I和反应Ⅱ)达到平衡状态的判据是_______ (填标号)。
A.气体的密度不再变化 B.气体的压强不再改变
C.v正(CO2)=3v逆(H2) D.各物质浓度比不再改变
②平衡状态下,反应器(A)中,甲醇的选择性随温度升高而降低,可能的原因是_______ 。
③在反应器(B)中,CO2的平衡转化率明显高于反应器(A),可能的原因是_______ 。
④若反应器(A)中初始时n(CO2)=1mol,反应Ⅱ的化学平衡常数Kp(Ⅱ)=_______ (用最简的分数表示)。
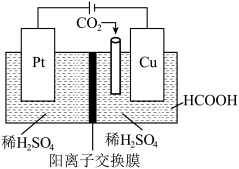
(4)近年来,有研究人员用CO2通过电催化生成HCOOH,实现CO2的回收利用,其工作原理如图所示。请写出Cu电极上的电极反应式:_______ 。
反应I:
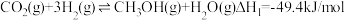
反应Ⅱ:
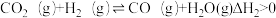
请回答下列问题:
(1)若已知H2和CO的燃烧热,计算反应Ⅱ的
 H2,还需要的一个数据为
H2,还需要的一个数据为(2)在催化剂条件下,反应I的反应机理和相对能量变化如图(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。

完善该反应机理中相关的化学反应方程式:

(3)在恒温恒压下,CO2和H2按体积比1:3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如表。
已知:①分子筛膜催化反应器(B)具有催化反应、分离出部分水蒸气的双重功能;
②CH3OH的选择性
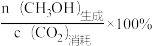
| 1.8MPa 260℃ | |||
| CO2平衡转化率 | 甲醇的选择性 | 达到平衡时间(s) | |
| 普通反应器(A) | 25.0% | 80.0% | 10.0 |
| 分子筛膜催化反应器(B) | a>25.0% | 100.0% | 8.0 |
A.气体的密度不再变化 B.气体的压强不再改变
C.v正(CO2)=3v逆(H2) D.各物质浓度比不再改变
②平衡状态下,反应器(A)中,甲醇的选择性随温度升高而降低,可能的原因是
③在反应器(B)中,CO2的平衡转化率明显高于反应器(A),可能的原因是
④若反应器(A)中初始时n(CO2)=1mol,反应Ⅱ的化学平衡常数Kp(Ⅱ)=
(4)近年来,有研究人员用CO2通过电催化生成HCOOH,实现CO2的回收利用,其工作原理如图所示。请写出Cu电极上的电极反应式:

更新时间:2023-10-09 15:52:38
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】氯及其化合物在生活和生产中应用广泛。
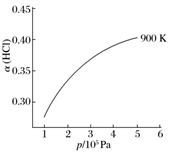
(1)已知:900 K时,4HCl(g)+O2(g) 2Cl2(g)+2H2O(g),反应自发。
2Cl2(g)+2H2O(g),反应自发。
①该反应是放热还是吸热,判断并说明理由___________________________ 。
②900 K时,体积比为4∶1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(p)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×105~4.5 ×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。
×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。_____________________
(2)已知:Cl2(g)+2NaOH(aq)===NaCl(aq)+NaClO(aq)+H2O(l) ΔHl=-102 kJ·mol-1
3Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l) ΔH2=-422 kJ·mol-1
①写出在溶液中NaClO分解生成NaClO3的热化学方程式:________________________________ 。
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol·L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为ct mol·L-1,写出该时刻溶液中Cl-浓度的表达式:c(Cl-)=________________ (用c0、ct表示)mol·L-1。
③有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-===ClO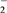 + Cl-
+ Cl-
Ⅱ.ClO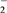 +ClO-===ClO
+ClO-===ClO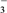 +Cl-
+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:______________________________________________________ 。
(1)已知:900 K时,4HCl(g)+O2(g)
 2Cl2(g)+2H2O(g),反应自发。
2Cl2(g)+2H2O(g),反应自发。①该反应是放热还是吸热,判断并说明理由
②900 K时,体积比为4∶1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(p)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×105~4.5
 ×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。
×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。
(2)已知:Cl2(g)+2NaOH(aq)===NaCl(aq)+NaClO(aq)+H2O(l) ΔHl=-102 kJ·mol-1
3Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l) ΔH2=-422 kJ·mol-1
①写出在溶液中NaClO分解生成NaClO3的热化学方程式:
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol·L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为ct mol·L-1,写出该时刻溶液中Cl-浓度的表达式:c(Cl-)=
③有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-===ClO
 + Cl-
+ Cl-Ⅱ.ClO
 +ClO-===ClO
+ClO-===ClO +Cl-
+Cl-常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】亚硝酰氯(ClNO)是有机合成中的重要试剂,工业上可用NO与 合成,请分析并回答:
合成,请分析并回答:
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,热化学方程式和平衡常数如下:
则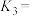
___________ (用 、
、 表示)。
表示)。
(2)25°C时,向体积为2L且带气压计的恒容密闭容器中通入0.08molNO和0.04mol ,发生反应:
,发生反应: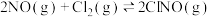 ,
, 。
。
①下列描述能说明该反应已达到平衡状态的是___________ (填序号)。
A.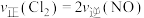
B.容器内混合气体的密度保持不变
C.容器内气体压强保持不变
D.容器内混合气体的平均相对分子质量保持不变
②若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图Ⅰ曲线a所示,则
___________ 0(填“>”、“<”或“不确定”);若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图Ⅰ曲线b所示,则改变的条件是___________ 。
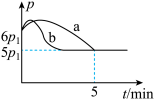
③试求算m值为___________ 。在图Ⅱ中描绘上述反应平衡常数的对数值(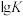 )与温度的变化关系趋势图线(m为起点)
)与温度的变化关系趋势图线(m为起点)_____ 。

④此时,NO的转化率为___________ 。
(3)利用亚硝酰氯与适量NaOH溶液反应后的其中含氮产物X,再与NaOH等溶液一起,可以使铁表面氧化形成致密氧化膜(先分别生成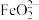 、
、 ,再生成铁的氧化物),试写出最后生成氧化膜的离子反应方程式:
,再生成铁的氧化物),试写出最后生成氧化膜的离子反应方程式:___________ 。
 合成,请分析并回答:
合成,请分析并回答:(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,热化学方程式和平衡常数如下:
| 序号 | 热化学方程式 | 平衡常数 |
| ① |  , , |  |
| ② | 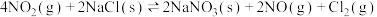 , , |  |
| ③ | 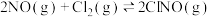 , , |  |
则
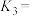
 、
、 表示)。
表示)。(2)25°C时,向体积为2L且带气压计的恒容密闭容器中通入0.08molNO和0.04mol
 ,发生反应:
,发生反应: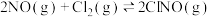 ,
, 。
。①下列描述能说明该反应已达到平衡状态的是
A.
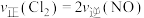
B.容器内混合气体的密度保持不变
C.容器内气体压强保持不变
D.容器内混合气体的平均相对分子质量保持不变
②若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图Ⅰ曲线a所示,则


③试求算m值为
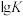 )与温度的变化关系趋势图线(m为起点)
)与温度的变化关系趋势图线(m为起点)
④此时,NO的转化率为
(3)利用亚硝酰氯与适量NaOH溶液反应后的其中含氮产物X,再与NaOH等溶液一起,可以使铁表面氧化形成致密氧化膜(先分别生成
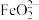 、
、 ,再生成铁的氧化物),试写出最后生成氧化膜的离子反应方程式:
,再生成铁的氧化物),试写出最后生成氧化膜的离子反应方程式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】 和
和 共活化处理的研究既有利于实现碳中和,又有利于处理某些环境中的有害气体.该研究过程主要涉及如下反应:
共活化处理的研究既有利于实现碳中和,又有利于处理某些环境中的有害气体.该研究过程主要涉及如下反应:
Ⅰ.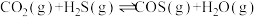
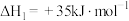
Ⅱ.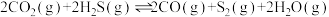
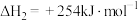
Ⅲ.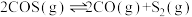

回答下列问题:
(1)反应Ⅲ的反应热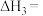
________ ,该反应在________ (填“高温”“低温”或“任意温度”)下能自发进行;
(2)向某密闭容器中投入等物质的量的 和
和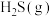 ,发生上述反应.其中
,发生上述反应.其中 的平衡转化率随温度或压强变化如图.L,X可分别代表压强或温度;
的平衡转化率随温度或压强变化如图.L,X可分别代表压强或温度;________ ,原因为________ ;
②若在恒温恒容密闭容器中发生上述反应,下列条件能说明上述反应均达到平衡状态的是________ (填字母);
A. 和
和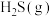 的物质的量之比不再发生变化时
的物质的量之比不再发生变化时
B. 和
和 的物质的量之比不再发生变化时
的物质的量之比不再发生变化时
C. 混合气体密度不再发生变化时
D. 容器内压强不再发生变化时
(3) 下,向起始压强为
下,向起始压强为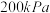 的恒容密闭容器中通入等物质的量的
的恒容密闭容器中通入等物质的量的 和
和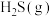 混合气体,发生上述反应,
混合气体,发生上述反应,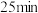 时达到平衡状态,测得此时体系总压强为
时达到平衡状态,测得此时体系总压强为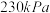 ,
, ;
;
①平衡时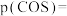
________ 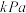 ;
;
② 的平均生成速率为
的平均生成速率为________ 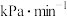 ;
;
③ 下反应Ⅲ的压力平衡常数
下反应Ⅲ的压力平衡常数
________  ;
;
 和
和 共活化处理的研究既有利于实现碳中和,又有利于处理某些环境中的有害气体.该研究过程主要涉及如下反应:
共活化处理的研究既有利于实现碳中和,又有利于处理某些环境中的有害气体.该研究过程主要涉及如下反应:Ⅰ.
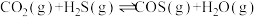
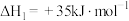
Ⅱ.
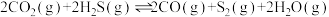
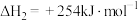
Ⅲ.
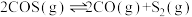

回答下列问题:
(1)反应Ⅲ的反应热
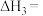
(2)向某密闭容器中投入等物质的量的
 和
和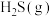 ,发生上述反应.其中
,发生上述反应.其中 的平衡转化率随温度或压强变化如图.L,X可分别代表压强或温度;
的平衡转化率随温度或压强变化如图.L,X可分别代表压强或温度;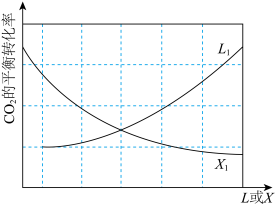
②若在恒温恒容密闭容器中发生上述反应,下列条件能说明上述反应均达到平衡状态的是
A.
 和
和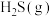 的物质的量之比不再发生变化时
的物质的量之比不再发生变化时B.
 和
和 的物质的量之比不再发生变化时
的物质的量之比不再发生变化时C. 混合气体密度不再发生变化时
D. 容器内压强不再发生变化时
(3)
 下,向起始压强为
下,向起始压强为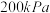 的恒容密闭容器中通入等物质的量的
的恒容密闭容器中通入等物质的量的 和
和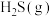 混合气体,发生上述反应,
混合气体,发生上述反应,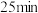 时达到平衡状态,测得此时体系总压强为
时达到平衡状态,测得此时体系总压强为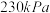 ,
, ;
;①平衡时
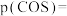
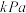 ;
;②
 的平均生成速率为
的平均生成速率为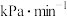 ;
;③
 下反应Ⅲ的压力平衡常数
下反应Ⅲ的压力平衡常数
 ;
;
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2 H2(g)+CO(g) CH3OH(g);
CH3OH(g);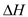 =-a kJ·mol-1(a>0)。初始投料与各容器达到平衡时的有关数据如下:
=-a kJ·mol-1(a>0)。初始投料与各容器达到平衡时的有关数据如下:
(1)该温度下此反应反应物的总键能和_________ (填“大于”“等于”或“小于”)生成物的总键能和。
(2)在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则H2的平均反应速率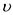 ( H2)为
( H2)为_______ 。
(3)下列选项能说明甲容器中的反应已经达到平衡状态的有_________ (填序号)。
A.容器内H2、CO、CH3OH的物质的量之比为2:1:1 B.容器内气体的密度保持恒定
C.容器内H2气体的体积分数保持恒定 D.2V正(H2)=V逆(CO)
(4)丙容器中,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是____ (填字母序号)。
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡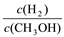 减小
减小
E.平衡常数K增大
(5)三个容器中的反应分别达平衡时各组数据关系正确的是_______ (填序号)。
A.Q1+Q2=a B.α3<α1
C.P3<2P1=2P2 D.n2<n3<1.0mol
(6)已知: ①3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H=—247kJ·mol-l
CH3OCH3(g) +CO2(g) △H=—247kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H= -24 kJ·mol-l
CH3OCH3(g)+H2O(g) △H= -24 kJ·mol-l
③CO(g)+H2O(g) CO2(g)+H2(g) △H= -41 kJ·mol-l
CO2(g)+H2(g) △H= -41 kJ·mol-l
2 H2(g)+CO(g) CH3OH(g);△H=-a kJ·mol-1 ,则 a=
CH3OH(g);△H=-a kJ·mol-1 ,则 a=______ 。
 CH3OH(g);
CH3OH(g);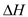 =-a kJ·mol-1(a>0)。初始投料与各容器达到平衡时的有关数据如下:
=-a kJ·mol-1(a>0)。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol H2、1 mol CO | 1 mol CH3OH | 4 mol H2、2 mol CO |
| 平衡时n(CH3OH) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | 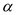 1 1 | 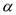 2 2 | 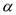 3 3 |
(1)该温度下此反应反应物的总键能和
(2)在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则H2的平均反应速率
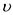 ( H2)为
( H2)为(3)下列选项能说明甲容器中的反应已经达到平衡状态的有
A.容器内H2、CO、CH3OH的物质的量之比为2:1:1 B.容器内气体的密度保持恒定
C.容器内H2气体的体积分数保持恒定 D.2V正(H2)=V逆(CO)
(4)丙容器中,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡
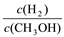 减小
减小E.平衡常数K增大
(5)三个容器中的反应分别达平衡时各组数据关系正确的是
A.Q1+Q2=a B.α3<α1
C.P3<2P1=2P2 D.n2<n3<1.0mol
(6)已知: ①3CO(g) +3H2(g)
 CH3OCH3(g) +CO2(g) △H=—247kJ·mol-l
CH3OCH3(g) +CO2(g) △H=—247kJ·mol-l②2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H= -24 kJ·mol-l
CH3OCH3(g)+H2O(g) △H= -24 kJ·mol-l③CO(g)+H2O(g)
 CO2(g)+H2(g) △H= -41 kJ·mol-l
CO2(g)+H2(g) △H= -41 kJ·mol-l2 H2(g)+CO(g)
 CH3OH(g);△H=-a kJ·mol-1 ,则 a=
CH3OH(g);△H=-a kJ·mol-1 ,则 a=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】以二氧化碳为原料,不依赖植物光合作用,直接人工合成淀粉—看似科幻的一幕,真实地发生在实验室里。中国科学家首次实现了二氧化碳到淀粉的从头合成,相关成果北京时间9月24日由国际知名学术期刊《科学》在线发表,因此CO2的捕集、利用与封存成为科学家研究的重要课题。
已知CO2经催化加氢可以生成多种低碳有机物。
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH=-49.5kJ·mol-1
II.CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH=+40.9kJ·mol-1
III.CO(g)+2H2(g)⇌CH3OH(g)ΔH3
回答下列问题:
(1)反应III的ΔH3为___________ 。
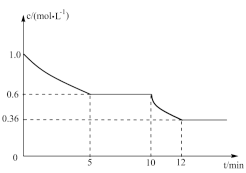
(2)一定温度下,在一体积固定的密闭容器中进行反应I,测得CO2的物质的量浓度随反应时间的变化如图所示:则反应进行的前5分钟内,v(H2)=______ ;10min时,改变的外界条件可能是_______ (任写两点)
(3)将CO2和H2按物质的量之比1:1投料发生反应II,下列不能说明反应已达平衡的是______(填序号)。
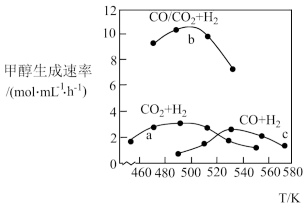
(4)如图为一定比例的CO2+H2、CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。490K时,根据曲线a、c可判断合成甲醇的反应机理是___________ (填“A”或“B”)。
A.CO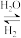 CO2
CO2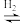 CH3OH+H2O
CH3OH+H2O
B.CO2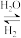 CO
CO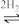 CH3OH
CH3OH
(5)已知一定温度下按照起始比 =3,在一密闭容器中进行反应III,保持总压为2.1MPa不变,达平衡时CO的平衡转化率为
=3,在一密闭容器中进行反应III,保持总压为2.1MPa不变,达平衡时CO的平衡转化率为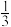 ,则该条件下用平衡体系中各气体分压表示的平衡常数(Kp)的计算式为Kp=
,则该条件下用平衡体系中各气体分压表示的平衡常数(Kp)的计算式为Kp=___________ (保留2位有效数字)(各气体分压=平衡体系中各气体的体积分数×总压)。
(6)C2H6(g)+2CO2(g)⇌4CO(g)+3H2(g)ΔH=+430kJ/mol,在四种不同的容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_________ (填标号)。
a.恒温恒容容器b.恒容绝热容器c.恒压绝热容器d.恒温恒压容器
已知CO2经催化加氢可以生成多种低碳有机物。
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH=-49.5kJ·mol-1
II.CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH=+40.9kJ·mol-1
III.CO(g)+2H2(g)⇌CH3OH(g)ΔH3
回答下列问题:
(1)反应III的ΔH3为
(2)一定温度下,在一体积固定的密闭容器中进行反应I,测得CO2的物质的量浓度随反应时间的变化如图所示:则反应进行的前5分钟内,v(H2)=

(3)将CO2和H2按物质的量之比1:1投料发生反应II,下列不能说明反应已达平衡的是______(填序号)。
| A.CO的浓度保持不变 |
| B.CO2和H2的转化率相等 |
| C.混合气体中CO2的百分含量不再发生变化 |
| D.单位时间内体系中减少1molH2的同时有1molH2O增加 |

A.CO
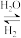 CO2
CO2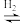 CH3OH+H2O
CH3OH+H2OB.CO2
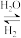 CO
CO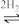 CH3OH
CH3OH(5)已知一定温度下按照起始比
 =3,在一密闭容器中进行反应III,保持总压为2.1MPa不变,达平衡时CO的平衡转化率为
=3,在一密闭容器中进行反应III,保持总压为2.1MPa不变,达平衡时CO的平衡转化率为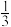 ,则该条件下用平衡体系中各气体分压表示的平衡常数(Kp)的计算式为Kp=
,则该条件下用平衡体系中各气体分压表示的平衡常数(Kp)的计算式为Kp=(6)C2H6(g)+2CO2(g)⇌4CO(g)+3H2(g)ΔH=+430kJ/mol,在四种不同的容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是
a.恒温恒容容器b.恒容绝热容器c.恒压绝热容器d.恒温恒压容器
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】利用二氧化碳氢化法合成二甲醚,可实现二氧化碳再利用。其中涉及的反应有:
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H1=-48.1kJ/mol
CH3OH(g)+H2O(g) ∆H1=-48.1kJ/mol
II.2CH3OH(g) CH3OCH3(g)+H2O(g) ∆H2=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ∆H2=-24.5kJ/mol
III.CO2(g)+H2(g) CO(g)+H2O(g) ∆H3=+41.2kJ/mol
CO(g)+H2O(g) ∆H3=+41.2kJ/mol
已知:生物A的选择性S=
回答下列问题:
(1)写出CO2(g)与H2(g)转化为CH3OCH3(g)和H2O(g)(反应IV)的热化学方程式:___________
(2)在恒温(T>373 K)恒容条件下,将一定量的CO2、H2通入密闭容器中(含催化剂)发生上述反应。下列不能够说明该反应体系已达化学平衡状态的是___________ (填标号)。
A.n(CH3OH):n(CH3OCH3)=2:1
B.反应I中v正(H2)=3v逆(CH3OH)
C.混合气体的平均相对分子质量不变
D.混合气体的密度不变
E.CO2的转化率不变
(3)在3.0 MPa下,研究人员在恒压密闭容器中充人4 mol H2和l mol CO2发生反应,CO2 的平衡转化率和生成物的选择性随温度变化如图1所示(不考虑其他因素影响):
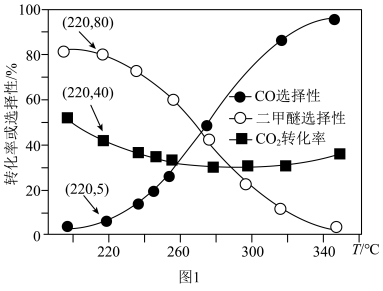
①在220℃条件下,平衡时n(CH3OCH3)=___________ ,计算反应2CH3OH(g) CH3OCH3(g)+H2O(g)在220℃下的平衡常数为
CH3OCH3(g)+H2O(g)在220℃下的平衡常数为___________ (结果保留三位有效数字)。
②温度高于280℃,CO2平衡转化率随温度升高而上升的原因是___________ 。
I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H1=-48.1kJ/mol
CH3OH(g)+H2O(g) ∆H1=-48.1kJ/molII.2CH3OH(g)
 CH3OCH3(g)+H2O(g) ∆H2=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ∆H2=-24.5kJ/molIII.CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H3=+41.2kJ/mol
CO(g)+H2O(g) ∆H3=+41.2kJ/mol已知:生物A的选择性S=

回答下列问题:
(1)写出CO2(g)与H2(g)转化为CH3OCH3(g)和H2O(g)(反应IV)的热化学方程式:
(2)在恒温(T>373 K)恒容条件下,将一定量的CO2、H2通入密闭容器中(含催化剂)发生上述反应。下列不能够说明该反应体系已达化学平衡状态的是
A.n(CH3OH):n(CH3OCH3)=2:1
B.反应I中v正(H2)=3v逆(CH3OH)
C.混合气体的平均相对分子质量不变
D.混合气体的密度不变
E.CO2的转化率不变
(3)在3.0 MPa下,研究人员在恒压密闭容器中充人4 mol H2和l mol CO2发生反应,CO2 的平衡转化率和生成物的选择性随温度变化如图1所示(不考虑其他因素影响):

①在220℃条件下,平衡时n(CH3OCH3)=
 CH3OCH3(g)+H2O(g)在220℃下的平衡常数为
CH3OCH3(g)+H2O(g)在220℃下的平衡常数为②温度高于280℃,CO2平衡转化率随温度升高而上升的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇和水蒸气重整制氢的部分反应过程如下图所示:
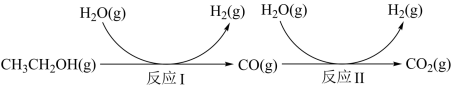
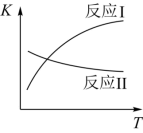
已知:反应Ⅰ和反应Ⅱ的平衡常数随温度变化曲线如图所示。
(1)反应Ⅰ中,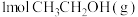 参与反应后的热量变化是
参与反应后的热量变化是 。
。
①反应Ⅰ的热化学方程式是___________ 。
②反应Ⅰ在较高温度下能够自发进行的原因是___________ 。
③已知绝热恒压下,下列说法能够判断反应Ⅰ达到化学平衡状态的是___________ (填字母)。
A 的含量保持不变 B.容器中压强保持不变
的含量保持不变 B.容器中压强保持不变
C.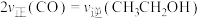 D.体系的温度保持不变
D.体系的温度保持不变
(2)反应Ⅱ中
①某温度下,已知 和
和 的起始浓度总和为
的起始浓度总和为 ,且
,且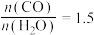 的投料比下,
的投料比下, 的平衡转化率为40%,该温度下反应平衡常数的值为
的平衡转化率为40%,该温度下反应平衡常数的值为___________ 。
②当不同的进气比[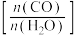 达到相同的
达到相同的 平衡转化率时,对应的反应温度和进气比的关系是
平衡转化率时,对应的反应温度和进气比的关系是___________ 。
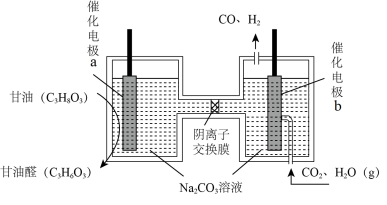
(3)我国科学家设计了一种电解装置如图所示,能将二氧化碳转化成合成气 和
和 ,同时获得甘油醛
,同时获得甘油醛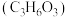 。a极接电源的
。a极接电源的___________ 极;若阴离子交换膜只允许 离子通过,当有
离子通过,当有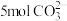 通过时,理论上可制得甘油醛
通过时,理论上可制得甘油醛___________ g。


已知:反应Ⅰ和反应Ⅱ的平衡常数随温度变化曲线如图所示。
(1)反应Ⅰ中,
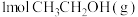 参与反应后的热量变化是
参与反应后的热量变化是 。
。①反应Ⅰ的热化学方程式是
②反应Ⅰ在较高温度下能够自发进行的原因是
③已知绝热恒压下,下列说法能够判断反应Ⅰ达到化学平衡状态的是
A
 的含量保持不变 B.容器中压强保持不变
的含量保持不变 B.容器中压强保持不变C.
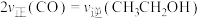 D.体系的温度保持不变
D.体系的温度保持不变(2)反应Ⅱ中
①某温度下,已知
 和
和 的起始浓度总和为
的起始浓度总和为 ,且
,且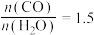 的投料比下,
的投料比下, 的平衡转化率为40%,该温度下反应平衡常数的值为
的平衡转化率为40%,该温度下反应平衡常数的值为②当不同的进气比[
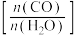 达到相同的
达到相同的 平衡转化率时,对应的反应温度和进气比的关系是
平衡转化率时,对应的反应温度和进气比的关系是(3)我国科学家设计了一种电解装置如图所示,能将二氧化碳转化成合成气
 和
和 ,同时获得甘油醛
,同时获得甘油醛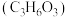 。a极接电源的
。a极接电源的 离子通过,当有
离子通过,当有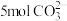 通过时,理论上可制得甘油醛
通过时,理论上可制得甘油醛
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】I.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
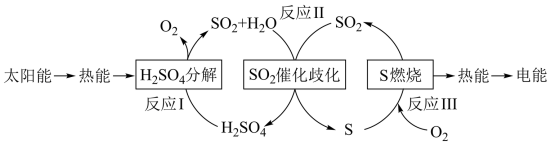
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:___________ 。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2___________ p 1(填“>”或“<”),得出该结论的理由是___________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.________
I2+2H2O+___________=___________+___________+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=___________ 。
②比较A、B、C,可得出的结论是___________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:___________
(5)一定温度下,反应I2(g)+H2(g)⇌2Hl(g)在密闭容器中达到平衡时,测得c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.78mmol•L-1.相同度温下,按下列4组初始浓度进行实验,反应逆向进行的是___________ 。
(注:1mmol•L-1=10-3mol•L-1)
Ⅱ.以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。
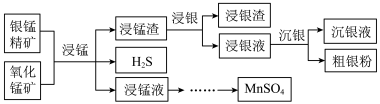
已知:酸性条件下,MnO2的氧化性强于Fe3+。
“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
(6)将“浸银”反应的离子方程式补充完整:_______
□Fe3+ + Ag2S + □ ___________ □ ___________ + 2[AgCl2]- + S
□ ___________ + 2[AgCl2]- + S
(7)结合平衡移动原理,解释浸出剂中Cl-、H+的作用:___________ 。

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.
I2+2H2O+___________=___________+___________+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| 序号 | A | B | C | D |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
(5)一定温度下,反应I2(g)+H2(g)⇌2Hl(g)在密闭容器中达到平衡时,测得c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.78mmol•L-1.相同度温下,按下列4组初始浓度进行实验,反应逆向进行的是
| A | B | C | D | |
| c(I2)/mmol•L-1 | 1.00 | 0.22 | 0.44 | 0.11 |
| c(H2)/mmol•L-1 | 1.00 | 0.22 | 0.44 | 0.44 |
| c(HI)/mmol•L-1 | 1.00 | 1.56 | 4.00 | 1.56 |
Ⅱ.以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。

已知:酸性条件下,MnO2的氧化性强于Fe3+。
“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
(6)将“浸银”反应的离子方程式补充完整:
□Fe3+ + Ag2S + □ ___________
 □ ___________ + 2[AgCl2]- + S
□ ___________ + 2[AgCl2]- + S(7)结合平衡移动原理,解释浸出剂中Cl-、H+的作用:
您最近一年使用:0次
【推荐3】乙烯被广泛用于合成聚乙烯等聚合产品。工业生产的乙烯中含有的少量乙炔会导致聚合催化剂中毒失活,含有的乙烷会使聚合过程终止。因此乙炔的选择加氢制乙烯在生产中有重大经济意义。反应原理如下:
反应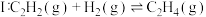 (主反应)
(主反应)
反应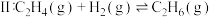 (副反应)
(副反应)
回答下列问题:
(1)分别以 乙炔和
乙炔和  氢气或
氢气或  乙烯为初始原料,在
乙烯为初始原料,在 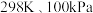 下,使用对反应
下,使用对反应  选择性好的催化剂,分别在恒压容器中反应,达平衡时,以乙炔和氢气为原料,体系向环境放热
选择性好的催化剂,分别在恒压容器中反应,达平衡时,以乙炔和氢气为原料,体系向环境放热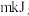 以乙烯为原料,体系从环境吸热
以乙烯为原料,体系从环境吸热 ,忽略副反应热效应,反应焓变
,忽略副反应热效应,反应焓变
___________  。
。
(2)初始条件同上,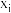 表示某物种
表示某物种  的物质的量与除
的物质的量与除  外其它各物种总物质的量之比,
外其它各物种总物质的量之比,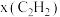 和
和  随时间
随时间 变化关系如图所示,实验测得
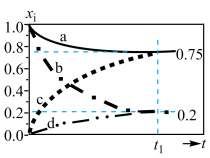
变化关系如图所示,实验测得 ,则图中表示
,则图中表示 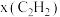 变化的曲线是
变化的曲线是___________ ;反应I平衡常数Kp=___________  ;以乙炔和氢气为原料时,
;以乙炔和氢气为原料时,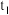 时刻
时刻 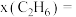
___________ 。
(3) 在催化剂表面逐步加氢,当变成
在催化剂表面逐步加氢,当变成 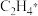 时,
时,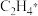 可从催化剂表面脱附生成
可从催化剂表面脱附生成 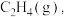 也可以继续加氢。清华大学李亚林团队找到一种催化剂,可使
也可以继续加氢。清华大学李亚林团队找到一种催化剂,可使 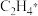 脱附生成
脱附生成 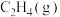 而不继续加氢,使催化产物停留在乙烯而不继续加氢生成乙烷。下面是两种催化剂(①
而不继续加氢,使催化产物停留在乙烯而不继续加氢生成乙烷。下面是两种催化剂(① 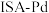 和②
和②  )分别催化乙炔加氢的反应机理:
)分别催化乙炔加氢的反应机理:
在催化剂② 作用下,
作用下,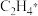 倾向于
倾向于___________ (填“脱附”或“加氢”),结合图中数据,推测清华大学团队找到的理想催化剂是___________ (填“①”或“②”),原因是在该催化剂上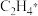 的脱附能
的脱附能___________ (填“高于”或“低于”) 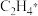 进一步加氢需要突破的能垒,该催化剂具有好的选择性。
进一步加氢需要突破的能垒,该催化剂具有好的选择性。
反应
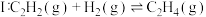 (主反应)
(主反应)反应
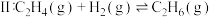 (副反应)
(副反应)回答下列问题:
(1)分别以
 乙炔和
乙炔和  氢气或
氢气或  乙烯为初始原料,在
乙烯为初始原料,在 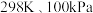 下,使用对反应
下,使用对反应  选择性好的催化剂,分别在恒压容器中反应,达平衡时,以乙炔和氢气为原料,体系向环境放热
选择性好的催化剂,分别在恒压容器中反应,达平衡时,以乙炔和氢气为原料,体系向环境放热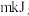 以乙烯为原料,体系从环境吸热
以乙烯为原料,体系从环境吸热 ,忽略副反应热效应,反应焓变
,忽略副反应热效应,反应焓变
 。
。(2)初始条件同上,
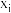 表示某物种
表示某物种  的物质的量与除
的物质的量与除  外其它各物种总物质的量之比,
外其它各物种总物质的量之比,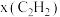 和
和  随时间
随时间 变化关系如图所示,实验测得
变化关系如图所示,实验测得 ,则图中表示
,则图中表示 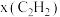 变化的曲线是
变化的曲线是 ;以乙炔和氢气为原料时,
;以乙炔和氢气为原料时,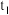 时刻
时刻 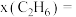

(3)
 在催化剂表面逐步加氢,当变成
在催化剂表面逐步加氢,当变成 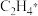 时,
时,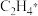 可从催化剂表面脱附生成
可从催化剂表面脱附生成 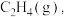 也可以继续加氢。清华大学李亚林团队找到一种催化剂,可使
也可以继续加氢。清华大学李亚林团队找到一种催化剂,可使 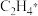 脱附生成
脱附生成 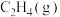 而不继续加氢,使催化产物停留在乙烯而不继续加氢生成乙烷。下面是两种催化剂(①
而不继续加氢,使催化产物停留在乙烯而不继续加氢生成乙烷。下面是两种催化剂(① 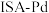 和②
和②  )分别催化乙炔加氢的反应机理:
)分别催化乙炔加氢的反应机理:
在催化剂②
 作用下,
作用下,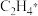 倾向于
倾向于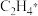 的脱附能
的脱附能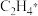 进一步加氢需要突破的能垒,该催化剂具有好的选择性。
进一步加氢需要突破的能垒,该催化剂具有好的选择性。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】合成气是一种重要的化工原料气,甲烷、二氧化碳自热重整制合成气的主要反应有:
Ⅰ.CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1=+247.3kJ·mol-1
2CO(g)+2H2(g) ΔH1=+247.3kJ·mol-1
Ⅱ.CH4(g)+H2O(g) CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1
CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)ΔH3=___________ kJ·mol-1。
(2)一定条件下,向VL恒容密闭容器中通入2molCH4(g)、1molCO2(g)、1molH2O(g)发生上述反应,达到平衡时,容器中CH4(g)为amol,CO2(g)为bmol,H2O(g)为cmol,此时CO(g)的浓度为___________ mol·L-1,反应Ⅲ的平衡常数为___________ 。(用含a、b、c、V的代数式表示)
(3)不同温度下,向VL密闭容器中按照n(CO2):n(CH4):n(H2O)=1:1:1投料,实验测得平衡时n(H2):n(CO)随温度的变化关系如图所示:
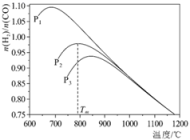
①压强p1、p2、p3由大到小的顺序为___________ ,判断的依据是___________ 。
②压强为p2时,随着温度升高,n(H2):n(CO)先增大后减小。解释温度Tm前后,随着温度升高n(H2):n(CO)变化的原因分别是___________ 。
(4)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图如下:
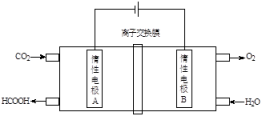
则A极的电极反应式为___________ 。
Ⅰ.CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH1=+247.3kJ·mol-1
2CO(g)+2H2(g) ΔH1=+247.3kJ·mol-1Ⅱ.CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1
CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1Ⅲ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3回答下列问题:
(1)ΔH3=
(2)一定条件下,向VL恒容密闭容器中通入2molCH4(g)、1molCO2(g)、1molH2O(g)发生上述反应,达到平衡时,容器中CH4(g)为amol,CO2(g)为bmol,H2O(g)为cmol,此时CO(g)的浓度为
(3)不同温度下,向VL密闭容器中按照n(CO2):n(CH4):n(H2O)=1:1:1投料,实验测得平衡时n(H2):n(CO)随温度的变化关系如图所示:

①压强p1、p2、p3由大到小的顺序为
②压强为p2时,随着温度升高,n(H2):n(CO)先增大后减小。解释温度Tm前后,随着温度升高n(H2):n(CO)变化的原因分别是
(4)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图如下:

则A极的电极反应式为
您最近一年使用:0次
【推荐2】铁的化合物在生产生活和科学实验中应用广泛。请按要求回答下列问题:
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。已知:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.0kJ/mol
①反应Fe2O3(s)+3CH4(g) 2Fe(s)+3CO(g)+6H2(g)的ΔH=
2Fe(s)+3CO(g)+6H2(g)的ΔH=_____________ 。
②若该反应在5 L的密闭容器中进行5 min 后达到平衡,测得体系中固体质量减少0.96 g,则该段时间内CO的平均反应速率为________________ 。
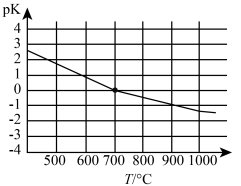
③该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如图。试用平衡移动原理解释该曲线的变化规律:______________ 。若700°C时测得平衡时,H2浓度为1.0 mol·L-1,则CH4的平衡转化率为____________ 。
(2)常温下FeCO3的溶度积常数为Ksp(FeCO3),H2CO3的一级电离常数和二级电离常数分别为Ka1和Ka2。已知菱铁矿的主要成分是FeCO3,实验室中可以通过FeSO4与足量NaHCO3溶液混合制得FeCO3,常温下该反应的平衡常数K=__________ [用含有Ksp(FeCO3)、Ka1和Ka2的代数式表示]。
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备,请写出阳极的电极反应式:__________________ 。
(4)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物立方晶胞结构如图所示。
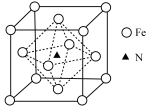
①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置是____________ 。
②该化合物晶胞中距离最近的铁原子和氮原子的距离为a pm,阿伏加德罗常数的值为NA,则该晶胞的密度为___________ g·cm-3(列式计算即可)。
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。已知:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.0kJ/mol
①反应Fe2O3(s)+3CH4(g)
 2Fe(s)+3CO(g)+6H2(g)的ΔH=
2Fe(s)+3CO(g)+6H2(g)的ΔH=②若该反应在5 L的密闭容器中进行5 min 后达到平衡,测得体系中固体质量减少0.96 g,则该段时间内CO的平均反应速率为
③该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如图。试用平衡移动原理解释该曲线的变化规律:

(2)常温下FeCO3的溶度积常数为Ksp(FeCO3),H2CO3的一级电离常数和二级电离常数分别为Ka1和Ka2。已知菱铁矿的主要成分是FeCO3,实验室中可以通过FeSO4与足量NaHCO3溶液混合制得FeCO3,常温下该反应的平衡常数K=
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备,请写出阳极的电极反应式:
(4)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物立方晶胞结构如图所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置是
②该化合物晶胞中距离最近的铁原子和氮原子的距离为a pm,阿伏加德罗常数的值为NA,则该晶胞的密度为
您最近一年使用:0次
【推荐3】Ⅰ.页岩气中含有 、
、 、
、 等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的
等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的 和
和 。
。
(1) 和
和 在Cu/ZnO催化下发生反应可合成清洁能源甲醇:
在Cu/ZnO催化下发生反应可合成清洁能源甲醇: ,该反应实际上分两步进行。
,该反应实际上分两步进行。
断开(或形成)1mol化学键的能量变化数据如下表所示,利用下表中的数据可知,该反应每生成1mol甲醇,需要___________ (填“吸收”或“放出”)___________ kJ的热量。
(2)可利用 热分解制备
热分解制备 ,已知下列反应的热化学方程式:
,已知下列反应的热化学方程式:
①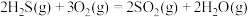
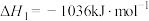
②
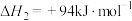
③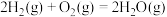
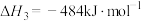
计算 热分解反应④
热分解反应④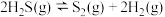

___________  。
。
(3) 重整技术是实现“碳中和”的一种理想的
重整技术是实现“碳中和”的一种理想的 利用技术,反应为:
利用技术,反应为: 。在pMPa时,将
。在pMPa时,将 和
和 按物质的量之为1:1:充入密闭容器中,分别在无催化剂及
按物质的量之为1:1:充入密闭容器中,分别在无催化剂及 催化下反应相同时间,测得
催化下反应相同时间,测得 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示:
在pMPa、900℃、 催化条件下,将
催化条件下,将 、
、 、
、 按物质的量之比为
按物质的量之比为 充入密闭容器,
充入密闭容器, 的平衡转化率为
的平衡转化率为 ,此时平衡常数
,此时平衡常数
___________ (以分压表示,分压=总压×物质的量分数;写出含 、
、 、
、 的计算表达式)。
的计算表达式)。
Ⅱ.回收利用工业废气中的 和
和 ,实验原理示意图如下。
,实验原理示意图如下。
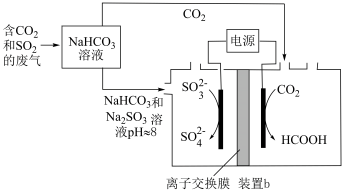
(4)①装置b中 参与反应的电极为
参与反应的电极为___________ 极(填“正”、“负”、“阴”或“阳”)
②反应后装置b中溶液pH变化___________ (填“增大”、“减小”或“不变”)
③装置b中的总反应的离子方程式为___________ 。
 、
、 、
、 等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的
等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的 和
和 。
。(1)
 和
和 在Cu/ZnO催化下发生反应可合成清洁能源甲醇:
在Cu/ZnO催化下发生反应可合成清洁能源甲醇: ,该反应实际上分两步进行。
,该反应实际上分两步进行。断开(或形成)1mol化学键的能量变化数据如下表所示,利用下表中的数据可知,该反应每生成1mol甲醇,需要
| 化学键 | H-H | C-O | C=O | O-H | C-H |
 | 436 | 326 | 803 | 464 | 414 |
(2)可利用
 热分解制备
热分解制备 ,已知下列反应的热化学方程式:
,已知下列反应的热化学方程式:①
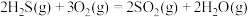
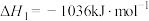
②

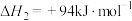
③
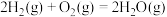
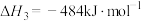
计算
 热分解反应④
热分解反应④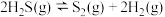

 。
。(3)
 重整技术是实现“碳中和”的一种理想的
重整技术是实现“碳中和”的一种理想的 利用技术,反应为:
利用技术,反应为: 。在pMPa时,将
。在pMPa时,将 和
和 按物质的量之为1:1:充入密闭容器中,分别在无催化剂及
按物质的量之为1:1:充入密闭容器中,分别在无催化剂及 催化下反应相同时间,测得
催化下反应相同时间,测得 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示:在pMPa、900℃、
 催化条件下,将
催化条件下,将 、
、 、
、 按物质的量之比为
按物质的量之比为 充入密闭容器,
充入密闭容器, 的平衡转化率为
的平衡转化率为 ,此时平衡常数
,此时平衡常数
 、
、 、
、 的计算表达式)。
的计算表达式)。
Ⅱ.回收利用工业废气中的
 和
和 ,实验原理示意图如下。
,实验原理示意图如下。
(4)①装置b中
 参与反应的电极为
参与反应的电极为②反应后装置b中溶液pH变化
③装置b中的总反应的离子方程式为
您最近一年使用:0次



