高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Si等元素)制备,工艺如下图所示。回答下列问题:
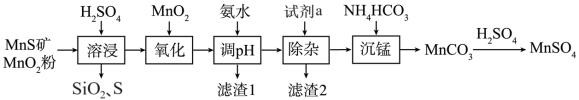
常温下,相关金属离子[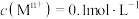 ]形成氢氧化物沉淀的pH范围如下:
]形成氢氧化物沉淀的pH范围如下:
(1)“氧化”过程中添加适量的 ,其作用是将溶液中的
,其作用是将溶液中的___________ 。
(2)通过表格中数据分析,通过“调pH”可以除铁和铝,溶液的pH范围为___________ 。
(3)根据表格中所给的信息,计算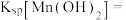
___________ , 沉淀完全的pH值,
沉淀完全的pH值,
___________ 。
(4)“除杂”是为了使溶液中的 变成沉淀从而除去,“除杂”的最佳试剂a为
变成沉淀从而除去,“除杂”的最佳试剂a为___________ 。(已知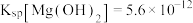 ,
, )
)
A.NaOH B.NaF C.
(5)在“沉锰”过程中用到 溶液将
溶液将 转化为
转化为 。根据表格所给信息,按要求完成下列问题。
。根据表格所给信息,按要求完成下列问题。
①试求出 的水解平衡常数
的水解平衡常数
___________ (保留小数点后一位)。
②在“沉锰”中用到的 溶液呈
溶液呈___________ 性(填“酸”、“碱”或“中”)。
③写出 溶液中的元素守恒关系式:
溶液中的元素守恒关系式:___________ 。

常温下,相关金属离子[
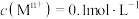 ]形成氢氧化物沉淀的pH范围如下:
]形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |  |
| 开始沉淀的pH | 8.0 | 6.3 | 1.5 | 3.4 | 8.9 |
| 沉淀完全的pH | x | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“氧化”过程中添加适量的
 ,其作用是将溶液中的
,其作用是将溶液中的(2)通过表格中数据分析,通过“调pH”可以除铁和铝,溶液的pH范围为
(3)根据表格中所给的信息,计算
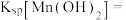
 沉淀完全的pH值,
沉淀完全的pH值,
(4)“除杂”是为了使溶液中的
 变成沉淀从而除去,“除杂”的最佳试剂a为
变成沉淀从而除去,“除杂”的最佳试剂a为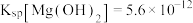 ,
, )
)A.NaOH B.NaF C.

(5)在“沉锰”过程中用到
 溶液将
溶液将 转化为
转化为 。根据表格所给信息,按要求完成下列问题。
。根据表格所给信息,按要求完成下列问题。| 电解质 | 电离平衡常数(25℃) |
 | 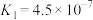  |
 |  |
 的水解平衡常数
的水解平衡常数
②在“沉锰”中用到的
 溶液呈
溶液呈③写出
 溶液中的元素守恒关系式:
溶液中的元素守恒关系式:
更新时间:2023-11-23 16:07:20
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】在实验中通常用滴定法测定物质的浓度或进行定量实验
(1)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.100mol/L的氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
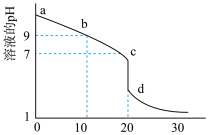
①d点所示的溶液中离子浓度由大到小的顺序依次为____ 。
②b点所示的溶液中c(NH )—c(NH3•H2O)=
)—c(NH3•H2O)=____ mol/L(写出准确数值)。
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用0.1000mo/LNaOH标准溶液进行滴定。
①碱式滴定管排气泡时,应选择图中的____ (填字母);
a. b.
b. c.
c.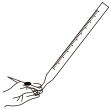 d.
d.
②滴定达到终点的标志是____ 。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有____ 。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.100mol/L的氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

①d点所示的溶液中离子浓度由大到小的顺序依次为
②b点所示的溶液中c(NH
 )—c(NH3•H2O)=
)—c(NH3•H2O)=(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用0.1000mo/LNaOH标准溶液进行滴定。
①碱式滴定管排气泡时,应选择图中的
a.
 b.
b. c.
c. d.
d.
②滴定达到终点的标志是
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】运用化学反应原理,研究元素化合物的反应具有重要意义。
(1)已知 (次磷酸)为一元弱酸,则
(次磷酸)为一元弱酸,则 与足量NaOH溶液充分反应的化学反应方程式为
与足量NaOH溶液充分反应的化学反应方程式为______ 。 易被氧化为
易被氧化为 ,
, , 溶液呈
, 溶液呈______ 性。(已知常温下 的电离常数为
的电离常数为 ,
,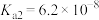 ,
,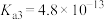 )
)
(2) 溶液呈碱性的原因是
溶液呈碱性的原因是______ (用离子方程式表示)。
(3)实验室在配制 溶液时,加蒸馏水前常将
溶液时,加蒸馏水前常将 固体先溶于适量盐酸中,其主要目的是
固体先溶于适量盐酸中,其主要目的是______
(4)请写出0.1 NaHS溶液中的电荷守恒关系式:
NaHS溶液中的电荷守恒关系式:______
(5)已知几种离子开始沉淀时溶液的pH如下表所示:
当向含有相同浓度的 、
、 、
、 的溶液中滴加氢氧化钠溶液时,
的溶液中滴加氢氧化钠溶液时,______ (填离子符号)先沉淀;
______ (填“>”“=”或“<”)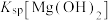 。
。
(1)已知
 (次磷酸)为一元弱酸,则
(次磷酸)为一元弱酸,则 与足量NaOH溶液充分反应的化学反应方程式为
与足量NaOH溶液充分反应的化学反应方程式为 易被氧化为
易被氧化为 ,
, , 溶液呈
, 溶液呈 的电离常数为
的电离常数为 ,
,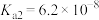 ,
,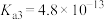 )
)(2)
 溶液呈碱性的原因是
溶液呈碱性的原因是(3)实验室在配制
 溶液时,加蒸馏水前常将
溶液时,加蒸馏水前常将 固体先溶于适量盐酸中,其主要目的是
固体先溶于适量盐酸中,其主要目的是(4)请写出0.1
 NaHS溶液中的电荷守恒关系式:
NaHS溶液中的电荷守恒关系式:(5)已知几种离子开始沉淀时溶液的pH如下表所示:
| 离子 |  |  |  |
| pH | 7.6 | 5.2 | 10.4 |
 、
、 、
、 的溶液中滴加氢氧化钠溶液时,
的溶液中滴加氢氧化钠溶液时,
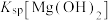 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】解析图像是科研工作者的一项重要能力,也是中学生必备素养。回答下列问题:
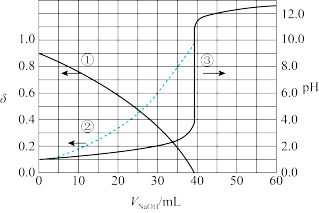
(1)以酚酞为指示剂,用 NaOH溶液滴定20.00mL未知浓度的
NaOH溶液滴定20.00mL未知浓度的 溶液。pH、分布系数
溶液。pH、分布系数 随NaOH溶液体积
随NaOH溶液体积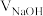 的变化关系如图。已知
的变化关系如图。已知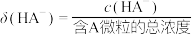 写出
写出 的电离方程式
的电离方程式___________ 。HA-的电离常数
___________ 。
(2)浓度均为0.10mo/L、体积均为 的MOH和ROH溶液,分别加水稀释至体积V,pH随
的MOH和ROH溶液,分别加水稀释至体积V,pH随 的变化如图所示,ROH的电离程度:b点
的变化如图所示,ROH的电离程度:b点___________ (填“>”“<”或“=”)a点,当 =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则
___________ (填“增大”、“减小”或“不变”),b点___________ (填“>”“<”“=”或“不能确定”)c点水的电离程度。

(3)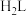 为某常见配体,其
为某常见配体,其 ,
,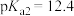 。常温下构建Fe(Ⅲ)-H2L溶液体系,其中
。常温下构建Fe(Ⅲ)-H2L溶液体系,其中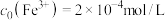 ,
,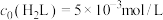 。体系中含Fe物种的组分分布系数
。体系中含Fe物种的组分分布系数 与pH的关系如图所示,已知:
与pH的关系如图所示,已知: ,分布系数
,分布系数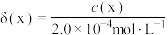 。
。

①当 时,参与配位的
时,参与配位的
___________ 。
②pH在9.5~10.5之间,含L的物种主要为___________ (填“L2-”“HL-”或“H2L”)。
(1)以酚酞为指示剂,用
 NaOH溶液滴定20.00mL未知浓度的
NaOH溶液滴定20.00mL未知浓度的 溶液。pH、分布系数
溶液。pH、分布系数 随NaOH溶液体积
随NaOH溶液体积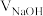 的变化关系如图。已知
的变化关系如图。已知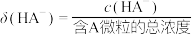 写出
写出 的电离方程式
的电离方程式

(2)浓度均为0.10mo/L、体积均为
 的MOH和ROH溶液,分别加水稀释至体积V,pH随
的MOH和ROH溶液,分别加水稀释至体积V,pH随 的变化如图所示,ROH的电离程度:b点
的变化如图所示,ROH的电离程度:b点 =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则

(3)
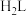 为某常见配体,其
为某常见配体,其 ,
,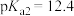 。常温下构建Fe(Ⅲ)-H2L溶液体系,其中
。常温下构建Fe(Ⅲ)-H2L溶液体系,其中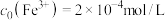 ,
,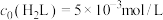 。体系中含Fe物种的组分分布系数
。体系中含Fe物种的组分分布系数 与pH的关系如图所示,已知:
与pH的关系如图所示,已知: ,分布系数
,分布系数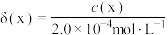 。
。
①当
 时,参与配位的
时,参与配位的
②pH在9.5~10.5之间,含L的物种主要为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3.下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题:
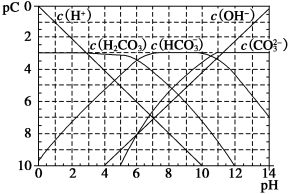
(1)在人体血液中, 能起到使人体血液pH保持在7.35~7.45的作用。
能起到使人体血液pH保持在7.35~7.45的作用。
①请用电解质溶液中的平衡解释:___________ (用离子方程式表示)。
②正常人体血液中, 的水解程度
的水解程度___________ 电离程度(填“<”“>”或“=”)。
③pH=7.00的血液中,c(H2CO3)___________ c( )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
(2)H2CO3一级电离平衡常数的数值 ≈
≈___________ 。
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的C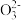 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确___________ 。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15 mol·L-1.c(C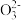 )=0.075mol·L-1.若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生
)=0.075mol·L-1.若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生___________ 。

(1)在人体血液中,
 能起到使人体血液pH保持在7.35~7.45的作用。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释:
②正常人体血液中,
 的水解程度
的水解程度③pH=7.00的血液中,c(H2CO3)
 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。(2)H2CO3一级电离平衡常数的数值
 ≈
≈(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的C
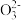 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15 mol·L-1.c(C
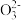 )=0.075mol·L-1.若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生
)=0.075mol·L-1.若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、 、CaO)制备草酸镍晶体(
、CaO)制备草酸镍晶体(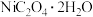 )的流程如下:
)的流程如下:

回答下列问题:
(1)“酸浸”时,为了提高镍的浸取率,可采取的措施是_______ (填两种措施);“滤渣I”的主要成分为_______ 。
(2)“除铁”时,加入NaClO发生反应的离子方程式为_______ 。若要使 恰好沉淀完全,则溶液中
恰好沉淀完全,则溶液中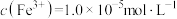 ,此时溶液的pH是
,此时溶液的pH是_______ (已知常温下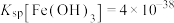 ,
, )。
)。
(3)“萃取”操作中使用的玻璃仪器有_______ 。向溶液中加入有机萃取剂萃取、分液,此时杂质处于_______ (填“有机层”或“无机层”)中。
(4)加草酸铵“沉镍”得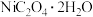 的离子方程式为
的离子方程式为_______ 。
(5)称量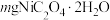 高温分解,测得固体的失重率[(原固体质量−剩余固体质量)/原固体质量]与温度关系曲线如图所示,加热至400℃发生的总反应的化学方程式为
高温分解,测得固体的失重率[(原固体质量−剩余固体质量)/原固体质量]与温度关系曲线如图所示,加热至400℃发生的总反应的化学方程式为_______ 。

 、CaO)制备草酸镍晶体(
、CaO)制备草酸镍晶体(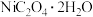 )的流程如下:
)的流程如下:
回答下列问题:
(1)“酸浸”时,为了提高镍的浸取率,可采取的措施是
(2)“除铁”时,加入NaClO发生反应的离子方程式为
 恰好沉淀完全,则溶液中
恰好沉淀完全,则溶液中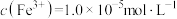 ,此时溶液的pH是
,此时溶液的pH是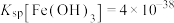 ,
, )。
)。(3)“萃取”操作中使用的玻璃仪器有
(4)加草酸铵“沉镍”得
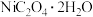 的离子方程式为
的离子方程式为(5)称量
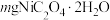 高温分解,测得固体的失重率[(原固体质量−剩余固体质量)/原固体质量]与温度关系曲线如图所示,加热至400℃发生的总反应的化学方程式为
高温分解,测得固体的失重率[(原固体质量−剩余固体质量)/原固体质量]与温度关系曲线如图所示,加热至400℃发生的总反应的化学方程式为
您最近一年使用:0次
【推荐3】氮化镓(GaN)是具有优异光电性能的第三代半导体材料。利用炼锌矿渣[主要含铁酸锌 、铁酸镓
、铁酸镓 、
、 ]制备GaN并回收金属元素的一种工艺流程如下图:
]制备GaN并回收金属元素的一种工艺流程如下图: 、
、 在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为_______ 。
(2)“酸浸”所得浸出液中 、
、 浓度分别为1mol/L和0.003mol/L。常温下,为尽可能多地提取
浓度分别为1mol/L和0.003mol/L。常温下,为尽可能多地提取 同时确保不混入
同时确保不混入 ,“调pH”时须:4≤pH<
,“调pH”时须:4≤pH<_______ (假设调pH时溶液体积不变)。已知常温下,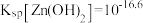 ,
, 。
。
(3)“脱铁”和“反萃取”时,所用盐酸的浓度
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(4)回收金属元素时,锌主要从_______ 中回收(填序号,后同),铁主要从_______ 中回收。
A.滤液 B.水相1 C.水相2 D.有机相
(5)由Ga制备 的部分工艺如下图:
的部分工艺如下图: (乙醚)和
(乙醚)和 (三正辛胺)均为配体;
(三正辛胺)均为配体;
(ii) 沸点:55.7℃,
沸点:55.7℃, 沸点:34.6℃,
沸点:34.6℃, 沸点:365.8℃。
沸点:365.8℃。
①比较分子中的C-Ga-C键角大小:
_____ 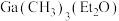 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②直接分解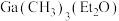 不能制备超纯
不能制备超纯 ,采用“配体交换”工艺制备超纯
,采用“配体交换”工艺制备超纯 的理由是
的理由是_______ 。
(6)MOCVD法是通过 与
与 反应得到GaN和另一种产物,写出该反应的化学方程式:
反应得到GaN和另一种产物,写出该反应的化学方程式:_______ 。
(7)GaN晶体的一种六方晶胞如下图所示。该晶体的密度为_______  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、铁酸镓
、铁酸镓 、
、 ]制备GaN并回收金属元素的一种工艺流程如下图:
]制备GaN并回收金属元素的一种工艺流程如下图: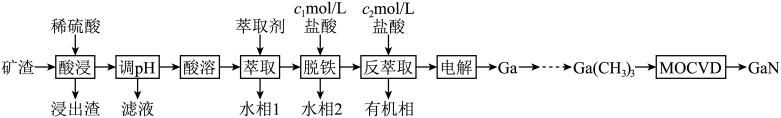
 、
、 在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。| 盐酸浓度(mol/L) | 反萃取率(%) | |
 |  | |
| 2 | 86.9 | 9.4 |
| 4 | 69.1 | 52.1 |
| 6 | 17.5 | 71.3 |
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)“酸浸”所得浸出液中
 、
、 浓度分别为1mol/L和0.003mol/L。常温下,为尽可能多地提取
浓度分别为1mol/L和0.003mol/L。常温下,为尽可能多地提取 同时确保不混入
同时确保不混入 ,“调pH”时须:4≤pH<
,“调pH”时须:4≤pH<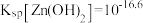 ,
, 。
。(3)“脱铁”和“反萃取”时,所用盐酸的浓度

 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(4)回收金属元素时,锌主要从
A.滤液 B.水相1 C.水相2 D.有机相
(5)由Ga制备
 的部分工艺如下图:
的部分工艺如下图:
 (乙醚)和
(乙醚)和 (三正辛胺)均为配体;
(三正辛胺)均为配体;(ii)
 沸点:55.7℃,
沸点:55.7℃, 沸点:34.6℃,
沸点:34.6℃, 沸点:365.8℃。
沸点:365.8℃。①比较分子中的C-Ga-C键角大小:

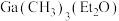 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②直接分解
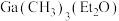 不能制备超纯
不能制备超纯 ,采用“配体交换”工艺制备超纯
,采用“配体交换”工艺制备超纯 的理由是
的理由是(6)MOCVD法是通过
 与
与 反应得到GaN和另一种产物,写出该反应的化学方程式:
反应得到GaN和另一种产物,写出该反应的化学方程式:(7)GaN晶体的一种六方晶胞如下图所示。该晶体的密度为
 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。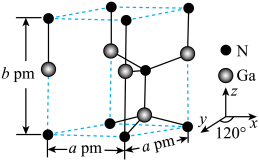
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务。
(1)被称作海洋元素的是_________________ (写元素符号)。
(2)工业上常以饱和食盐水为原料制备氯气,请写出反应的化学反应方程式___________ 。
(3)从海水中提取食盐和溴的过程如下:

①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式___ 。
②步骤Ⅱ中通入空气吹出溴,是利用了溴的___ 性质,步骤Ⅲ得到工业溴的化学方程式为:______ 。
(1)被称作海洋元素的是
(2)工业上常以饱和食盐水为原料制备氯气,请写出反应的化学反应方程式
(3)从海水中提取食盐和溴的过程如下:

①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式
②步骤Ⅱ中通入空气吹出溴,是利用了溴的
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】利用金属矿渣(含有FeS2、SiO2及Cu2O)制备(NH4)2Fe(SO4)2晶体的实验流程如下。
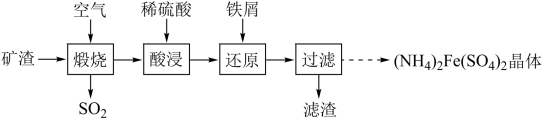
(1)煅烧过程中FeS2和Cu2O转化为Fe2O3和CuO。FeS2与O2反应生成Fe2O3和SO2的化学方程式为___________ 。
(2)为提高酸浸过程中铁的浸出率,实验中可采取的措施有___________ 。(填字母)。
A.增加矿渣的投料量 B.将矿渣粉碎并搅拌
C.缩短酸浸的时间 D.适当提高酸浸温度
(3)向酸浸后的溶液中加入过量铁屑,除能将Fe3+转化为Fe2+外,还能___________ ;检验Fe3+是否完全被还原的实验操作是___________ 。
(4)煅烧生成的SO2用石灰乳吸收得到CaSO3浆料,以CaSO3浆料制备NaHSO3溶液的实验方案为___________ 。已知:2CaSO3+Na2SO4+H2SO4+4H2O=2CaSO4·2H2O+2NaHSO3;CaSO4·2H2O难溶于水;pH=4~6溶液中HSO3-能大量存在。实验中可选用的试剂:3 mol·L-1 Na2SO4,3 mol·L-1H2SO4,1mol·L-1 NaOH。

(1)煅烧过程中FeS2和Cu2O转化为Fe2O3和CuO。FeS2与O2反应生成Fe2O3和SO2的化学方程式为
(2)为提高酸浸过程中铁的浸出率,实验中可采取的措施有
A.增加矿渣的投料量 B.将矿渣粉碎并搅拌
C.缩短酸浸的时间 D.适当提高酸浸温度
(3)向酸浸后的溶液中加入过量铁屑,除能将Fe3+转化为Fe2+外,还能
(4)煅烧生成的SO2用石灰乳吸收得到CaSO3浆料,以CaSO3浆料制备NaHSO3溶液的实验方案为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
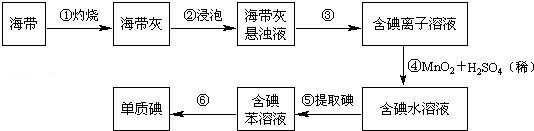
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______ (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______ ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______ 。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是_______ 。在分液操作中,应充分振荡,然后静置,待分层后______ (填标号),以下略。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】KMnO4是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分MnO2)为原料生产高锰酸钾的工艺路线如图:
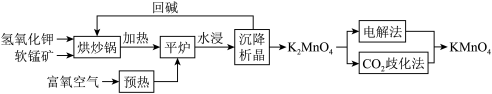
回答下列问题:
(1)原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是____ 。
(2)“平炉”中发生的化学方程式为:____ 。
(3)“平炉”中需要加压,其目的是____ 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应(同一价态的元素在发生氧化还原反应过程中发生了“化合价变化上的分歧”),反应中生成KMnO4、MnO2和____ (化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为____ 。阴极逸出的气体是(化学式)____ 。
③“电解法”和“CO2歧化法”,K2MnO4的理论利用率之比为____ 。
(5)高锰酸钾纯度的测定:称取1.080g样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为0.2000 mol•L-1的H2C2O4标准溶液20.00mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为25.00mL,该样品的纯度为____ 。

回答下列问题:
(1)原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是
(2)“平炉”中发生的化学方程式为:
(3)“平炉”中需要加压,其目的是
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应(同一价态的元素在发生氧化还原反应过程中发生了“化合价变化上的分歧”),反应中生成KMnO4、MnO2和
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为
③“电解法”和“CO2歧化法”,K2MnO4的理论利用率之比为
(5)高锰酸钾纯度的测定:称取1.080g样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为0.2000 mol•L-1的H2C2O4标准溶液20.00mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为25.00mL,该样品的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】高品质MnO2可用于生产锂离子电池正极材料锰酸锂。以软锰矿与黄铁矿为主要原料采用“两矿一步浸出法”制备高品质MnO2的某工艺流程如图所示:
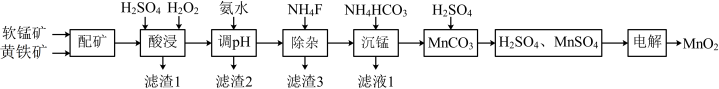
已知:①软锰矿与黄铁矿的主要成分分别为MnO2、FeS2,还含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的pH如下:
回答下列问题:
(1)“配矿”过程中,将软锰矿与黄铁矿粉碎混匀的目的是_______ 。
(2)“酸浸”操作中需先后分批加入H2SO4、H2O2。加入H2SO4后发生酸浸过程的主要反应离子方程式为2FeS2+3MnO2+12H+=2Fe3++3Mn2++4S+6H2O,2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。
①已知滤渣1的主要成分为S、SiO2、CaSO4等,其附着在矿粉颗粒表面使上述反应受阻,此时加入H2O2,利用其迅速分解产生的大量气泡可破除该不利影响。分析导致H2O2迅速分解的因素是_______ 。
②矿粉颗粒表面附着物被破除后,H2O2还可以继续与MnO2反应,从而提高锰元素的浸出率,该反应的化学方程式是_______ 。
(3)“调pH”时调节溶液pH范围为4.7~6.0,此时“滤渣2”的主要成分为_______ (填化学式)。
(4)“沉锰”步骤发生主要反应的离子方程式为_______ 。
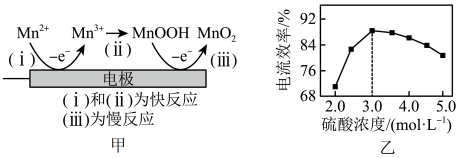
(5)利用惰性电极电解H2SO4—MnSO4—H2O体系获得MnO2的机理(部分)如图1甲所示,硫酸浓度与电流效率的关系如图2所示。硫酸浓度超过3.0 mol·L-1时,电流效率降低的原因是_______ 。

已知:①软锰矿与黄铁矿的主要成分分别为MnO2、FeS2,还含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的pH如下:
| 金属离子 | Fe2+ | Fe3+ | Mn2+ | Mg2+ | Al3+ |
| 开始沉淀pH | 6.9 | 1.9 | 6.6 | 9.1 | 3.4 |
| 沉淀完全(c=1.0×10-5 mol·L-1)的pH | 8.3 | 3.2 | 10.1 | 10.9 | 4.7 |
(1)“配矿”过程中,将软锰矿与黄铁矿粉碎混匀的目的是
(2)“酸浸”操作中需先后分批加入H2SO4、H2O2。加入H2SO4后发生酸浸过程的主要反应离子方程式为2FeS2+3MnO2+12H+=2Fe3++3Mn2++4S+6H2O,2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。
①已知滤渣1的主要成分为S、SiO2、CaSO4等,其附着在矿粉颗粒表面使上述反应受阻,此时加入H2O2,利用其迅速分解产生的大量气泡可破除该不利影响。分析导致H2O2迅速分解的因素是
②矿粉颗粒表面附着物被破除后,H2O2还可以继续与MnO2反应,从而提高锰元素的浸出率,该反应的化学方程式是
(3)“调pH”时调节溶液pH范围为4.7~6.0,此时“滤渣2”的主要成分为
(4)“沉锰”步骤发生主要反应的离子方程式为
(5)利用惰性电极电解H2SO4—MnSO4—H2O体系获得MnO2的机理(部分)如图1甲所示,硫酸浓度与电流效率的关系如图2所示。硫酸浓度超过3.0 mol·L-1时,电流效率降低的原因是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
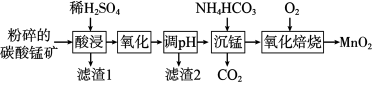
【推荐3】工业上以碳酸锰矿(主要含MnCO3,还含有SiO2、Al2O3、FeCO3等杂质)为原料制备MnO2的工艺流程如下图所示。
已知:常温下,溶液中金属离子开始沉淀和完全沉淀时的pH如表所示。
回答下列问题:
(1)“酸浸”前将碳酸锰矿粉碎的目的是___________ 。
(2)“氧化”时MnO2将Fe2+氧化成Fe3+的离子方程式为___________ 。
(3)“调pH”时应控制pH范围为___________ 。
(4)“沉锰”得到MnCO3,该过程需控制在较低温度下的原因是___________ 。
(5)“氧化焙烧”的化学方程式为___________ 。
(6)若以125kg该碳酸锰矿为原料制备MnO2,得到产品质量为87kg,则该碳酸锰矿的纯度是___________ 。(忽略流程中锰元素的损失)。

已知:常温下,溶液中金属离子开始沉淀和完全沉淀时的pH如表所示。
| 金属离子 |  |  |  | Mn2+ |
| 开始沉淀pH | 1.5 | 6.5 | 3.3 | 8.3 |
| 完全沉淀pH | 3.7 | 9.7 | 5.2 | 9.8 |
(1)“酸浸”前将碳酸锰矿粉碎的目的是
(2)“氧化”时MnO2将Fe2+氧化成Fe3+的离子方程式为
(3)“调pH”时应控制pH范围为
(4)“沉锰”得到MnCO3,该过程需控制在较低温度下的原因是
(5)“氧化焙烧”的化学方程式为
(6)若以125kg该碳酸锰矿为原料制备MnO2,得到产品质量为87kg,则该碳酸锰矿的纯度是
您最近一年使用:0次



