合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是_____ 。
(2)合成氨的反应原理为 ;在一容积为2L的密闭容器中加入一定量的
;在一容积为2L的密闭容器中加入一定量的 和0.5mol
和0.5mol ,在一定条件下发生合成氨反应,反应中
,在一定条件下发生合成氨反应,反应中 的物质的量浓度的变化情况如下图
的物质的量浓度的变化情况如下图
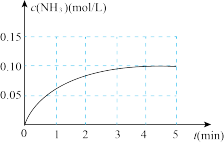
①根据上图,计算从反应开始到平衡时,平均反应速率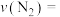
_____ 。
②平衡时测得 的物质的量为0.10mol,则的转化率
的物质的量为0.10mol,则的转化率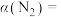
_____ ,该温度下的平衡常数
_____ 。
(3)对于反应 ,在一定条件下氨的平衡含量如下表。
,在一定条件下氨的平衡含量如下表。
①该反应为_____ (填“吸热”或“放热”)反应。
②其他条件不变时,温度升高,氨的平衡含量减小的原因是_____ 。
③哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是_____ 。
(1)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是
| 序号 | 化学反应 | K(298K)的数值 |
| ① |  |  |
| ② |  | 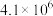 |
(2)合成氨的反应原理为
 ;在一容积为2L的密闭容器中加入一定量的
;在一容积为2L的密闭容器中加入一定量的 和0.5mol
和0.5mol ,在一定条件下发生合成氨反应,反应中
,在一定条件下发生合成氨反应,反应中 的物质的量浓度的变化情况如下图
的物质的量浓度的变化情况如下图
①根据上图,计算从反应开始到平衡时,平均反应速率
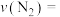
②平衡时测得
 的物质的量为0.10mol,则的转化率
的物质的量为0.10mol,则的转化率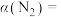

(3)对于反应
 ,在一定条件下氨的平衡含量如下表。
,在一定条件下氨的平衡含量如下表。| 温度/℃ | 压强/MPa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
②其他条件不变时,温度升高,氨的平衡含量减小的原因是
③哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是
更新时间:2023-11-24 17:45:09
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】在2 L的某恒容密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H。已知反应中化学键数据如下表:
CH3OH(g)+H2O(g) △H。已知反应中化学键数据如下表:
回答下列问题:
(1)△H___________ (填“>”“<”或“=”)0。
(2)某温度下,向该容器中充入0.3 mol CO2、0.9 mol H2,发生上述反应,5 min末,反应达到平衡,此时测得H2O(g)的物质的量分数为25%。
①0~5 min内,H2平均速率v(H2)=___________ mol·L-1·min-1。
②每生成0.15 mol CH3OH,转移的电子数为___________ NA。
③反应前后的总压强之比为___________ 。
(3)工业上有一种方法是用CO2来生产燃料甲醇(化学式:CH3OH,常温下为无色液体),可以将CO2变废为宝。在体积为2 L的密闭容器中,充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:

①从开始到平衡,CH3OH的平均反应速率v(CH3OH)=_______ ;H2的转化率a(H2)=_______ ;
②若反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),在四种不同情况下的反应速率分别为:
a.v(CO2)=0.15 mol∙L-1∙min-1 b.v(H2)=0.01 mol∙L-1∙min-1
c.v(CH3OH)=0.2 mol∙L-1∙min-1 d.v(H2O)=0.45 mol∙L-1∙min-1
该反应进行最快的是____________ (填字母)。
③以下结论可以作为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)已达平衡的标志的是_________ 。
a.v(H2)正=v(CH3OH)逆
b.c(CO2):c(H2):c(CH3OH):c(H2O)=1:3:1:1
c.容器内压强不再变化
d.单位时间内,每生成1 mol CH3OH,同时消耗3 mol H2
e.容器内混合气体的密度不再变化
f.H2的体积分数不再变化
 CH3OH(g)+H2O(g) △H。已知反应中化学键数据如下表:
CH3OH(g)+H2O(g) △H。已知反应中化学键数据如下表:| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ/mol) | 436 | 351 | 745 | 463 | 413 |
回答下列问题:
(1)△H
(2)某温度下,向该容器中充入0.3 mol CO2、0.9 mol H2,发生上述反应,5 min末,反应达到平衡,此时测得H2O(g)的物质的量分数为25%。
①0~5 min内,H2平均速率v(H2)=
②每生成0.15 mol CH3OH,转移的电子数为
③反应前后的总压强之比为
(3)工业上有一种方法是用CO2来生产燃料甲醇(化学式:CH3OH,常温下为无色液体),可以将CO2变废为宝。在体积为2 L的密闭容器中,充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:

①从开始到平衡,CH3OH的平均反应速率v(CH3OH)=
②若反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),在四种不同情况下的反应速率分别为:
a.v(CO2)=0.15 mol∙L-1∙min-1 b.v(H2)=0.01 mol∙L-1∙min-1
c.v(CH3OH)=0.2 mol∙L-1∙min-1 d.v(H2O)=0.45 mol∙L-1∙min-1
该反应进行最快的是
③以下结论可以作为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)已达平衡的标志的是
a.v(H2)正=v(CH3OH)逆
b.c(CO2):c(H2):c(CH3OH):c(H2O)=1:3:1:1
c.容器内压强不再变化
d.单位时间内,每生成1 mol CH3OH,同时消耗3 mol H2
e.容器内混合气体的密度不再变化
f.H2的体积分数不再变化
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】I.为了探究化学反应速率及其影响因素,某研究小组以盐酸和碳酸钙反应进行了如下实验。实验方案与数据如下表,t表示收集a mLCO2所需的时间。
(1)设计实验1和实验2的目的是研究 _________________ 对化学反应速率的影响。
(2)为研究温度对对化学反应速率的影响,可以将实验_____ 和实验____ (填序号)作对比。
(3)将实验2和实验3作对比,可知t2___________ t3(填“﹥”、“﹤”或“﹦”)。
Ⅱ.在一体积为10L密闭容器中,通入一定量的CO和H2O,在 850℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g),CO浓度变化如图,
CO2(g)+H2(g),CO浓度变化如图,
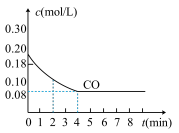
(4)则0~4 min的平均反应速率v(CO)=_____________ mol·L-1·min -1。
(5)该反应达到最大限度所需的时间为____________ ,此时CO的转化率为_____________ 。
| 序号 | 反应温度/℃ | C(HCl)/ mol·L-1 | V(HCl)/ mL | 10g碳酸钙的形状 | t/min |
| 1 | 20 | 2 | 10 | 块状 | t1 |
| 2 | 20 | 2 | 10 | 粉末 | t2 |
| 3 | 20 | 4 | 10 | 粉末 | t3 |
| 4 | 40 | 2 | 10 | 粉末 | t4 |
(2)为研究温度对对化学反应速率的影响,可以将实验
(3)将实验2和实验3作对比,可知t2
Ⅱ.在一体积为10L密闭容器中,通入一定量的CO和H2O,在 850℃时发生如下反应:
CO(g)+H2O(g)
 CO2(g)+H2(g),CO浓度变化如图,
CO2(g)+H2(g),CO浓度变化如图,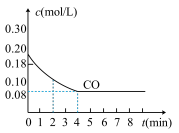
(4)则0~4 min的平均反应速率v(CO)=
(5)该反应达到最大限度所需的时间为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】碘及碘的化合物在人类活动中占有重要的地位。已知反应H2(g)+I2(g) 2HI(g)ΔH=-14.9kJ·mol-1。
2HI(g)ΔH=-14.9kJ·mol-1。
(1)根据下图判断1molH2(g)分子中化学键断裂时需要吸收的能量为___________ kJ。

(2)氢气和碘蒸气能直接反应生成碘化氢,T℃时,向1L的恒容密闭容器中充入0.2mol H2(g)和0.2mol I2(g),5min时反应达到平衡,H2(g)、I2(g)和HI(g)的物质的量浓度(c)随时间(t)变化的曲线如图所示:
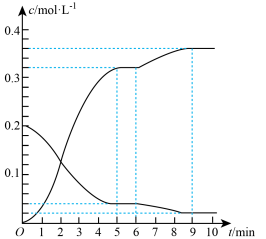
0~5min内,用H2(g)表示的该反应速率v(H2)=__________ 。6min时,改变的外界条件为__________ 。
(3)反应H2(g)+I2(g) 2HI(g)的反应机理如下:
2HI(g)的反应机理如下:
第一步:I2 2I(快速平衡);
2I(快速平衡);
第二步:I+H2 H2I(快速平衡);
H2I(快速平衡);
第三步:H2I+I→2HI(慢反应)。
则该反应的反应速率由__________ 步决定。
(4)将等物质的量的I2和H2置于预先抽真空的特制1L恒容密闭容器中,加热到1500K,起始总压强为416kPa;体系达到平衡时,总压强为456kPa。若体系中只考虑如下反应关系:
①I2(g) 2I(g)Kpl=200ΔH1
2I(g)Kpl=200ΔH1
②I2(g)+H2(g) 2HI(g)Kp2ΔH2
2HI(g)Kp2ΔH2
KP为以分压表示的平衡常数。1500K时,平衡体系中I(g)的分压为__________ kPa,Kp2=__________ (写表达式)。
(5)某实验兴趣小组将氧化还原反应2Cu2++5I- 2CuI↓++
2CuI↓++ 设计成如图所示的原电池装置:
设计成如图所示的原电池装置:

带孔的封蜡鸡蛋壳为半透膜,鸡蛋壳内的电极为__________ (填“正极”或“负极”);该电极反应式为__________ 。
 2HI(g)ΔH=-14.9kJ·mol-1。
2HI(g)ΔH=-14.9kJ·mol-1。(1)根据下图判断1molH2(g)分子中化学键断裂时需要吸收的能量为

(2)氢气和碘蒸气能直接反应生成碘化氢,T℃时,向1L的恒容密闭容器中充入0.2mol H2(g)和0.2mol I2(g),5min时反应达到平衡,H2(g)、I2(g)和HI(g)的物质的量浓度(c)随时间(t)变化的曲线如图所示:

0~5min内,用H2(g)表示的该反应速率v(H2)=
(3)反应H2(g)+I2(g)
 2HI(g)的反应机理如下:
2HI(g)的反应机理如下:第一步:I2
 2I(快速平衡);
2I(快速平衡);第二步:I+H2
 H2I(快速平衡);
H2I(快速平衡);第三步:H2I+I→2HI(慢反应)。
则该反应的反应速率由
(4)将等物质的量的I2和H2置于预先抽真空的特制1L恒容密闭容器中,加热到1500K,起始总压强为416kPa;体系达到平衡时,总压强为456kPa。若体系中只考虑如下反应关系:
①I2(g)
 2I(g)Kpl=200ΔH1
2I(g)Kpl=200ΔH1②I2(g)+H2(g)
 2HI(g)Kp2ΔH2
2HI(g)Kp2ΔH2KP为以分压表示的平衡常数。1500K时,平衡体系中I(g)的分压为
(5)某实验兴趣小组将氧化还原反应2Cu2++5I-
 2CuI↓++
2CuI↓++ 设计成如图所示的原电池装置:
设计成如图所示的原电池装置:
带孔的封蜡鸡蛋壳为半透膜,鸡蛋壳内的电极为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】二甲醚简称DME,是一种基础化工原料,可用于燃料电池及制取低碳烯烃等,Kagan提出的一步法制取二甲醚的反应为: ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:
ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:
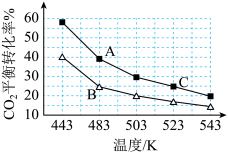
(1)ΔH_______ 0(填“>”或“<”)。进料浓度比c(H2)∶c(CO2)=5的曲线为_______ 点所在曲线(填“A”或“B”),B、C两点用CH3OCH3表示的平均反应速率 (B)
(B)_______  (C)(填“>”、“<”或“=”)。
(C)(填“>”、“<”或“=”)。
(2)在一定条件下,若将CO2改为等物质的量的CO和CO2的混合气,则充入的CO与H2O发生反应: 将导致CH3OCH3的产率增大,原因是
将导致CH3OCH3的产率增大,原因是_______ 。
(3)在一定体积的刚性容器中保持温度不变,保持c(H2)∶c(CO2)进料浓度比不变,进一步提高CO2的平衡转化率的方法是_______ 、_______ 。
(4)在绝热恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g) 5N2(g)+6H2O(g)
5N2(g)+6H2O(g)
不能说明该反应已达到平衡状态标志的是_______ (填标号)。
a.体系温度不变
b.反应速率5v(NH3)消耗 =4v(N2)消耗
c.容器内压强不再随时间而发生变化
d.容器内N2的物质的量分数不再随时间而发生变化
e.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
(5)一定温度下,在2 L恒容密闭容器内发生反应2NO2(g) N2O4(g),n(NO2)随时间的变化如表:
N2O4(g),n(NO2)随时间的变化如表:
根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是_______ 。该温度下,反应2NO2(g)  N2O4(g)的平衡常数K=
N2O4(g)的平衡常数K=_______ L·mol-1。
(6)对于反应2NO2(g) N2O4(g),用平衡时各组分压强关系表达的平衡常数
N2O4(g),用平衡时各组分压强关系表达的平衡常数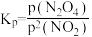 。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:v消耗(NO2)=k1·p2(NO2),v消耗(N2O4)=k2·p(N2O4)。其中k1、k2是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图所示:
。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:v消耗(NO2)=k1·p2(NO2),v消耗(N2O4)=k2·p(N2O4)。其中k1、k2是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图所示:
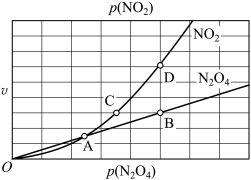
一定温度下,k1、k2与平衡常数KP的关系是k1=_______ 。在图标出的点中,指出能表示反应达到平衡状态的点并说明理由_______ 。
 ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:
ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:
(1)ΔH
 (B)
(B) (C)(填“>”、“<”或“=”)。
(C)(填“>”、“<”或“=”)。(2)在一定条件下,若将CO2改为等物质的量的CO和CO2的混合气,则充入的CO与H2O发生反应:
 将导致CH3OCH3的产率增大,原因是
将导致CH3OCH3的产率增大,原因是(3)在一定体积的刚性容器中保持温度不变,保持c(H2)∶c(CO2)进料浓度比不变,进一步提高CO2的平衡转化率的方法是
(4)在绝热恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)
 5N2(g)+6H2O(g)
5N2(g)+6H2O(g)不能说明该反应已达到平衡状态标志的是
a.体系温度不变
b.反应速率5v(NH3)消耗 =4v(N2)消耗
c.容器内压强不再随时间而发生变化
d.容器内N2的物质的量分数不再随时间而发生变化
e.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
(5)一定温度下,在2 L恒容密闭容器内发生反应2NO2(g)
 N2O4(g),n(NO2)随时间的变化如表:
N2O4(g),n(NO2)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2) /mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
 N2O4(g)的平衡常数K=
N2O4(g)的平衡常数K=(6)对于反应2NO2(g)
 N2O4(g),用平衡时各组分压强关系表达的平衡常数
N2O4(g),用平衡时各组分压强关系表达的平衡常数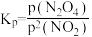 。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:v消耗(NO2)=k1·p2(NO2),v消耗(N2O4)=k2·p(N2O4)。其中k1、k2是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图所示:
。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:v消耗(NO2)=k1·p2(NO2),v消耗(N2O4)=k2·p(N2O4)。其中k1、k2是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图所示:
一定温度下,k1、k2与平衡常数KP的关系是k1=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氨气是一种重要的化工原料。请回答:
(1)已知:
写出由氢气和氮气合成氨气的热化学方程式___________ 。
(2)下列关于工业合成氨的说法不正确 的是___________ 。
A.反应温度控制在400~500℃左右,主是为了提高 的产率
的产率
B.为了防止混有杂质的原料气使催化剂“中毒”,必须对原料气净化处理
C.采用高压的目的只是为了提高反应的速率
D.工业上为了提高 的转化率,可适当增大
的转化率,可适当增大 的浓度
的浓度
E.生产过程中将 液化分离,并及时补充
液化分离,并及时补充 和
和 ,有利于氨的合成
,有利于氨的合成
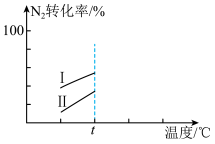
(3)在其他条件相同时,某同学研究该氨气合成反应在不同催化剂I或II作用下,反应相同时间时, 的转化率随反应温度的变化情况。请在图中补充
的转化率随反应温度的变化情况。请在图中补充 后的变化情况
后的变化情况____________ 。
(4)在25℃下,将 溶于水制成氨水,取
溶于水制成氨水,取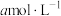 的氨水与
的氨水与 的盐酸等体积混合,反应后溶液中
的盐酸等体积混合,反应后溶液中 。用含a的代数式表示
。用含a的代数式表示 的电离平衡常数
的电离平衡常数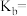
________ 。
(5)工业上用 催化还原
催化还原 可以消除氮氧化物的污染。如下图,采用
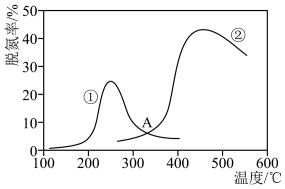
可以消除氮氧化物的污染。如下图,采用 作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:
作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为: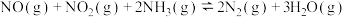 。
。
以下说法正确的是___________。
(1)已知:
| 化学键 |  | H-H | N-H |
键能/( ) ) | 945 | 436 | 390.8 |
写出由氢气和氮气合成氨气的热化学方程式
(2)下列关于工业合成氨的说法
A.反应温度控制在400~500℃左右,主是为了提高
 的产率
的产率B.为了防止混有杂质的原料气使催化剂“中毒”,必须对原料气净化处理
C.采用高压的目的只是为了提高反应的速率
D.工业上为了提高
 的转化率,可适当增大
的转化率,可适当增大 的浓度
的浓度E.生产过程中将
 液化分离,并及时补充
液化分离,并及时补充 和
和 ,有利于氨的合成
,有利于氨的合成(3)在其他条件相同时,某同学研究该氨气合成反应在不同催化剂I或II作用下,反应相同时间时,
 的转化率随反应温度的变化情况。请在图中补充
的转化率随反应温度的变化情况。请在图中补充 后的变化情况
后的变化情况
(4)在25℃下,将
 溶于水制成氨水,取
溶于水制成氨水,取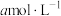 的氨水与
的氨水与 的盐酸等体积混合,反应后溶液中
的盐酸等体积混合,反应后溶液中 。用含a的代数式表示
。用含a的代数式表示 的电离平衡常数
的电离平衡常数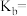
(5)工业上用
 催化还原
催化还原 可以消除氮氧化物的污染。如下图,采用
可以消除氮氧化物的污染。如下图,采用 作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:
作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为: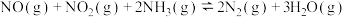 。
。
以下说法正确的是___________。
| A.相同条件下,改变压强对脱氮率没有影响 |
| B.在交叉点A处,不管使用哪种催化剂,上述反应都未达平衡 |
| C.催化剂①、②分别适合于250℃和450℃左右脱氮 |
| D.由曲线②温度升高到一定程度后脱氮率下降可推知该反应为放热反应 |
您最近一年使用:0次
【推荐3】合成氨反应是目前最有效的工业固氮方法,解决数亿人口生存问题。
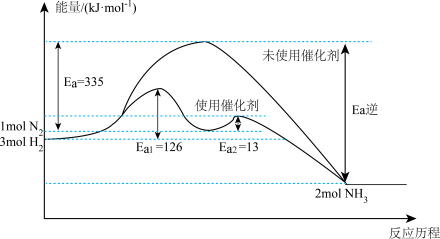
(1)如图所示,合成氨反应
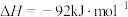 中未使用催化剂时,逆反应的活化能
中未使用催化剂时,逆反应的活化能
_______  ;使用催化剂之后,正反应的活化能为
;使用催化剂之后,正反应的活化能为_______  。
。
(2)在t℃、压强为3.6MPa条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示:
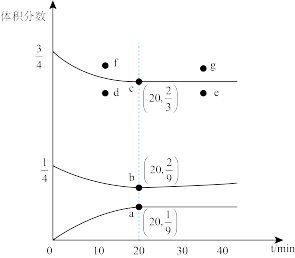
①反应20min达到平衡,该反应的 =
=_______ (请写出计算表达式)。
②若起始条件一样,在恒容容器中发生反应,则达到平衡时H2的含量符合图中_______ 点(填“d”“e”“f”或“g”)。
(3)在合成氨的实际生产中,未反应的气体(含不参与反应的惰性气体)可多次循环使用。当氢氮比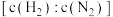 为3时,平衡时氨气的含量关系式为:
为3时,平衡时氨气的含量关系式为: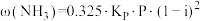 (
( 表示平衡常数,Р表示平衡体系压强,i表示惰性气体体积分数),当温度为500℃,平衡体系压强为2.3MPa,不含惰性气体时,平衡时氨气的含量为
表示平衡常数,Р表示平衡体系压强,i表示惰性气体体积分数),当温度为500℃,平衡体系压强为2.3MPa,不含惰性气体时,平衡时氨气的含量为 。若温度不变,体系中有13%的惰性气体,此时增大压强,
。若温度不变,体系中有13%的惰性气体,此时增大压强, 将
将_______ (填“变大”“变小”或“不变”)。欲使平衡时氨气的含量仍为 ,应将压强调整至
,应将压强调整至_______ MPa(结果保留2位有效数字)。
(1)如图所示,合成氨反应

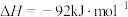 中未使用催化剂时,逆反应的活化能
中未使用催化剂时,逆反应的活化能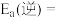
 ;使用催化剂之后,正反应的活化能为
;使用催化剂之后,正反应的活化能为 。
。
(2)在t℃、压强为3.6MPa条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示:

①反应20min达到平衡,该反应的
 =
=②若起始条件一样,在恒容容器中发生反应,则达到平衡时H2的含量符合图中
(3)在合成氨的实际生产中,未反应的气体(含不参与反应的惰性气体)可多次循环使用。当氢氮比
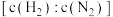 为3时,平衡时氨气的含量关系式为:
为3时,平衡时氨气的含量关系式为: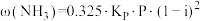 (
( 表示平衡常数,Р表示平衡体系压强,i表示惰性气体体积分数),当温度为500℃,平衡体系压强为2.3MPa,不含惰性气体时,平衡时氨气的含量为
表示平衡常数,Р表示平衡体系压强,i表示惰性气体体积分数),当温度为500℃,平衡体系压强为2.3MPa,不含惰性气体时,平衡时氨气的含量为 。若温度不变,体系中有13%的惰性气体,此时增大压强,
。若温度不变,体系中有13%的惰性气体,此时增大压强, 将
将 ,应将压强调整至
,应将压强调整至
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,回答下列问题:
(1)250℃、100 kPa时二氧化碳加氢制甲醇的反应一般认为通过两个步骤来实现,能量变化过程如图所示。
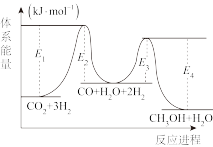
总反应的焓变△H=___________ kJ·mol-1,写出决速步反应的热化学方程式___________ 。
(2)合成总反应在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250°C下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250°C下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。

①用各物质的平衡分压表示总反应的平衡常数表达式Kp=___________ 。
②图中对应等压过程的曲线是___________ ,判断的理由是___________ 。
③当x(CH3OH)=0.10时,CO2的平衡转化率α=___________ 。
④A、B、C、D、E中可能表示220℃、6×105Pa时的平衡状态的点是___________ ,C、D两点的平衡常数分别是KC、KD,KC___________ KD(填“>”“<”或“=”)。
(1)250℃、100 kPa时二氧化碳加氢制甲醇的反应一般认为通过两个步骤来实现,能量变化过程如图所示。

总反应的焓变△H=
(2)合成总反应在起始物
 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250°C下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250°C下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
①用各物质的平衡分压表示总反应的平衡常数表达式Kp=
②图中对应等压过程的曲线是
③当x(CH3OH)=0.10时,CO2的平衡转化率α=
④A、B、C、D、E中可能表示220℃、6×105Pa时的平衡状态的点是
您最近一年使用:0次
【推荐2】能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ · mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ · mol-1
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________ 。
(2)汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动。

下列说法中正确的是_____________ (填字母序号)。
A.负极的电极反应式为:CO + O2-―2e-=CO2
B.工作时电子由电极a通过传感器流向电极b
C.工作时电极b作正极,O2-由电极a通过固体介质向电极b迁移
D.传感器中通过的电流越大,尾气中CO的含量越高
(3)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________ 。
(4)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向2 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
① 该反应的平衡常数表达式为:K=_____________________ 。
② 该时间内反应速率v(H2)=_________________ 。
③下列说法正确的是___________ 。
A.升高温度改变化学反应的平衡常数
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反 应速率减慢
C.化学反应的限度与时间长短无关
D.化学反应的限度是不可能改变的
E. 仅增大H2的浓度,正反应速率加快,反应物的转化率也都增大
④ 10min反应达平衡容器内混合气体的平均相对分子质量比起始时________ (填增大、减小或无变化)。
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ · mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ · mol-1
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=
(2)汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动。

下列说法中正确的是
A.负极的电极反应式为:CO + O2-―2e-=CO2
B.工作时电子由电极a通过传感器流向电极b
C.工作时电极b作正极,O2-由电极a通过固体介质向电极b迁移
D.传感器中通过的电流越大,尾气中CO的含量越高
(3)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为
(4)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向2 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)
 CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:| 物 质 | CO | H2 | CH3OH |
| 浓度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
① 该反应的平衡常数表达式为:K=
② 该时间内反应速率v(H2)=
③下列说法正确的是
A.升高温度改变化学反应的平衡常数
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反 应速率减慢
C.化学反应的限度与时间长短无关
D.化学反应的限度是不可能改变的
E. 仅增大H2的浓度,正反应速率加快,反应物的转化率也都增大
④ 10min反应达平衡容器内混合气体的平均相对分子质量比起始时
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】利用反应NO2(g)+SO2(g)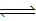 SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义,完成下列填空:
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义,完成下列填空:
(1)该反应的平衡常数表达式K=___ 。
(2)若上述反应在一密闭容器中进行。下列能表明反应达到平衡状态的是___ 。(选填字母)。
a.混合气体颜色保持不变
b.NO2和NO的体积比保持不变
c.每消耗1molSO2的同时生成1molSO3
d.体系中气体密度保持不变
(3)一定温度下,在容积为2L的容器中发生上述反应,2min内,SO2的质量减少了1.6g,则这段时间内NO的生成速率为___ 。
(4)请写出两种能提高SO2转化率的措施___ 、___ 。
(5)亚硫酸溶液久置,pH会变小,请用方程式表示其原因___ 。
(6)在密闭容器中,上述反应达到平衡后,继续充入一定量的NO2气体,描述密闭容器内气体颜色的变化情况,并简述理由___ 。
 SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义,完成下列填空:
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义,完成下列填空:(1)该反应的平衡常数表达式K=
(2)若上述反应在一密闭容器中进行。下列能表明反应达到平衡状态的是
a.混合气体颜色保持不变
b.NO2和NO的体积比保持不变
c.每消耗1molSO2的同时生成1molSO3
d.体系中气体密度保持不变
(3)一定温度下,在容积为2L的容器中发生上述反应,2min内,SO2的质量减少了1.6g,则这段时间内NO的生成速率为
(4)请写出两种能提高SO2转化率的措施
(5)亚硫酸溶液久置,pH会变小,请用方程式表示其原因
(6)在密闭容器中,上述反应达到平衡后,继续充入一定量的NO2气体,描述密闭容器内气体颜色的变化情况,并简述理由
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a.CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1
b.CO2(g)+H2(g) CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2
c.CH4(g) C(s)+2H2(g) ∆H3
C(s)+2H2(g) ∆H3
d.2CO(g) CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4
e.CO(g)+H2(g) H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5
(1)根据盖斯定律,反应a的∆H1=___________ (写出一个合理的代数式即可)。
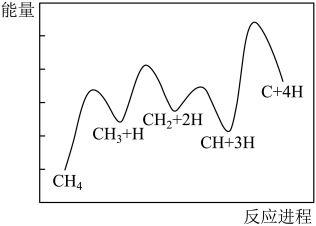
(2)一定条件下,c反应CH4分解形成碳的反应历程如图所示。该历程分___________ 步进行,其中第___________ 步的正反应活化能最大。
(3)某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行a反应,达到平衡时CO2的转化率是50%,则其平衡常数为___________ 。
(4)在一固定容积的密闭容器中进行b反应:CO2(g)+H2(g) CO(g)+H2O(g)。其平衡常数K和温度T的关系如下:
CO(g)+H2O(g)。其平衡常数K和温度T的关系如下:
①该反应的正反应为___________ 反应(填“吸热”或“放热”)。
②当温度为850℃,某时刻测得容器中各物质的物质的量如下:
此时上述反应正、逆反应速率的关系为:υ正___________ υ逆(填“大于”、“小于”或“等于”)。
③在一定温度下,压缩容器体积增大压强,则该反应中H2(g)的平衡转化率___________ (填“增大”、“减小”或“不变”)。工业生产中,通过此方法使容器压强增大以加快反应速率,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其原因可能是___________ 。
a.CH4(g)+CO2(g)
 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1b.CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2c.CH4(g)
 C(s)+2H2(g) ∆H3
C(s)+2H2(g) ∆H3d.2CO(g)
 CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4e.CO(g)+H2(g)
 H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5(1)根据盖斯定律,反应a的∆H1=
(2)一定条件下,c反应CH4分解形成碳的反应历程如图所示。该历程分

(3)某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行a反应,达到平衡时CO2的转化率是50%,则其平衡常数为
(4)在一固定容积的密闭容器中进行b反应:CO2(g)+H2(g)
 CO(g)+H2O(g)。其平衡常数K和温度T的关系如下:
CO(g)+H2O(g)。其平衡常数K和温度T的关系如下:| T/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
②当温度为850℃,某时刻测得容器中各物质的物质的量如下:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
③在一定温度下,压缩容器体积增大压强,则该反应中H2(g)的平衡转化率
您最近一年使用:0次
【推荐2】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含 等)制备
等)制备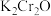 的流程如图所示。
的流程如图所示。

已知:Ⅰ在酸性条件下,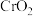 能将
能将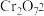 还原为
还原为
Ⅱ.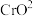 的氧化性强于
的氧化性强于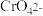
Ⅲ. 相关金属离子形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)向含铬废水中加入 调节
调节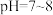 ,目的是
,目的是__________ 。
(2)写出“氧化”步骤中反应的例子方程式_________ 。
(3)“加热”操作的目的是________ 。
(4)“酸化”过程中发生反应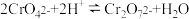
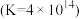 已知,“酸化”后溶液中
已知,“酸化”后溶液中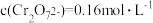 则溶液中
则溶液中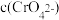 =
=________ 。
(5)“结晶”后得到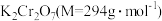 产品0.3000g,将其溶解后用稀
产品0.3000g,将其溶解后用稀 酸化,再由浓度为
酸化,再由浓度为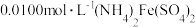 标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为
标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为________ 。
(6)在 存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。

①负极的电极反应式为_________ ;
②处理过程中,需严格控制正极附近的pH,理由是_________
 等)制备
等)制备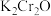 的流程如图所示。
的流程如图所示。
已知:Ⅰ在酸性条件下,
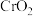 能将
能将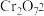 还原为
还原为
Ⅱ.
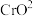 的氧化性强于
的氧化性强于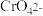
Ⅲ. 相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
 | 4.9 | 6.8 |
 | 1.5 | 2.8 |
回答下列问题:
(1)向含铬废水中加入
 调节
调节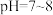 ,目的是
,目的是(2)写出“氧化”步骤中反应的例子方程式
(3)“加热”操作的目的是
(4)“酸化”过程中发生反应
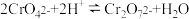
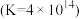 已知,“酸化”后溶液中
已知,“酸化”后溶液中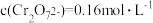 则溶液中
则溶液中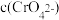 =
=(5)“结晶”后得到
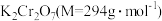 产品0.3000g,将其溶解后用稀
产品0.3000g,将其溶解后用稀 酸化,再由浓度为
酸化,再由浓度为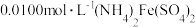 标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为
标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为(6)在
 存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
①负极的电极反应式为
②处理过程中,需严格控制正极附近的pH,理由是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】通过化学的方法实现 的资源化利用是一种理想的
的资源化利用是一种理想的 减排途径。
减排途径。
Ⅰ.利用 制备CO:一定温度下,在恒容密闭容器中进行如下反应:
制备CO:一定温度下,在恒容密闭容器中进行如下反应: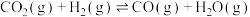
(1)下列事实能说明上述反应达到平衡状态的是_______(填字母序号)。
Ⅱ.利用 制备甲醇(
制备甲醇( )
)
一定条件下,向恒容密闭容器中通入等量的 和
和 ,压强为p kPa.涉及反应如下:
,压强为p kPa.涉及反应如下:
主反应:
 kJ·mol-1
kJ·mol-1
副反应: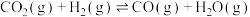
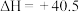 kJ·mol-1
kJ·mol-1
已知: 产率
产率
(2)一段时间后,测得体系中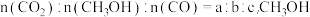 产率=
产率=_______ (用代数式表示),主反应的压强平衡常数Kp=_______ (用代数式表示)。
(3)探究温度对反应速率的影响(其他条件相同)
实验测得不同温度下,单位时间内的 转化率和
转化率和 与CO的物质的量之比
与CO的物质的量之比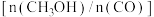 如图所示。
如图所示。
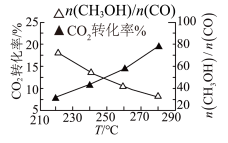
图中,随着温度的升高, 转化率升高,
转化率升高,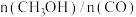 的值下降。解释其原因
的值下降。解释其原因_______ 。
(4)探究温度和压强对平衡的影响(其他条件相同)。不同压强下,平衡时 转化率随温度的变化关系如图所示。
转化率随温度的变化关系如图所示。
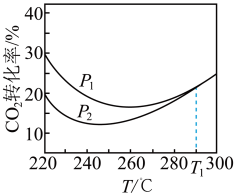
①压强
_______ (填“大于”或“小于”) 。
。
②图2中温度高于 时,两条曲线重叠的原因是
时,两条曲线重叠的原因是_______ 。
③下列条件中, 平衡产率最大的是
平衡产率最大的是_______ (填字母序号)。
A.220℃ 5MPa B.220℃ 1MPa C.300℃ 1MPa
 的资源化利用是一种理想的
的资源化利用是一种理想的 减排途径。
减排途径。Ⅰ.利用
 制备CO:一定温度下,在恒容密闭容器中进行如下反应:
制备CO:一定温度下,在恒容密闭容器中进行如下反应: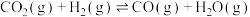
(1)下列事实能说明上述反应达到平衡状态的是_______(填字母序号)。
A.体系内 | B.体系压强不再发生变化 |
| C.体系内各物质浓度不再发生变化 | D.体系内CO的物质的量分数不再发生变化 |
Ⅱ.利用
 制备甲醇(
制备甲醇( )
)一定条件下,向恒容密闭容器中通入等量的
 和
和 ,压强为p kPa.涉及反应如下:
,压强为p kPa.涉及反应如下:主反应:

 kJ·mol-1
kJ·mol-1副反应:
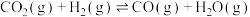
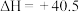 kJ·mol-1
kJ·mol-1已知:
 产率
产率
(2)一段时间后,测得体系中
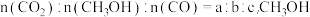 产率=
产率=(3)探究温度对反应速率的影响(其他条件相同)
实验测得不同温度下,单位时间内的
 转化率和
转化率和 与CO的物质的量之比
与CO的物质的量之比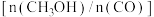 如图所示。
如图所示。
图中,随着温度的升高,
 转化率升高,
转化率升高,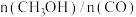 的值下降。解释其原因
的值下降。解释其原因(4)探究温度和压强对平衡的影响(其他条件相同)。不同压强下,平衡时
 转化率随温度的变化关系如图所示。
转化率随温度的变化关系如图所示。
①压强

 。
。②图2中温度高于
 时,两条曲线重叠的原因是
时,两条曲线重叠的原因是③下列条件中,
 平衡产率最大的是
平衡产率最大的是A.220℃ 5MPa B.220℃ 1MPa C.300℃ 1MPa
您最近一年使用:0次



