(1)25℃时,配制不同浓度HA溶液,并测其pH值,所得相关数据如下:
| 序号 | 原HA溶液体积/mL | 水的体积/mL | pH |
| I | 40.00 | / | 2.88 |
| II | 4.00 | 36.0 | 3.38 |
(2)25℃,将pH=2的HA溶液与pH=12的NaOH溶液等体积混合,下列说法正确的是
a.混合后离子浓度满足等式:
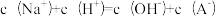
b.混合后会生成强碱弱酸盐NaA,因其水解而使混合后的溶液显碱性
c.pH=2的HA溶液中,由水电离出的H+浓度为10-2mo1/L
d.pH=12的NaOH溶液中,由水电离出的H+浓度为10-12mol/L
(3)25℃时,向HA溶液中加入NaOH,配制
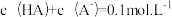 的混合溶液,溶液的pH、HA和A-分布分数δ(分布分数
的混合溶液,溶液的pH、HA和A-分布分数δ(分布分数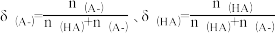 与所加NaOH物质的量的关系如图所示。
与所加NaOH物质的量的关系如图所示。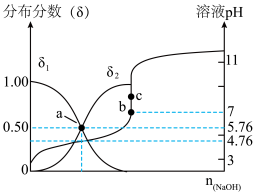
①δ1表示
②25℃时,HA的电离平衡常数Ka=
③pH=5时,溶液中A-的浓度和HA的浓度之比为c(A-):c(HA)=
④若c处c(Na+)=0.1mol/L,则a、b、c三处水的电离程度由大到小排序为
(4)查阅资料可知,若往某溶液中加入少量强酸或强碱时,外来的H+或OH-中绝大多数被溶液中某些微粒消耗掉从而导致pH几乎不变的为缓冲溶液。据此小组同学推断(3)中a点对应溶液为缓冲溶液。原因是向a点溶液加入少量酸,外来的H+被A-消耗;加少量碱,外来的OH-被
(5)下列浓度比均为1:1的混合溶液中与a点溶液相似,也属于缓冲溶液的是
a.Na2CO3-NaHCO3 b.H2SO4-Na2SO4 c.NaOH-NaCl d.NH3∙H2O-NH4Cl
相似题推荐
(1)NH4Al(SO4)2可作净水剂,其原理是
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2溶液中的c(
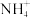 )
)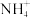 )。
)。(3)浓度均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示:
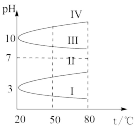
①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是
②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中2c(
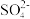 )-c(
)-c(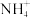 )-3c(Al3+)=
)-3c(Al3+)=(4)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是
(5)难溶电解质在水溶液中存在溶解平衡。25℃,某NH4Al(SO4)2溶液里c(Al3+)=0.1mol•L﹣1,使Al3+开始沉淀的pH为
Ⅰ.化学家研究发现,SbF5能将MnF4从离子[MnF6]2-的盐中反应得到,SbF5转化成稳定离子[SbF6]-的盐。而MnF4很不稳定,受热易分解为MnF3和F2。根据以上研究写出以K2MnF6和SbF5为原料,在 423 K 的温度下制备F2的化学方程式:

现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。
已知KHF2是一种酸式盐,写出阴极上发生的电极反应式
Ⅱ.①卤化氢的熔沸点随相对分子质量增加而升高,而HF熔沸点高于HCl的原因是
②已知25 ℃时,氢氟酸(HF)的电离平衡常数Ka=3.6×10-4。
某pH=2的氢氟酸溶液,由水电离出的c(H+)=
③又已知25 ℃时,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol/L HF溶液中加入 1 L 0.2 mol/L CaCl2 溶液,通过列式计算说明是否有沉淀产生:
| 酸 | CH3COOH | HNO2 | HCN | HClO |
| 电离平衡常数(Ka) | 1.8×10-5 | 4.6×10-4 | 5×10-10 | 3×10-8 |
A.醋酸和水能以任意比例混溶
B.在醋酸水溶液中还含有未电离的醋酸分子
C.醋酸与Na2CO3溶液反应放出CO2气体
D.1mol⋅L﹣1的醋酸水溶液能使紫色石蕊溶液变红色
E.等体积等pH的醋酸和盐酸分别与足量氢氧化钠溶液充分反应,醋酸消耗的氢氧化钠更多
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,最强、最弱的酸分别是
②下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸 E.加氢氧化钠固体
③依表格数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式
(3)已知草酸是一种二元弱酸,其电离常数K1=5.4×10-2,K2=5.4×10-5,试从电离平衡移动的角度解释K1>K2的原因
(4)已知水溶液中c(H+)和c(OH﹣)的关系如图所示:

②若A点到E点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的NaOH
(1)常温下,将
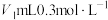 稀盐酸与
稀盐酸与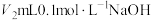 溶液混合,所得溶液的pH为1,则
溶液混合,所得溶液的pH为1,则
(2)常温下,将
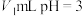 的酸HA溶液与
的酸HA溶液与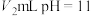 的NaOH溶液混合。下列说法正确的是___________(填字母)。
的NaOH溶液混合。下列说法正确的是___________(填字母)。A.若 ,反应后溶液pH一定等于7 ,反应后溶液pH一定等于7 |
B.若反应后溶液呈中性,则混合液中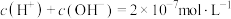 |
C.若反应后溶液呈酸性,则 一定大于 一定大于 |
D.若反应后溶液呈碱性,则 一定小于 一定小于 |
 的NaOH溶液滴定
的NaOH溶液滴定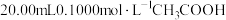 溶液,滴定过程中,溶液的pH与消耗NaOH溶液的体积的关系如图所示:
溶液,滴定过程中,溶液的pH与消耗NaOH溶液的体积的关系如图所示:
①该滴定过程应该选择
②a
③C点溶液中离子浓度由大到小的顺序为
(4)25℃时,下表为一些难溶电解质的相关数据:
| 物质 |  |  |  |
| 开始沉淀时的pH | 5.8 | 4. 1 | 2.0 |
| 完全沉淀时的pH | 8.3 | 6.4 | 3.2 |
常温下,除去酸性
 溶液中含有的少量
溶液中含有的少量 ,其操作步骤为:
,其操作步骤为:①应先加入
②再加入CuO,调节溶液的pH在
 转化为
转化为 沉淀,过滤。
沉淀,过滤。
(1)有关上述常数的说法正确的是___________。
| A.它们都能反映一定条件下对应变化进行的程度 |
| B.它们的大小都随温度的升高而增大 |
| C.室温时,AgCl分别加入水中与AgNO3溶液中,前者溶度积常数大 |
| D.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh |
 的比值为
的比值为(3)一定温度下,在体积为1L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g),化学平衡常数K的表达式为
CO(g)+H2O(g),化学平衡常数K的表达式为(4)25°C时,将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合所得溶液中c(
 )=c(Cl-),则溶液显
)=c(Cl-),则溶液显(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol·L-1的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL
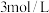 的NaOH溶液吸收标准状况下
的NaOH溶液吸收标准状况下
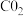 时,所得溶液中各离子浓度由大到小的顺序为
时,所得溶液中各离子浓度由大到小的顺序为(2)常温下向一定体积的
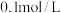 醋酸溶液中加水稀释后,下列说法正确的是
醋酸溶液中加水稀释后,下列说法正确的是A.溶液中导电粒子的数目减少
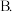 醋酸的电离程度增大,
醋酸的电离程度增大, 亦增大
亦增大C.溶液中
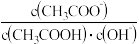 不变
不变 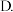 溶液中
溶液中 减小
减小(3)①常温下将
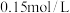 稀硫酸
稀硫酸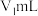 与
与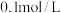 NaOH溶液
NaOH溶液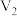 mL棍合,所得溶液的pH为1,则
mL棍合,所得溶液的pH为1,则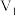 :
: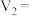
 溶液体积变化忽略不询.
溶液体积变化忽略不询.②常温下若溶液由
 的HA溶液
的HA溶液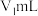 与
与 的NaOH溶液
的NaOH溶液 混合而得,则下列说法正确的是
混合而得,则下列说法正确的是A.若反应后溶液呈中性,则

B.若
 ,反应后溶液pH一定等于7
,反应后溶液pH一定等于7C.若反应后溶液呈酸性,则
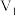 一定大于
一定大于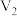
D.若反应后溶液呈碱性,则
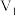 一定小于
一定小于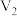
(4)常温下,浓度均为
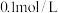 的下列五种溶液的pH值如下表所示:
的下列五种溶液的pH值如下表所示: | 溶质 | 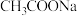 |  |  | NaClO | NaCN |
| pH |  | 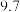 | 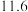 | 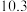 | 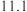 |
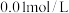 的下列四种酸的溶液分别稀释100倍,pH变化最小的是
的下列四种酸的溶液分别稀释100倍,pH变化最小的是A.HCN
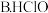
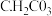
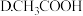
②根据以上数据,判断下列反应可以成立的是
A.
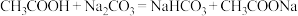
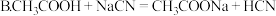
C.
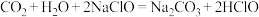

(5)几种离子开始沉淀时的pH如下表:
| 离子 |  |  |  |
| pH | 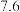 |  |  |
 、
、 、
、 离子的溶液中滴加NaOH溶液时,
离子的溶液中滴加NaOH溶液时, 填离子符号
填离子符号 先沉淀,
先沉淀,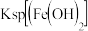
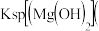 填“
填“ ”、“
”、“ ”或“
”或“ ”
” .
.
 )在医药、农药等领域应用广泛。回答下列问题:
)在医药、农药等领域应用广泛。回答下列问题:(1)已知:羟胺在水中主要以
 (弱碱)形式存在,电离方式与
(弱碱)形式存在,电离方式与 相似。将羟胺溶液加水稀释,
相似。将羟胺溶液加水稀释, 的值将
的值将(2)常温下,将0.1
 盐酸分别滴入20.00
盐酸分别滴入20.00 0.1
0.1 羟胺溶液和20.00
羟胺溶液和20.00 0.1
0.1
 溶液中,测得溶液
溶液中,测得溶液 [
[ ]随滴入盐酸体积变化如图所示。
]随滴入盐酸体积变化如图所示。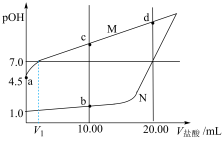
①图中表示盐酸滴定羟胺溶液的曲线是
②常温下,
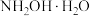 电离平衡常数的值约为
电离平衡常数的值约为 ;
;
③a、b、c、d四点对应的溶液中,水的电离程度由大到小的顺序为
④若将b、d点对应的溶液混合,则混合液呈

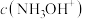 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(1)利用下列实验装置制取次氯酸钠和氢氧化钠混合液。
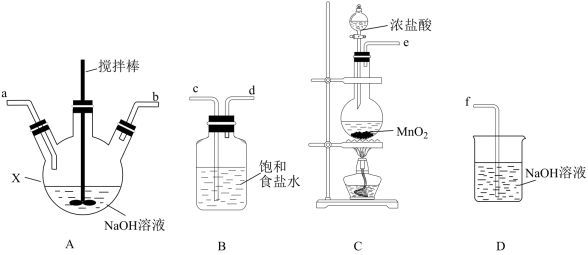
①仪器X的名称是
②若该实验温度控制不当,反应后测得装置A内ClO﹣与ClO
 的物质的量之比为5:1,则A中反应的化学方程式是
的物质的量之比为5:1,则A中反应的化学方程式是(2)制备水合肼:反应原理为CO(NH2)2(尿素)+NaClO+NaOH=N2H4•H2O+NaCl+Na2CO3。
①将次氯酸钠和氢氧化钠混合液缓慢滴加到尿素溶液中,边加边搅拌。该操作需严格控制试剂的滴加顺序和滴加速度,原因是
②N2H4•H2O一级电离方程式为N2H4•H2O=N2H
 +OH﹣,其二级电离方程式为
+OH﹣,其二级电离方程式为(3)碘化钠的制备:采用水合肼还原法制取碘化钠固体,其制备流程如图所示。
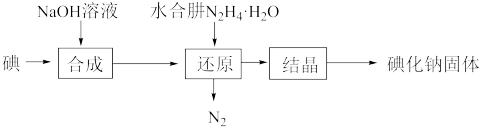
①“还原”过程主要消耗“合成”中生成的副产物IO
 ,反应的离子方程式是
,反应的离子方程式是②工业上也可用硫化钠或铁屑还原碘酸钠制备碘化钠,“水合肼还原法”的优点是
| 25℃平衡体系(苯、水、HA) | 苯或水相中HA起始浓度 | 焓变 | 平衡常数 |
在水相: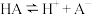 | 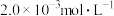 |  |  |
在有机相: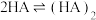 | 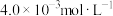 |  |  |
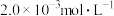 时,测得HA溶液
时,测得HA溶液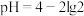 。二相平衡体系中,HA在有机相苯(B)和水相(W)中的分配系数为K,
。二相平衡体系中,HA在有机相苯(B)和水相(W)中的分配系数为K,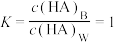 ,即达到平衡后,以HA分子形式存在于有机相和水相中的比例为1:1。
,即达到平衡后,以HA分子形式存在于有机相和水相中的比例为1:1。请回答下列问题:
(1)有机相苯中HA发生双聚反应
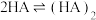 ,在较低温度下反应自发进行,则
,在较低温度下反应自发进行,则
(2)用分液漏斗分离得到有机相,向有机相中继续加少量苯,则
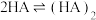 平衡
平衡
(3)计算25℃时,平衡体系水相中
 的电离度
的电离度
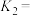
(4)25℃时,NaA和HA均为0.1mol/L的混合水溶液中离子浓度由大到小的顺序为
Ⅰ.若在绝热、恒容的密闭容器中通入
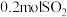 和
和 ,发生反应
,发生反应
 ,一段时间内,正反应速率随时间的变化曲线如图所示。
,一段时间内,正反应速率随时间的变化曲线如图所示。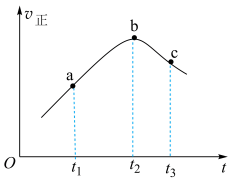
(1)混合气体的密度:a
(2)b点时,

(3)
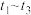 内,
内, 先增大后减小的主要原因为
先增大后减小的主要原因为Ⅱ.常温下,氢硫酸(
 的水溶液)的电离方程式可表示为
的水溶液)的电离方程式可表示为 和
和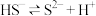 。现将氢硫酸与氢氧化钠溶液混合。已知:
。现将氢硫酸与氢氧化钠溶液混合。已知: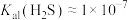 ,
, 。
。(4)对于反应
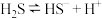 ,该反应的平衡常数表达式为
,该反应的平衡常数表达式为(5)若将等体积、等浓度的氢硫酸与氢氧化钠溶液混合,发生反应的化学方程式:
(6)常温下,当混合后溶液中的
 时,该溶液的pH约为
时,该溶液的pH约为 ,
, ]。
]。

【资料卡片】控制电位在0.740~1.511 V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2,以达到硒与杂质金属的分离。请回答下列问题:
(1)“脱硫”时,测得脱硫率随温度的变化如图,最佳温度是

(2)“氧化酸浸”中,Se转化成H2SeO3(
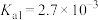 ),H2SeO3的化学名称为
),H2SeO3的化学名称为(3)已知:ClO2浓度过高时容易爆炸,工业上制备ClO2的工艺有:
盐酸法:

双氧水法:
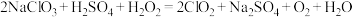
请根据以上信息完成填空:双氧水法相比盐酸法的优点有①反应需要的酸度条件较低,对设备腐蚀影响较小;②
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等。
①净化后的溶液中
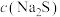 达到
达到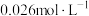 ,此时溶液中的
,此时溶液中的 的最大值为
的最大值为 ,精硒中基本不含铜。[
,精硒中基本不含铜。[ ]
]②硒代硫酸钠酸化生成硒的离子方程式为
(5)H2SeO4在水溶液中的电离方程式如下:
 ,
, 。已知
。已知 H2SeO4溶液的pH为x,则
H2SeO4溶液的pH为x,则
(1)同温同压下,研究
 分别在不同浓度的盐酸和
分别在不同浓度的盐酸和 溶液中的溶解度(用溶解
溶液中的溶解度(用溶解 的物质的量浓度表示)变化如图所示。已知氯气在溶解时存在以下平衡:
的物质的量浓度表示)变化如图所示。已知氯气在溶解时存在以下平衡:
①
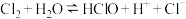
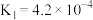
②
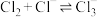

③

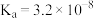
随着
 浓度的增大,
浓度的增大, 溶解度减小,溶液中
溶解度减小,溶液中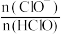
 、
、 、
、 、
、 四种离子浓度由大到小的顺序为
四种离子浓度由大到小的顺序为(2)
 是一种高效漂白剂。经测定,25℃时
是一种高效漂白剂。经测定,25℃时 溶液中各组分分布系数随
溶液中各组分分布系数随 变化情况如图所示(
变化情况如图所示( 未画出)。
未画出)。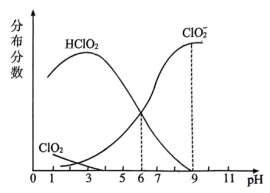
①25℃时,

 。
。②25℃时,浓度均为
 的
的 和
和 的混合溶液中,
的混合溶液中,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)为测定某
 消毒剂样品中含氯量,用
消毒剂样品中含氯量,用 溶液滴定该样品溶液,操作如下:
溶液滴定该样品溶液,操作如下:a.取样:取
 样品溶液置于锥形瓶,加入稀硫酸酸化,发生反应:
样品溶液置于锥形瓶,加入稀硫酸酸化,发生反应: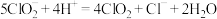 (
( 极易溶于水);
极易溶于水);b.氧化:加入足量碘化钾溶液,振荡充分反应;
c.滴定:加入淀粉作指示剂,在锥形瓶下垫一张白纸,用
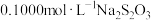 标准溶液滴定碘单质(
标准溶液滴定碘单质( );
);d.重复上述操作三次。
滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视
 溶液后,溶液
溶液后,溶液测得的实验数据如下表:
| 实验序号 | 待测液体积( ) ) |  标准溶液 标准溶液 | |
滴定前刻度/ | 滴定后刻度/ | ||
| 1 | 20.00 | 0.60 | 20.60 |
| 2 | 20.00 | 6.00 | 25.95 |
| 3 | 20.00 | 1.40 | 23.20 |
| 4 | 20.00 | 1.00 | 21.05 |
 计)
计) (保留三位有效数字)。滴定时,有一组数据出现了明显异常,所测含氯量偏大,原因可能有
(保留三位有效数字)。滴定时,有一组数据出现了明显异常,所测含氯量偏大,原因可能有A.取样时用
 的滴定管液面在
的滴定管液面在 处放出所有溶液
处放出所有溶液B.滴定终点读数时仰视刻度线
C.达终点时滴定管尖嘴有标准液悬挂
D.盛装待测液的锥形瓶未润洗
E.摇动锥形瓶时有液体溅出



