全球大气  浓度升高对人类生产生活产生了影响,研究二氧化碳的回收对我国2060年实现碳中和具有现实意义,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产生活产生了影响,研究二氧化碳的回收对我国2060年实现碳中和具有现实意义,碳及其化合物的资源化利用成为研究热点。回答下列问题:
(1)工业上用二氧化碳催化加氢可合成乙醇,其反应原理为: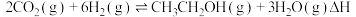
①通过表格中的数值可以推断:该反应在________ (填“高温”、“低温”或“任何温度”)下能自发进行。
② 的平衡转化率与氢碳比
的平衡转化率与氢碳比 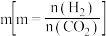 及压强、温度的关系分别如图 a和图 b所示。
及压强、温度的关系分别如图 a和图 b所示。

图a中氢碳比 从大到小的顺序为
从大到小的顺序为___________ 。图b中压强从大到小的顺序为___________ 。
(2)反应
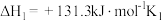
反应
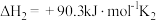
反应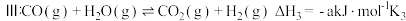
①
___________ ,
___________ (用 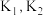 表示)。
表示)。
②研究表明,反应 Ⅲ的速率方程为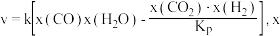 表示反应气体的物质的量分数,
表示反应气体的物质的量分数, 为平衡常数(用平衡分压代替平衡浓度计算),
为平衡常数(用平衡分压代替平衡浓度计算), 为反应的速率常数。当恒压
为反应的速率常数。当恒压 ,只发生反应Ⅲ:COg+H2Og⇌CO2g+H2gΔH3=-akJ⋅mol-1K3且
,只发生反应Ⅲ:COg+H2Og⇌CO2g+H2gΔH3=-akJ⋅mol-1K3且 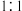 加料时,平衡转化率为 b,求反应物转化率为
加料时,平衡转化率为 b,求反应物转化率为 时的反应速率
时的反应速率
___________ (用含 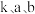 的计算式表示,不用化简)。
的计算式表示,不用化简)。
(3)已知 时,大气中的
时,大气中的  溶于水存在以下过程:
溶于水存在以下过程:
①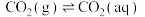
②
溶液中 的浓度
的浓度 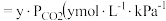 为比例系数,此题可看为常数)。当大气压强为
为比例系数,此题可看为常数)。当大气压强为 ,大气中
,大气中 的物质的量分数为
的物质的量分数为 时,溶液中
时,溶液中 的浓度为
的浓度为_______  (忽略
(忽略 和水的电离)。
和水的电离)。
 浓度升高对人类生产生活产生了影响,研究二氧化碳的回收对我国2060年实现碳中和具有现实意义,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产生活产生了影响,研究二氧化碳的回收对我国2060年实现碳中和具有现实意义,碳及其化合物的资源化利用成为研究热点。回答下列问题:(1)工业上用二氧化碳催化加氢可合成乙醇,其反应原理为:
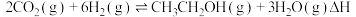
温度/  | 400 | 500 |
平衡常数  | 9 | 5.3 |
②
 的平衡转化率与氢碳比
的平衡转化率与氢碳比 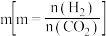 及压强、温度的关系分别如图 a和图 b所示。
及压强、温度的关系分别如图 a和图 b所示。
图a中氢碳比
 从大到小的顺序为
从大到小的顺序为(2)反应

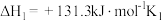
反应

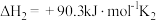
反应
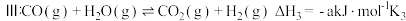
①


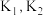 表示)。
表示)。②研究表明,反应 Ⅲ的速率方程为
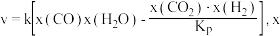 表示反应气体的物质的量分数,
表示反应气体的物质的量分数, 为平衡常数(用平衡分压代替平衡浓度计算),
为平衡常数(用平衡分压代替平衡浓度计算), 为反应的速率常数。当恒压
为反应的速率常数。当恒压 ,只发生反应Ⅲ:COg+H2Og⇌CO2g+H2gΔH3=-akJ⋅mol-1K3且
,只发生反应Ⅲ:COg+H2Og⇌CO2g+H2gΔH3=-akJ⋅mol-1K3且 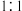 加料时,平衡转化率为 b,求反应物转化率为
加料时,平衡转化率为 b,求反应物转化率为 时的反应速率
时的反应速率
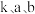 的计算式表示,不用化简)。
的计算式表示,不用化简)。(3)已知
 时,大气中的
时,大气中的  溶于水存在以下过程:
溶于水存在以下过程:①
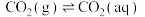
②

溶液中
 的浓度
的浓度 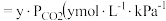 为比例系数,此题可看为常数)。当大气压强为
为比例系数,此题可看为常数)。当大气压强为 ,大气中
,大气中 的物质的量分数为
的物质的量分数为 时,溶液中
时,溶液中 的浓度为
的浓度为 (忽略
(忽略 和水的电离)。
和水的电离)。
更新时间:2024-02-01 21:13:11
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】硫酸有着广泛的用途。硫酸工业在国民经济中占有重要地位。
(1)实验室可用铜与浓硫酸反应制备少量 :
: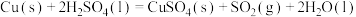
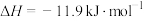 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由___________ 。
(2)我国古籍记载了硫酸的制备方法—“炼石胆( )取精华法”。
)取精华法”。
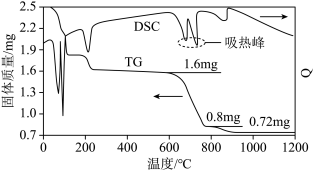
①借助现代仪器分析,该制备过程中 分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有
分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有___________ 、___________ (填化学式)和 。
。
②已知下列热化学方程式:
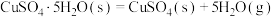



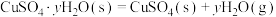

则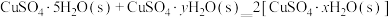 的△H=
的△H=__________  。
。
(3)接触法制硫酸的关键反应为 的催化氧化:
的催化氧化: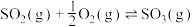

①为寻求固定投料比下不同反应阶段的最佳生产温度,绘制不同转化率( )下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
)下反应速率(数值已略去)与温度的关系如图,下列说法正确的是__________ 。
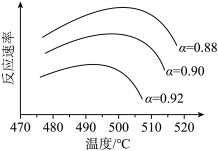
A.温度越高,反应速率越大 B.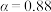 的曲线代表平衡转化率
的曲线代表平衡转化率
C. 越大,反应速率最大值对应温度越低 D.可根据不同
越大,反应速率最大值对应温度越低 D.可根据不同 下的最大速率,选择最佳生产温度
下的最大速率,选择最佳生产温度
②固定投料比,在压强分别为0.5MPa、2.5MPa和5.0MPa下,得到 的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=__________ 。
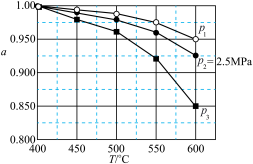
③对于气体参与的反应,可用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B)来表示平衡常数 。设
。设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为
的平衡转化率为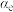 ,则上述催化氧化反应
,则上述催化氧化反应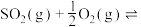
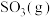 的
的
_____________ (用含p和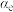 的代数式表示)。
的代数式表示)。
(1)实验室可用铜与浓硫酸反应制备少量
 :
: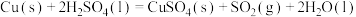
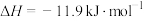 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由(2)我国古籍记载了硫酸的制备方法—“炼石胆(
 )取精华法”。
)取精华法”。①借助现代仪器分析,该制备过程中
 分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有
分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有 。
。
②已知下列热化学方程式:
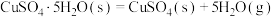



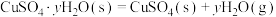

则
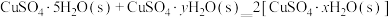 的△H=
的△H= 。
。(3)接触法制硫酸的关键反应为
 的催化氧化:
的催化氧化: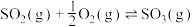
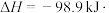

①为寻求固定投料比下不同反应阶段的最佳生产温度,绘制不同转化率(
 )下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
)下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
A.温度越高,反应速率越大 B.
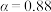 的曲线代表平衡转化率
的曲线代表平衡转化率C.
 越大,反应速率最大值对应温度越低 D.可根据不同
越大,反应速率最大值对应温度越低 D.可根据不同 下的最大速率,选择最佳生产温度
下的最大速率,选择最佳生产温度②固定投料比,在压强分别为0.5MPa、2.5MPa和5.0MPa下,得到
 的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
③对于气体参与的反应,可用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B)来表示平衡常数
 。设
。设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为
的平衡转化率为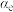 ,则上述催化氧化反应
,则上述催化氧化反应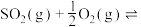
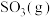 的
的
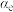 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
【推荐2】草酸二甲酯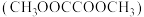 的热催化加氢是生产乙二醇
的热催化加氢是生产乙二醇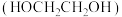 、乙醇酸甲酯
、乙醇酸甲酯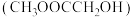 的重要工艺,主要反应如下:
的重要工艺,主要反应如下:
 .
.
 .
.
 .
.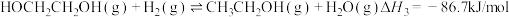
回答下列问题:
(1)草酸二甲酯热催化加氢生成乙二醇反应的 。
。
(2)计算表明,反应 在研究的温度范围内平衡常数大于
在研究的温度范围内平衡常数大于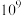 ,可以认为反应Ⅲ几乎不可逆,为了限制反应
,可以认为反应Ⅲ几乎不可逆,为了限制反应 对乙二醇产率的影响,可采取的最佳措施是___________(填标号)。
对乙二醇产率的影响,可采取的最佳措施是___________(填标号)。
(3)在选定催化剂后研究投料比和压强对反应平衡的影响。测得在 、
、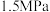 的等温等压条件下,原料草酸二甲酯的转化率
的等温等压条件下,原料草酸二甲酯的转化率 及产物的选择性
及产物的选择性 投料比的变化关系如图甲所示(
投料比的变化关系如图甲所示(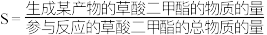 )。
)。___________ ;当投料比为60时,若草酸二甲酯的转化率为 ,且该条件下不发生反应
,且该条件下不发生反应 ,则最终收集的流出气中甲醇蒸气的分压为
,则最终收集的流出气中甲醇蒸气的分压为___________  (保留小数点后两位)。
(保留小数点后两位)。
(4)在等压 、投料比为50的条件下,
、投料比为50的条件下, 及各产物的选择性
及各产物的选择性 随温度变化关系如图乙所示。当反应温度高于
随温度变化关系如图乙所示。当反应温度高于 时,乙二醇的选择性降低,原因是
时,乙二醇的选择性降低,原因是___________ ;根据图乙数据,画出乙醇酸甲酯的产率随温度的变化图像___________ (标出产率最高时的数据)。
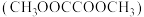 的热催化加氢是生产乙二醇
的热催化加氢是生产乙二醇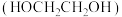 、乙醇酸甲酯
、乙醇酸甲酯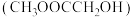 的重要工艺,主要反应如下:
的重要工艺,主要反应如下: .
.
 .
.
 .
.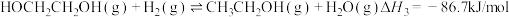
回答下列问题:
(1)草酸二甲酯热催化加氢生成乙二醇反应的
 。
。(2)计算表明,反应
 在研究的温度范围内平衡常数大于
在研究的温度范围内平衡常数大于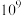 ,可以认为反应Ⅲ几乎不可逆,为了限制反应
,可以认为反应Ⅲ几乎不可逆,为了限制反应 对乙二醇产率的影响,可采取的最佳措施是___________(填标号)。
对乙二醇产率的影响,可采取的最佳措施是___________(填标号)。| A.升高反应体系的温度 | B.适当增大反应投料中氢气的比例 |
| C.增大反应体系的压强 | D.选择合适的催化剂进行反应 |
(3)在选定催化剂后研究投料比和压强对反应平衡的影响。测得在
 、
、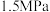 的等温等压条件下,原料草酸二甲酯的转化率
的等温等压条件下,原料草酸二甲酯的转化率 及产物的选择性
及产物的选择性 投料比的变化关系如图甲所示(
投料比的变化关系如图甲所示(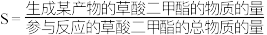 )。
)。
 ,且该条件下不发生反应
,且该条件下不发生反应 ,则最终收集的流出气中甲醇蒸气的分压为
,则最终收集的流出气中甲醇蒸气的分压为 (保留小数点后两位)。
(保留小数点后两位)。(4)在等压
 、投料比为50的条件下,
、投料比为50的条件下, 及各产物的选择性
及各产物的选择性 随温度变化关系如图乙所示。当反应温度高于
随温度变化关系如图乙所示。当反应温度高于 时,乙二醇的选择性降低,原因是
时,乙二醇的选择性降低,原因是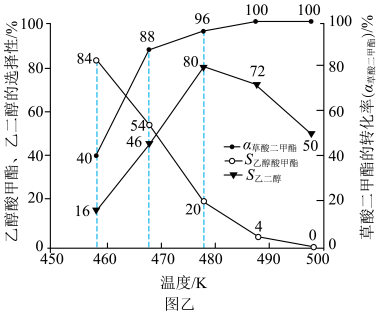
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】氨是重要的基础化工原料,可以制备尿素[CO(NH2)2]、N2H4等多种含氮的化工产品。
(1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I: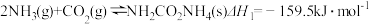
反应Ⅱ:
反应Ⅲ:H2O(1)=H2O(g) △H3=+44.0 kJ·mol-1
则反应: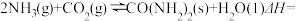
__________ kJ/mol
(2)将氨气与二氧化碳在有催化剂的反应器中反应 ,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
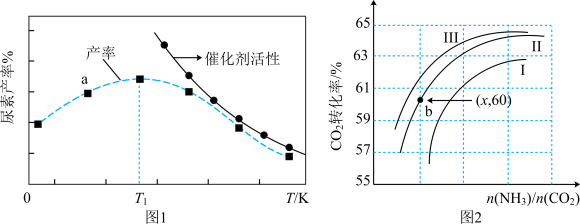
①a点________ (填是或不是)处于平衡状态,T1之后尿素产率下降的原因是___________________________ 。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比 、水碳比
、水碳比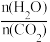 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___________ ,测得b点氨的转化率为30%,则x=___________________ 。
③已知该反应的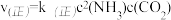 ,
,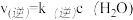 ,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是
,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是____________________________________ 。
(3)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:
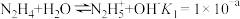 ;
;

①25℃时,向N2H4水溶液中加入H2SO4,欲使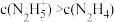 ,同时
,同时 ,应控制溶液pH范围
,应控制溶液pH范围_____________ (用含a、b式子表示)。
②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为_______________ 。
(1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:
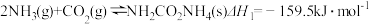
反应Ⅱ:

反应Ⅲ:H2O(1)=H2O(g) △H3=+44.0 kJ·mol-1
则反应:
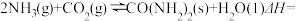
(2)将氨气与二氧化碳在有催化剂的反应器中反应
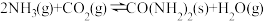 ,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
①a点
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比
 、水碳比
、水碳比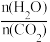 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是③已知该反应的
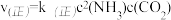 ,
,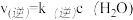 ,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是
,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是(3)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:
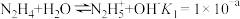 ;
;
①25℃时,向N2H4水溶液中加入H2SO4,欲使
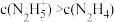 ,同时
,同时 ,应控制溶液pH范围
,应控制溶液pH范围②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】石油炼厂气(小分子烷烃和烯烃)的综合利用是当今社会发展的需要。
(1)已知一些物质的燃烧热如下表:
写出丙烷与氢气反应生成甲烷的热化学方程式:___________ 。
(2)1,2-二氯乙烷(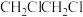 )常用于制造乙酰纤维、烟草萃取剂、熏蒸剂。工业上可用乙烯加成法制备1,2-二氯乙烷,主要副产物为氯乙烯(
)常用于制造乙酰纤维、烟草萃取剂、熏蒸剂。工业上可用乙烯加成法制备1,2-二氯乙烷,主要副产物为氯乙烯(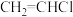 ),反应原理如下:
),反应原理如下:
I.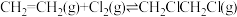
II.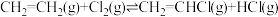
 下,向某恒容密闭容器中充入等物质的量的
下,向某恒容密闭容器中充入等物质的量的 和
和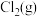 ,在催化剂作用下发生反应,容器内气体的压强随时间的变化如图1所示。
,在催化剂作用下发生反应,容器内气体的压强随时间的变化如图1所示。

①前 内用
内用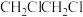 表示的平均反应速率
表示的平均反应速率
___________  。
。
②该温度下,各有机物组分占总有机物的含量 随时间的变化曲线如图2所示,
随时间的变化曲线如图2所示, 表示
表示___________ (填有机物的结构简式),理由是___________ 。反应II的平衡常数
___________ ( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。

③为提高平衡时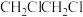 的产率,可采取的措施是
的产率,可采取的措施是___________ (填两条)。
(1)已知一些物质的燃烧热如下表:
| 物质 |  |  | 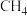 |  |  |
燃烧热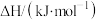 | -393.5 | -285.8 | -890.3 | -1559.8 | -2219.9 |
(2)1,2-二氯乙烷(
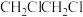 )常用于制造乙酰纤维、烟草萃取剂、熏蒸剂。工业上可用乙烯加成法制备1,2-二氯乙烷,主要副产物为氯乙烯(
)常用于制造乙酰纤维、烟草萃取剂、熏蒸剂。工业上可用乙烯加成法制备1,2-二氯乙烷,主要副产物为氯乙烯(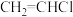 ),反应原理如下:
),反应原理如下:I.
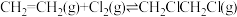
II.
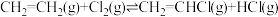
 下,向某恒容密闭容器中充入等物质的量的
下,向某恒容密闭容器中充入等物质的量的 和
和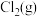 ,在催化剂作用下发生反应,容器内气体的压强随时间的变化如图1所示。
,在催化剂作用下发生反应,容器内气体的压强随时间的变化如图1所示。
①前
 内用
内用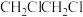 表示的平均反应速率
表示的平均反应速率
 。
。②该温度下,各有机物组分占总有机物的含量
 随时间的变化曲线如图2所示,
随时间的变化曲线如图2所示, 表示
表示
 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
③为提高平衡时
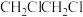 的产率,可采取的措施是
的产率,可采取的措施是
您最近一年使用:0次
【推荐2】根据要求完成下列填空:
(1)将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:
3A(g) +B(g) 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
①用C表示10s 内正反应的化学反应速率为___________________ ;
②反应前A的物质的量浓度是___________________________ ;
(2)某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生反应2SO2(g)+O2(g) 2SO3(g) 反应,5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%,则该反应达到平衡时SO2的转化率为
2SO3(g) 反应,5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%,则该反应达到平衡时SO2的转化率为__________________ ;
(3)已知在容积固定的密闭容器中充入NH3和O2发生如下反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
下列能说明该反应已经达到平衡状态的是___________;
(4)在一定条件下,可实现如图所示物质之间的变化:

①已知孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。
则图中的F是____________ (填化学式)。
②写出明矾[KAl(SO4)2·12H2O] 与过量NaOH溶液反应的离子方程式:
_____________________________________________ 。
③图中所得C和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式:
________________________________________________ 。
(5)海带提碘的流程如下:

①第②步为了加快溶解速率并使充分进入溶液中,可以采取的措施是:
______________________ 、______________________ (写出两条)。
②写出第④步发生反应的离子方式_____________________________ 。
(1)将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:
3A(g) +B(g)
 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:①用C表示10s 内正反应的化学反应速率为
②反应前A的物质的量浓度是
(2)某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生反应2SO2(g)+O2(g)
 2SO3(g) 反应,5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%,则该反应达到平衡时SO2的转化率为
2SO3(g) 反应,5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%,则该反应达到平衡时SO2的转化率为(3)已知在容积固定的密闭容器中充入NH3和O2发生如下反应:
4NH3(g)+5O2(g)
 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)下列能说明该反应已经达到平衡状态的是___________;
| A.容器中气体总质量不变 | B.c(O2)不变 | C.v (O2)=1.25 v(NH3) |
| D.体系压强不变 | E.相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO | |

①已知孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。
则图中的F是
②写出明矾[KAl(SO4)2·12H2O] 与过量NaOH溶液反应的离子方程式:
③图中所得C和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式:
(5)海带提碘的流程如下:

①第②步为了加快溶解速率并使充分进入溶液中,可以采取的措施是:
②写出第④步发生反应的离子方式
您最近一年使用:0次
【推荐3】在2 L的密闭容器中,某化学反应2A B+D在四种不同条件下进行,A、B、D都为气体,且B、D起始浓度为0,反应物A的物质的量(mol)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,A、B、D都为气体,且B、D起始浓度为0,反应物A的物质的量(mol)随反应时间(min)的变化情况如下表:

根据上述数据,回答以下问题:
(1)实验1中,10至30分钟时间内A的平均反应速率为________ mol·L-1·min-1,达平衡时B物质的浓度为________ ,A的转化率为________ 。
(2)实验2中,隐含的反应条件可能是________ 。
(3)实验3中,A的起始的物质的量________ (填“>”“<”或“=”)1.0 mol,实验3和实验1的起始速率v3________ (填“>”“<”或“=”)v1,由实验1和实验5可确定上述反应为________ (填“放热”或“吸热”) 反应,实验4中,该反应温度下其平衡常数为________ 。
(4)若开始时在实验2的密闭容器中充入1.0molB,1.0molD,达平衡时A物质的浓度为________ 。
 B+D在四种不同条件下进行,A、B、D都为气体,且B、D起始浓度为0,反应物A的物质的量(mol)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,A、B、D都为气体,且B、D起始浓度为0,反应物A的物质的量(mol)随反应时间(min)的变化情况如下表:
根据上述数据,回答以下问题:
(1)实验1中,10至30分钟时间内A的平均反应速率为
(2)实验2中,隐含的反应条件可能是
(3)实验3中,A的起始的物质的量
(4)若开始时在实验2的密闭容器中充入1.0molB,1.0molD,达平衡时A物质的浓度为
您最近一年使用:0次
【推荐1】甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH1=-1451.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-556.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___ 。
(2)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①下表所列数据是反应I在不同温度下的化学平衡常数(K)。
由表中数据判断ΔH1___ 0(填“>”、“=”或“<”)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为___ ,此时的温度为___ (从上表中选择)。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:用该电池电解(惰性电极)500ml某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8gCu(OH)2固体。则原CuSO4溶液的物质的量浓度为___ mol·L-1(假设电解前后溶液体积不变)。
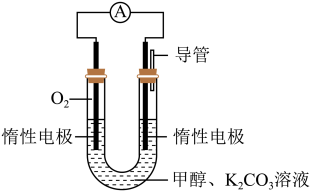
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH1=-1451.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-556.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1反应Ⅱ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2①下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:用该电池电解(惰性电极)500ml某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8gCu(OH)2固体。则原CuSO4溶液的物质的量浓度为

您最近一年使用:0次
【推荐2】随着科学技术的发展和环保要求不断提高,CO2的捕集利用技术成为研究的重点。
Ⅰ.工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq) ΔH1
NH4HCO3(aq) ΔH1
2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq)ΔH3
2NH4HCO3(aq)ΔH3
则ΔH3=___________ (用含ΔH1、ΔH2的代数式表示)。
Ⅱ.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的化学反应方程式为CO2(g)+4H2(g) CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
(1)该反应的ΔS___________ 0(填“>”“<”或“=”),该反应的ΔH___________ 0(填“>”或“<”)。
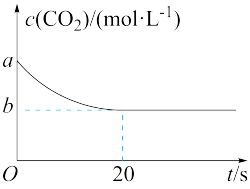
(2)在恒容密闭容器中通入等物质的量的CO2和H2并发生上述反应,T ℃下,CO2物质的量浓度c(CO2)随时间t变化的曲线如图所示。下列能说明反应达到平衡状态的是___________ (填字母代号)。
A.体系压强保持不变
B.混合气体密度保持不变
C.甲烷和水蒸气的物质的量之比保持不变
D.H2的质量分数保持不变
(3)T ℃下,反应前20 s的平均反应速率v(H2)=___________ (用含a、b的代数式表示)。
(4)T ℃下,该反应的平衡常数K=___________ (用含a、b的代数式表示)。
(5)若降低温度,反应重新达到平衡,则v(正)___________ ;CO2转化率___________ (填“增大”“减小”或“不变”)。
Ⅰ.工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
NH3(l)+H2O(l)+CO2(g)
 NH4HCO3(aq) ΔH1
NH4HCO3(aq) ΔH12NH3(l)+H2O(l)+CO2(g)
 (NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq) ΔH2(NH4)2CO3(aq)+H2O(l)+CO2(g)
 2NH4HCO3(aq)ΔH3
2NH4HCO3(aq)ΔH3则ΔH3=
Ⅱ.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的化学反应方程式为CO2(g)+4H2(g)
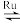 CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。(1)该反应的ΔS
(2)在恒容密闭容器中通入等物质的量的CO2和H2并发生上述反应,T ℃下,CO2物质的量浓度c(CO2)随时间t变化的曲线如图所示。下列能说明反应达到平衡状态的是

A.体系压强保持不变
B.混合气体密度保持不变
C.甲烷和水蒸气的物质的量之比保持不变
D.H2的质量分数保持不变
(3)T ℃下,反应前20 s的平均反应速率v(H2)=
(4)T ℃下,该反应的平衡常数K=
(5)若降低温度,反应重新达到平衡,则v(正)
您最近一年使用:0次
【推荐3】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250 ℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:
CO2 ( g)+CH4(g)
g)+CH4(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
平衡体系中各组分体积分数如下表:
①此温度下该反应的平衡常数K=____________ 。
②已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
CO(g)+H2O (g)===CO2(g)+H2 (g) =2.8 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) =-566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的ΔH=
2CO(g)+2H2(g) 的ΔH=_____________ 。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
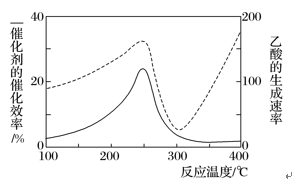
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是___________________________________________________________________ 。
②为了提高该反应中CH4的转化率,可以采取的措施是____________________________________ 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为________________________________________________ 。
(3)①Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是________ (填字母)。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li 4SiO4,Li4SiO4用于吸收、释放CO2。原理是在500 ℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700 ℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是
4SiO4,Li4SiO4用于吸收、释放CO2。原理是在500 ℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700 ℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_________________________________________ 。
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O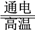 CO+H2+O2
CO+H2+O2
高温电解技术能高效实现反应A,工作原理示意图如下:
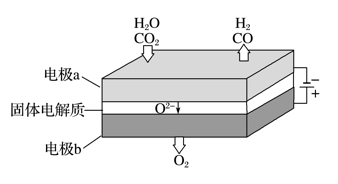
CO2在电极a放电的反应式是________________________________________________ 。
(1)250 ℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:
CO2 (
 g)+CH4(g)
g)+CH4(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=
②已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
CO(g)+H2O (g)===CO2(g)+H2 (g) =2.8 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) =-566.0 kJ·mol-1
反应CO2(g)+CH4(g)
 2CO(g)+2H2(g) 的ΔH=
2CO(g)+2H2(g) 的ΔH=(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是

②为了提高该反应中CH4的转化率,可以采取的措施是
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为
(3)①Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li
 4SiO4,Li4SiO4用于吸收、释放CO2。原理是在500 ℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700 ℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是
4SiO4,Li4SiO4用于吸收、释放CO2。原理是在500 ℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700 ℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O
 CO+H2+O2
CO+H2+O2高温电解技术能高效实现反应A,工作原理示意图如下:

CO2在电极a放电的反应式是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】2021年 1月20日我国在西昌卫星发射中心用长征三号乙运载火箭,成功将天通一号03 星发射升空。起飞重量中,95%的都是化学推进剂。
(1)火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.5 mol液态肼与足量过氧化氢反应,生成N2和气态水,放出250.0 kJ的热量。
①写出肼的结构式_______ 。
②写出该反应的热化学方程式:_______ 。
③火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是_______ 。
A.在高温下不融化 B.在高温下可分解气化
C. 在常温下就分解气化 D.该涂料不可能发生分解
(2) CH3OH和液氧也是常用的液体推进剂。在300℃温度下,发生反应CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) △H>0 。保持温度为300℃,在2 L的密闭容器中加入1 mol CH3OH和1 molH2O,第4 min达到平衡,容器内c (CO2)随时间的变化情况如图所示:
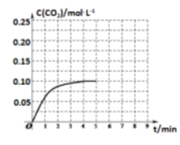
i.4min内H2的平均生成速率_______ 。
ii.请在上图中画出温度升高到T2时的c(CO2)变化曲线示意图_______ 。
iii.下列物理量可以作为该反应达到平衡状态的判断依据的是_______ 。
①混合气体的压强不变
②混合气体的密度不变
③B的物质的量浓度不变
④混合气体的总物质的量不变
⑤混合气体的平均相对分子质量不变
⑥v(CO2): v(H2)比值不变
⑦混合气体的总质量不变
A.②③④⑤⑥⑦ B. ①③④⑤ C.①②③④⑤⑦ D. ①③⑤
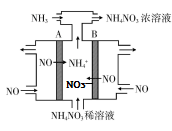
(3) NH4NO3也是一种重要的固体推进剂,可通过电解NO制备NH4NO3,其工作原理如图所示,AB处外接直流电源,请写出在B电极上发生的电极反应式:_______ 。
(1)火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.5 mol液态肼与足量过氧化氢反应,生成N2和气态水,放出250.0 kJ的热量。
①写出肼的结构式
②写出该反应的热化学方程式:
③火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是
A.在高温下不融化 B.在高温下可分解气化
C. 在常温下就分解气化 D.该涂料不可能发生分解
(2) CH3OH和液氧也是常用的液体推进剂。在300℃温度下,发生反应CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) △H>0 。保持温度为300℃,在2 L的密闭容器中加入1 mol CH3OH和1 molH2O,第4 min达到平衡,容器内c (CO2)随时间的变化情况如图所示:

i.4min内H2的平均生成速率
ii.请在上图中画出温度升高到T2时的c(CO2)变化曲线示意图
iii.下列物理量可以作为该反应达到平衡状态的判断依据的是
①混合气体的压强不变
②混合气体的密度不变
③B的物质的量浓度不变
④混合气体的总物质的量不变
⑤混合气体的平均相对分子质量不变
⑥v(CO2): v(H2)比值不变
⑦混合气体的总质量不变
A.②③④⑤⑥⑦ B. ①③④⑤ C.①②③④⑤⑦ D. ①③⑤
(3) NH4NO3也是一种重要的固体推进剂,可通过电解NO制备NH4NO3,其工作原理如图所示,AB处外接直流电源,请写出在B电极上发生的电极反应式:

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】含氮化合物广泛存在于自然界,是一类常见的化合物。
(1)汽车尾气是城市空气的主要污染物之一,汽车内燃机工作时发生反应: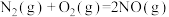 ,
, 可以催化还原
可以催化还原 以达到消除污染的目的。
以达到消除污染的目的。
已知反应Ⅰ、 ,
, ;
;
Ⅱ、 ,
,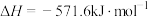 。
。
写出 与
与 反应生成
反应生成 和
和 的热化学方程式:
的热化学方程式:___________ ,该反应自发进行的条件为___________ (填“高温”或“低温”)。
(2)已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。如图所示为其他条件不变时,反应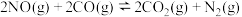 中
中 随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
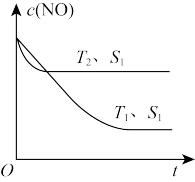
①该反应的
___________ (填“>”或“<”)0。
②若催化剂的表面积 ,在该图中画出该反应在
,在该图中画出该反应在 、
、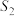 条件下达到平衡过程中
条件下达到平衡过程中 的变化曲线
的变化曲线___________ 。
(3)尿素是一种重要的化工原料,工业上可用氨和二氧化碳合成尿素: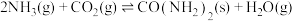 ,
, 。一定条件下,向10L恒容密闭容器中充入
。一定条件下,向10L恒容密闭容器中充入 和
和 。
。
①该反应 后达到平衡,测得容器中气体密度为
后达到平衡,测得容器中气体密度为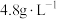 ,则平衡常数
,则平衡常数
___________ 。
②达到平衡后,再向容器中加入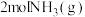 和
和 ,则再次达到平衡时反应物
,则再次达到平衡时反应物 的转化率
的转化率___________ (填“增大”“减小”或“不变”)。
③若第一次达到平衡后,再向容器中加入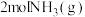 和
和 ,则平衡
,则平衡___________ (填“正向”“逆向”或“不”)移动。
(1)汽车尾气是城市空气的主要污染物之一,汽车内燃机工作时发生反应:
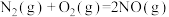 ,
, 可以催化还原
可以催化还原 以达到消除污染的目的。
以达到消除污染的目的。已知反应Ⅰ、
 ,
, ;
;Ⅱ、
 ,
,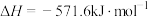 。
。写出
 与
与 反应生成
反应生成 和
和 的热化学方程式:
的热化学方程式:(2)已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。如图所示为其他条件不变时,反应
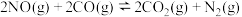 中
中 随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①该反应的

②若催化剂的表面积
 ,在该图中画出该反应在
,在该图中画出该反应在 、
、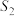 条件下达到平衡过程中
条件下达到平衡过程中 的变化曲线
的变化曲线(3)尿素是一种重要的化工原料,工业上可用氨和二氧化碳合成尿素:
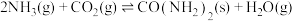 ,
, 。一定条件下,向10L恒容密闭容器中充入
。一定条件下,向10L恒容密闭容器中充入 和
和 。
。①该反应
 后达到平衡,测得容器中气体密度为
后达到平衡,测得容器中气体密度为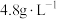 ,则平衡常数
,则平衡常数
②达到平衡后,再向容器中加入
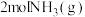 和
和 ,则再次达到平衡时反应物
,则再次达到平衡时反应物 的转化率
的转化率③若第一次达到平衡后,再向容器中加入
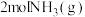 和
和 ,则平衡
,则平衡
您最近一年使用:0次
【推荐3】氢能是一种极具发展潜力的清洁能源。
(1)氢气的制取与储存是氢能源利用领域的研究热点.
已知:①CH4的燃烧热为890KJ·mol-1; ②H2的热值为50.2kJ·g-1
则甲烷部分氧化生成CO2和H2的热化学方程式为___________________________________ ;该反应自发进行的条件是___________ 。
(2)Bodensteins研究了如下反应:2HI(g) H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
①根据上述实验结果,该反应的平衡常数K的计算式为:___________ 。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,若k正=9.00min-1,在t=20min时,v逆=__________ min-1(保留三位有效数字)
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。在上述平衡基础上,缓慢升高到某一温度,反应重新达到平衡,请在下图中画出此过程的趋势图。______________
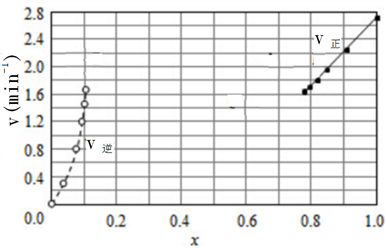
(3)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为______________________ 。
(1)氢气的制取与储存是氢能源利用领域的研究热点.
已知:①CH4的燃烧热为890KJ·mol-1; ②H2的热值为50.2kJ·g-1
则甲烷部分氧化生成CO2和H2的热化学方程式为
(2)Bodensteins研究了如下反应:2HI(g)
 H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1.00 | 0.910 | 0.850 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0.00 | 0.600 | 0.730 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,若k正=9.00min-1,在t=20min时,v逆=
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。在上述平衡基础上,缓慢升高到某一温度,反应重新达到平衡,请在下图中画出此过程的趋势图。

(3)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为
您最近一年使用:0次



