25℃时,向 的二元酸
的二元酸 溶液中逐滴滴入
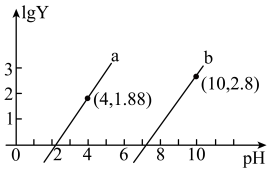
溶液中逐滴滴入 溶液,测得溶液的pH与lgY[Y代表
溶液,测得溶液的pH与lgY[Y代表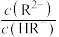 或
或 ]关系如图。下列相关结论错误的是
]关系如图。下列相关结论错误的是
 的二元酸
的二元酸 溶液中逐滴滴入
溶液中逐滴滴入 溶液,测得溶液的pH与lgY[Y代表
溶液,测得溶液的pH与lgY[Y代表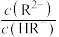 或
或 ]关系如图。下列相关结论错误的是
]关系如图。下列相关结论错误的是
A.曲线b表示pH与 的变化关系 的变化关系 |
B.25℃时, 的 的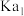 数量级为 数量级为 |
C.溶液的pH=7.2时, |
D.滴入20.00mLNaOH溶液时: |
更新时间:2024-03-08 08:16:47
|
相似题推荐
单选题
|
困难
(0.15)
名校
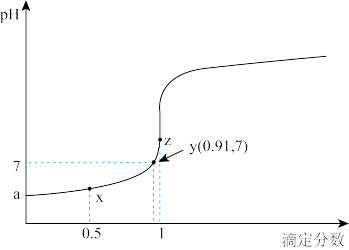
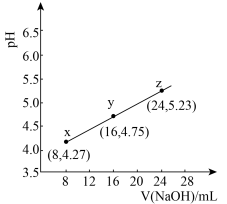
【推荐1】以0.10mol/L的氢氧化钠溶液滴定同浓度某一元酸HA的滴定曲线如图所示(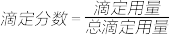 )。下列表述错误的是
)。下列表述错误的是
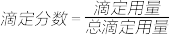 )。下列表述错误的是
)。下列表述错误的是
| A.z点后存在某点,溶液中的水的电离程度和y点的相同 |
| B.a约为3.5 |
C.z点处,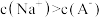 |
D.x点处的溶液中离子满足: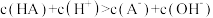 |
您最近一年使用:0次
【推荐2】测定溶液中乙二醛(含少量硝酸)含量的方法如下。
i.取V mL待测溶液于锥形瓶中,加入2滴酚酞溶液,用浓度为0.20 mol·L-1 NaOH溶液滴定至溶液恰好由无色变为粉红色,中和硝酸。
ii.向i所得溶液加入过量0.50 mol·L-1 NaOH溶液V1 mL,充全反应,使乙二醛反应生成CH2OHCOONa。
iii.用0.50 mol·L-1硫酸滴定ii中溶液至终点,消耗硫酸体积为V2 mL。
下列说法不正确 的是
i.取V mL待测溶液于锥形瓶中,加入2滴酚酞溶液,用浓度为0.20 mol·L-1 NaOH溶液滴定至溶液恰好由无色变为粉红色,中和硝酸。
ii.向i所得溶液加入过量0.50 mol·L-1 NaOH溶液V1 mL,充全反应,使乙二醛反应生成CH2OHCOONa。
iii.用0.50 mol·L-1硫酸滴定ii中溶液至终点,消耗硫酸体积为V2 mL。
下列说法
| A.根据结构分析,pKa:CH2OHCOOH < CH3COOH |
| B.乙二醛反应生成CH2OHCOONa属于氧化还原反应 |
| C.待测溶液中乙二醛浓度为(0.5V1-V2)/ V mol·L-1 |
| D.若不进行步骤i,测得溶液中乙二醛浓度偏低 |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐3】在含单质碘的KI溶液中存在可逆反应: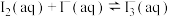 ,为测定该反应的平衡常数K进行如下实验,实验步骤如下:
,为测定该反应的平衡常数K进行如下实验,实验步骤如下:
①在装有 的KI溶液的碘量瓶中加入足量
的KI溶液的碘量瓶中加入足量 ,充分搅拌溶解,待过量的固体碘沉于瓶底后,取42.5mL上层清液,用
,充分搅拌溶解,待过量的固体碘沉于瓶底后,取42.5mL上层清液,用 萃取,充分振荡、静置、分液,得到42.5mL萃取后的水溶液、
萃取,充分振荡、静置、分液,得到42.5mL萃取后的水溶液、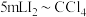 溶液。
溶液。
②取萃取后的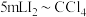 溶液于碘量瓶中,加水充分振荡,再加入质量分数为0.01%KI溶液,充分振荡后,静置5分钟,注入4mL0.2%的淀粉溶液,用
溶液于碘量瓶中,加水充分振荡,再加入质量分数为0.01%KI溶液,充分振荡后,静置5分钟,注入4mL0.2%的淀粉溶液,用 的
的 标准溶液滴定,平行滴定3次,平均消耗
标准溶液滴定,平行滴定3次,平均消耗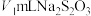 溶液。
溶液。
③将萃取后的水溶液42.5mL移入碘量瓶中,注入4mL0.2%的淀粉溶液,用 的
的 标准溶液滴定,平行滴定3次,平均消耗
标准溶液滴定,平行滴定3次,平均消耗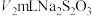 溶液。
溶液。
已知:(1)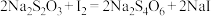 ;(2)
;(2) 与
与 难溶于
难溶于 ;(3)达到溶解平衡后,
;(3)达到溶解平衡后, 在
在 层和水层中的分配比
层和水层中的分配比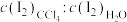 为
为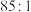
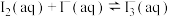 ,为测定该反应的平衡常数K进行如下实验,实验步骤如下:
,为测定该反应的平衡常数K进行如下实验,实验步骤如下:①在装有
 的KI溶液的碘量瓶中加入足量
的KI溶液的碘量瓶中加入足量 ,充分搅拌溶解,待过量的固体碘沉于瓶底后,取42.5mL上层清液,用
,充分搅拌溶解,待过量的固体碘沉于瓶底后,取42.5mL上层清液,用 萃取,充分振荡、静置、分液,得到42.5mL萃取后的水溶液、
萃取,充分振荡、静置、分液,得到42.5mL萃取后的水溶液、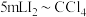 溶液。
溶液。②取萃取后的
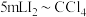 溶液于碘量瓶中,加水充分振荡,再加入质量分数为0.01%KI溶液,充分振荡后,静置5分钟,注入4mL0.2%的淀粉溶液,用
溶液于碘量瓶中,加水充分振荡,再加入质量分数为0.01%KI溶液,充分振荡后,静置5分钟,注入4mL0.2%的淀粉溶液,用 的
的 标准溶液滴定,平行滴定3次,平均消耗
标准溶液滴定,平行滴定3次,平均消耗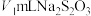 溶液。
溶液。③将萃取后的水溶液42.5mL移入碘量瓶中,注入4mL0.2%的淀粉溶液,用
 的
的 标准溶液滴定,平行滴定3次,平均消耗
标准溶液滴定,平行滴定3次,平均消耗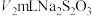 溶液。
溶液。已知:(1)
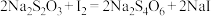 ;(2)
;(2) 与
与 难溶于
难溶于 ;(3)达到溶解平衡后,
;(3)达到溶解平衡后, 在
在 层和水层中的分配比
层和水层中的分配比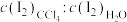 为
为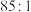

A.步骤①中萃取时若没有充分振荡,则导致所测 值偏小 值偏小 |
| B.步骤①中吸取上层清液时,不慎吸入碘固体,则测得的K偏大 |
| C.步骤②中滴定前滴定管有气泡,滴定后气泡消失,则测得的K偏大 |
| D.步骤③中滴定终点时俯视读数,则测得的K偏小 |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐1】工业上可用氨水处理硫酸厂尾气中的SO2.常温下,向一定浓度的氨水中通入SO2气体,溶液中lgx[x= 或
或 与溶液pH的关系如图所示。
与溶液pH的关系如图所示。
下列说法错误的是
 或
或 与溶液pH的关系如图所示。
与溶液pH的关系如图所示。
下列说法错误的是
A.曲线II代表lg |
B.当溶液的pH由7.2降到1.9的过程中,溶液中 浓度呈增大趋势 浓度呈增大趋势 |
C.当溶液中的c( ) =c(H2SO3)时,溶液的pH约为4 ) =c(H2SO3)时,溶液的pH约为4 |
D.(NH4)2SO3溶液中存在离子浓度关系:c(NH3·H2O) +c(OH-)>c(H+) +c( ) +c( H2SO3) ) +c( H2SO3) |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
【推荐2】某NaAlO2、Na2CO3的混合溶液中逐滴加入 1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。(已知:H2CO3的电离平衡常数K1=4.3×10-7,K2=5.6×10-11;Al(OH)3的酸式电离平衡常数K=6.3×10-13)则下列说法正确的是


| A.V1:V2=1:4 |
| B.M点时生成的CO2为0.05mol |
| C.原混合溶液中的CO32-与AlO2-的物质的量之比为1:3 |
| D.a曲线表示的离子方程式为:AlO2-+4H+=Al3++2H2O |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐1】肼 (N2H4)是一种二元弱碱。常温下,向 水溶液中滴加盐酸,所得混合溶液中
水溶液中滴加盐酸,所得混合溶液中 或
或 与pH的变化关系如图所示。下列说法错误的是
与pH的变化关系如图所示。下列说法错误的是

 水溶液中滴加盐酸,所得混合溶液中
水溶液中滴加盐酸,所得混合溶液中 或
或 与pH的变化关系如图所示。下列说法错误的是
与pH的变化关系如图所示。下列说法错误的是
A.常温下, 的电离平衡常数 的电离平衡常数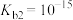 |
B.常温下,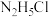 溶液的 溶液的 |
C.M点溶液中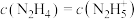 |
D.当溶液 时, 时,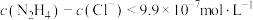 |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐2】缓冲溶液指的是由弱酸及其盐组成的混合溶液。缓冲溶液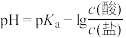 ,当酸和盐浓度相等时缓冲能力最强。丙酸(
,当酸和盐浓度相等时缓冲能力最强。丙酸( )简写为HR,其酸性比亚硝酸(
)简写为HR,其酸性比亚硝酸( )弱。298K时,用pH为13的NaOH溶液滴定
)弱。298K时,用pH为13的NaOH溶液滴定 溶液,溶液pH与NaOH溶液体积的关系如图所示。已知:
溶液,溶液pH与NaOH溶液体积的关系如图所示。已知: ,
,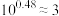 。
。
下列叙述正确的是
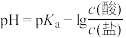 ,当酸和盐浓度相等时缓冲能力最强。丙酸(
,当酸和盐浓度相等时缓冲能力最强。丙酸( )简写为HR,其酸性比亚硝酸(
)简写为HR,其酸性比亚硝酸( )弱。298K时,用pH为13的NaOH溶液滴定
)弱。298K时,用pH为13的NaOH溶液滴定 溶液,溶液pH与NaOH溶液体积的关系如图所示。已知:
溶液,溶液pH与NaOH溶液体积的关系如图所示。已知: ,
,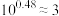 。
。下列叙述正确的是
A.常温下,丙酸电离常数 的数量级为 的数量级为 |
| B.在x、y、z点溶液中,缓冲能力最强的是z点 |
C.在z点溶液中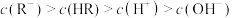 |
| D.若用同体积同浓度HNO2溶液替代HR溶液,则图中曲线竖直上移 |
您最近一年使用:0次
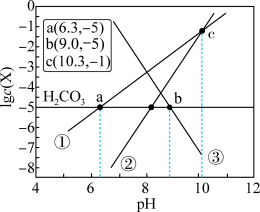
【推荐1】天然水体中的 与空气中的
与空气中的 保持平衡。某地溶洞水体中
保持平衡。某地溶洞水体中 (X为
(X为 、
、 、
、 或
或 )与pH的线性关系如图所示。下列说法不正确的是
)与pH的线性关系如图所示。下列说法不正确的是
 与空气中的
与空气中的 保持平衡。某地溶洞水体中
保持平衡。某地溶洞水体中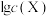 (X为
(X为 、
、 、
、 或
或 )与pH的线性关系如图所示。下列说法不正确的是
)与pH的线性关系如图所示。下列说法不正确的是
A.直线①代表 ,直线③代表 ,直线③代表 |
B.图中 |
C.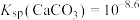 |
D.若空气中的 浓度增加,则水体中的 浓度增加,则水体中的 浓度减小 浓度减小 |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐2】常温下,Ka(CH3COOH)=1.0×10-5, 向某含有ZnSO4酸性废液加入一定量CH3COONa后,再通入H2S生成ZnS沉淀,始终保持H2S饱和,即c(H2S)=0.1mol/L,体系中pX[pX=—1gX,X为 、
、 或c(Zn2+), 单位为 mol/L]与
或c(Zn2+), 单位为 mol/L]与 关系如图。下列说法错误的是
关系如图。下列说法错误的是
 、
、 或c(Zn2+), 单位为 mol/L]与
或c(Zn2+), 单位为 mol/L]与 关系如图。下列说法错误的是
关系如图。下列说法错误的是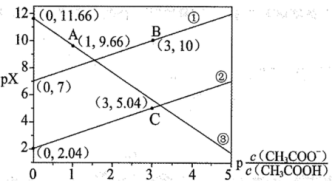
A.②中X为 | B.A 点溶液的pH为4 |
| C.Ka1(H₂S) 的数量级为10-7 | D.Ksp(ZnS)=10-21.7 |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐3】1784年,舍勒首先从柑橘中提取柠檬酸( ,常温下为固体,用H3A表示)。常温下,柠檬酸水溶液中存在下列平衡:
,常温下为固体,用H3A表示)。常温下,柠檬酸水溶液中存在下列平衡:
 H3A(aq) K。; H3A(aq)
H3A(aq) K。; H3A(aq) H++H2A- K1=10-3.13;
H++H2A- K1=10-3.13;H2A-
 H++HA2- K2=10-4.76; HA2-
H++HA2- K2=10-4.76; HA2- H++A3- K3=10-6.40。
H++A3- K3=10-6.40。测得溶液中
 [P(X)=-lgc(X),X=H2A-.HA2-或A3-]随pH的变化关系如图所示。
[P(X)=-lgc(X),X=H2A-.HA2-或A3-]随pH的变化关系如图所示。
| A.饱和溶液中c(H3A)不随pH变化 | B.直线①表示的离子是H2A- |
| C.A点的横坐标数值为5.58 | D.饱和NaH2A溶液一定呈酸性 |
您最近一年使用:0次

 )是二元弱酸。298K时,向一定浓度的
)是二元弱酸。298K时,向一定浓度的 溶液中滴加盐酸,混合溶液中含碳粒子浓度pX与pH的关系如图所示。已知:
溶液中滴加盐酸,混合溶液中含碳粒子浓度pX与pH的关系如图所示。已知: ,
, 或
或 )下列叙述正确的是
)下列叙述正确的是
 表示pH与
表示pH与 的关系
的关系
 时,溶液pH=3.26
时,溶液pH=3.26 的溶液中的溶质可能是
的溶液中的溶质可能是 和
和 时,向
时,向 溶液中滴加
溶液中滴加 溶液,溶液
溶液,溶液 与
与 溶液体积的关系曲线如图所示(已知:
溶液体积的关系曲线如图所示(已知: ),对图中
),对图中 、
、 、
、 、
、 四个点分析中,不正确的是
四个点分析中,不正确的是



 ,且
,且


