以NOx为主要成分的雾霾综合治理是当前重要的研究课题,其中汽车尾气的处理尤为重要。
已知:
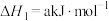
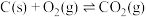

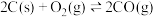
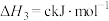
回答下列问题:
(1)汽车尾气中的NO和CO在催化转换器中发生以下反应可减少尾气污染:
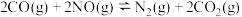 △H。则△H=
△H。则△H=
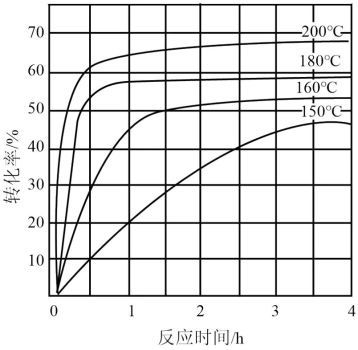
(2)某温度时,向2L恒容密闭体系中通入2mol CO和1mol NO发生反应:
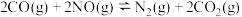
①下列能说明反应达到平衡状态的是
a.
b.体系中混合气体密度不再改变
c.CO与NO转化率的比值不再改变
d.该温度下,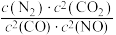 的值不再改变
的值不再改变
②某温度下,该反应达平衡时CO与CO2体积分数之比为3:2,则平衡常数为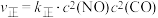 ,
,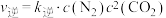 ,则该反应达到平衡时,
,则该反应达到平衡时,
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
③平衡时CO2的体积分数与温度、压强的关系如图所示。则温度:T1
④若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的
相似题推荐
 进行综合利用。
进行综合利用。Ⅰ.
 可用
可用 吸收获得
吸收获得 。
。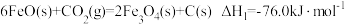
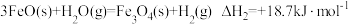
(1)
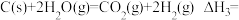

Ⅱ.
 可用来生产燃料甲醇。
可用来生产燃料甲醇。 。在体积为1L的恒容密闭容器中,充入
。在体积为1L的恒容密闭容器中,充入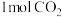 和
和 ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得 的浓度随时间的变化如表所示:
的浓度随时间的变化如表所示:时间/ | 0 | 3 | 5 | 10 | 15 |
浓度/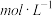 | 0 | 0.3 | 0.45 | 0.5 | 0.5 |
 的平衡转化率=
的平衡转化率=(3)下列措施中能使平衡体系中
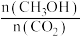 增大且不减慢化学反应速率的是_______。
增大且不减慢化学反应速率的是_______。| A.升高温度 | B.充入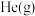 ,使体系压强增大 ,使体系压强增大 |
C.再充入 | D.将 从体系中分离出去 从体系中分离出去 |
 的物质的量浓度为
的物质的量浓度为 ,然后向容器中再加入一定量
,然后向容器中再加入一定量 ,待反应再一次达到平衡后,
,待反应再一次达到平衡后, 的物质的量浓度为
的物质的量浓度为 ,则
,则
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。

(1)NH3和O2在催化剂作用下反应,其化学方程式是
(2)2NO(g) + O2(g)
 2NO2(g) 是制造硝酸的重要反应之一。在800℃时,向容积为1 L的密闭容器中充入0.010 mol NO和0.005 mol O2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g) 是制造硝酸的重要反应之一。在800℃时,向容积为1 L的密闭容器中充入0.010 mol NO和0.005 mol O2,反应过程中NO的浓度随时间变化如下图所示。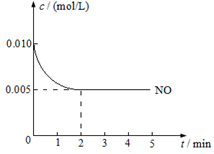
① 2 min内,v(O2) =
② 800℃时,该反应的化学平衡常数数值为
③ 已知:ⅰ.
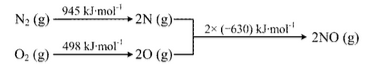
ⅱ.N2(g) + 2O2(g) === 2NO2(g) ΔH = + 68 kJ·mol-1
结合热化学方程式,说明温度对于NO生成NO2平衡转化率的影响:
(3)电解法处理含氮氧化物废气,可以回收硝酸。实验室模拟电解法吸收NO,装置如图所示:
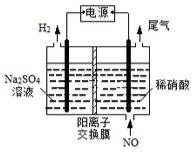
(均为石墨电极)。请写出电解过程中NO转化为硝酸的电极反应式:
(1)该矿石的化学式为
(2)①以该矿石灼烧后的固体产物为原料,真空高温条件下用单质硅还原,仅得到单质M和一种含氧酸盐(只含Z、Si和O元素,且Z和Si的物质的量之比为2∶1)。写出该反应的化学方程式
②单质M还可以通过电解熔融MCl2得到。不能用电解MCl2溶液的方法制备M的理由是
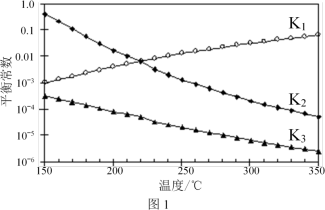
(3)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g) ⇌CO(g)+H2O(g) ΔH1
反应2:CO(g)+2H2(g) ⇌CH3OH(g) ΔH2
反应3:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图l所示。则ΔH2
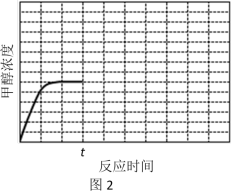
(4)在温度T1时,使体积比为3∶1的H2和CO2在体积恒定的密闭容器内进行反应。T1温度下甲醇浓度随时间变化曲线如图2所示;不改变其他条件,假定t时刻迅速降温到T2,一段时间后体系重新达到平衡。试在图中画出t时刻后甲醇浓度随时间变化至平衡的示意曲线
I.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)
 CO2(g)+H2(g) △H<0,得到如表数据:
CO2(g)+H2(g) △H<0,得到如表数据:| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | T1 |
| III | 900 | 2 | 2 | a | a | T2 |
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是
| A.容器内压强不再变化 | B.n2(H2)=n(H2O)•n(CO) |
| C.混合气体密度不变 | D.v正(CO)=v逆(CO2) |
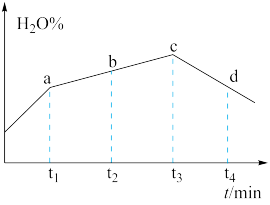
(4)若实验III的容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率随时间变化的示意图如图所示,b点v正
(5)CO和H2在一定条件下合成甲醇。甲醇/空气碱性燃料电池中,消耗32g甲醇,电池中有转移4.5mol电子。负极的电极反应式为
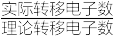 ×100%)
×100%)
(1)可利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ·mol-1
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是
(2)汽车内燃机工作时发生的反应为N2(g)+O2(g)
 2NO(g),生成的NO是汽车尾气的主要污染物。T℃时,向5L恒容密闭容器中充入6.5mol N2和7.5mol O2,在5min时反应达到平衡状态,此时容器中NO的物质的量5mol(不考虑后续反应)。则5min内该反应的平均速率v(NO)=
2NO(g),生成的NO是汽车尾气的主要污染物。T℃时,向5L恒容密闭容器中充入6.5mol N2和7.5mol O2,在5min时反应达到平衡状态,此时容器中NO的物质的量5mol(不考虑后续反应)。则5min内该反应的平均速率v(NO)=(3)汽车尾气中也含有CO,已知CO能发生可逆反应:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41kJ·mol-1。
CO2(g)+H2(g) ΔH=-41kJ·mol-1。①向某容器中充入1.0mol H2O(g)和1.0mol CO(g),在一定条件下发生上述反应。混合气体中CO的物质的量(mol)与时间关系如下表所示:
| 0 | 5min | 10min | 15min | 20min | 25min | |
| Ⅰ(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
| Ⅱ(800℃) | 1.0 | 0.70 | 0.60 | 0.50 | 0.50 | 0.50 |
相对实验Ⅰ,实验Ⅱ改变的条件可能是
②若开始时向绝热容器中投入一定量二氧化碳、氢气,在一定条件下发生上述可逆反应。下列图象正确且能说明可逆反应已达到平衡状态的是
A.
 B.
B. C.
C. D.
D.
(4)利用ClO2氧化氮氧化物反应过程如下:NO
 NO2
NO2 N2
N2反应Ⅰ的产物中还有两种强酸生成,其中硝酸与NO2的物质的量相等,则其化学方程式是
(1)在绝热恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:_______NO(g)+_______NH3(g)⇌_______N2(g)+_______H2O(g)。
①不能说明该反应已达到平衡状态标志的是
a.体系温度不变
b.反应速率5v(NH3)消耗 =4v(N2)消耗
c.容器内压强不再随时间而发生变化
d.容器内N2的物质的量分数不再随时间而发生变化
e.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
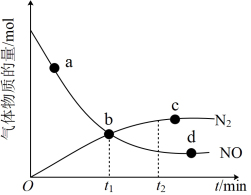
②某次实验中测得容器内NO及N2的物质的量随时间的变化如图所示,图中b点对应的反应速率关系是v正
 ” “
” “ ”或“
”或“ ”)。
”)。
(2)一定温度下,在2 L恒容密闭容器内发生反应2NO2(g)⇌N2O4(g),n(NO2)随时间的变化如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2) /mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
②根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是
③该温度下,反应2NO2(g)⇌N2O4(g)的平衡常数K=
(3)对于反应2NO2(g)⇌N2O4(g),用平衡时各组分压强关系表达的平衡常数
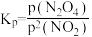 。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:v消耗(NO2)=k1·p2(NO2),v消耗(N2O4)=k2·p(N2O4)。其中k1、k2是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图所示:
。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:v消耗(NO2)=k1·p2(NO2),v消耗(N2O4)=k2·p(N2O4)。其中k1、k2是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图所示: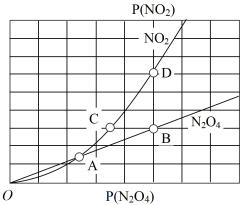
一定温度下,k1、k2与平衡常数KP的关系是k1=
| 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
中国科学家用金属钠和CO2在一定条件下制得了金刚石: 4 Na + 3CO2
 2 Na2CO3 + C(s,金刚石)
2 Na2CO3 + C(s,金刚石)(1)若反应在常压、890℃下进行,写出该反应的平衡常数表达式
a 反应肯定达到平衡 b 反应可能达到平衡 c 反应肯定未达平衡
(2)反应中还有石墨生成,已知:C(s,石墨)
 C(s,金刚石)- 1.9KJ,则升高温度,生成的碳单质中,金刚石的含量将
C(s,金刚石)- 1.9KJ,则升高温度,生成的碳单质中,金刚石的含量将(3)石墨的熔点比金刚石高,理由是
a 石墨中碳碳键键能更大 b 石墨有自由电子 c 石墨层与层之间有范德华力
(4)把副产物Na2CO3溶解,其溶液中存在的平衡体系请分别用化学用语表示出来
(5)容器内气体的平均相对分子质量将
(6)若反应时间为10min, 金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为
【推荐2】氮化镓(GaN)是一种重要的半导体材料。某工厂利用铝土矿(成分为Al2O3、Ga2O3、Fe2O3等)为原料制备GaN的流程如下图所示:
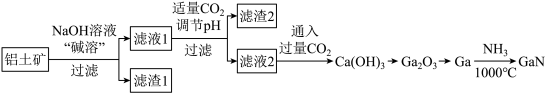
已知:镓与铝同主族,镓的熔点是29.8°C,沸点是2403°C;其氧化物和氢氧化物均为两性化合物;氢氧化物的电离常数如下:
两性氢氧化物 | Al( OH)3 | Ga( OH)3 |
酸式电离常数Ka | 2×10-11 | 1×10-7 |
碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
回答下列问题:
(1)为了提高 “碱溶”效率应采用的措施是
(2)滤渣1的成分是
(3)滤液2中通入过量CO2的理由是
(4)流程中利用镓与NH3在1000℃反应生成固体半导体材料 GaN,每生成l molGaN时放出15. 45 kJ热量,写出该反应的热化学方程式
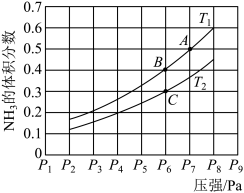
(5)在密闭容器中,充入一定量的Ga与NH3发生反应 ,测得反应平衡体系中NH3的体积分数与压强 P和温度T 的关系曲线如下图所示。图中A 点和C点化学平衡常数的大小关系: KA
(6)已知铝土矿中Ga2O3的质量分数为 a%,某工厂使用 w 吨铝土矿经过一系列反应, 反应过程中镓元素的总利用率为 b%能制得
(1)生产硝酸:
①NH3催化氧化是工业制硝酸的第一步反应,其化学方程式是
②除此之外,相同条件下还可能发生以下副反应:
4NH3(g)+4O2(g)=2N2O(g)+6H2O(g)
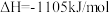
4NH3(g)+3O2(g)=2N2O(g)+6H2O(g)

两个副反应在理论上趋势均很大,但实际生产中影响并不大,原因是
(2)生产尿素:
①尿素的合成分两步进行;
a.2NH3(g)+CO2(g)
 NH2COONH4(l)
NH2COONH4(l) 
b.NH2COONH4(l)
 CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) 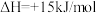
则总反应2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l)的
CO(NH2)2(l)+H2O(l)的 =
=②下图为n(NH3):n(CO2)=4:1时,温度对CO2的转化率的影响。解释温度升高CO2的平衡转化率增大的原因:
③测定尿素样品含氮量的方法如下:取a g尿素样品,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则尿素样品中氮元素的质量分数是
(1)已知:2C(s)+O2(g)=2CO(g) ΔH=-221.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
则C(s)与H2O(g)制备水煤气的热化学方程式为
(2)工业上通常用水煤气在恒容、催化剂和加热条件下生产甲醇,其热化学方程式为:CO(g)+2H2(g)⇌CH3OH(g) ΔH=-90.8kJ·mol-1。以下各项能说明该反应达到平衡状态的是_______。
| A.混合气体的密度保持不变 | B.容器内总压强保持不变 |
| C.CO的体积分数保持不变 | D.2v逆(H2)=v正(CH3OH) |
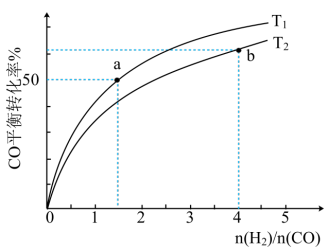
①温度T1
②T1时,往恒容容器中充入1molCO、1.5molH2,经过5min达到平衡,则5min内用H2表示的反应速率为v(H2)=
反应Ⅰ:
 ΔH1
ΔH1反应Ⅱ:
 ΔH2
ΔH2(1)已知CH4(g)、H2(g)的燃烧热ΔH依次为-893 kJ·mol-1、-285.8 kJ·mol-1;H2O(g)=H2O(1) ΔH3=-44 kJ·mol-1,则ΔH1=
(2)已知
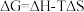 ,ΔG=-2.30RTlgKp(其中R为常数,T为温度,Kp为分压平衡常数),忽略ΔH、ΔS随温度的变化。在100 kPa压强下,反应Ⅱ的ΔG随温度变化的理论计算结果如下图所示。
,ΔG=-2.30RTlgKp(其中R为常数,T为温度,Kp为分压平衡常数),忽略ΔH、ΔS随温度的变化。在100 kPa压强下,反应Ⅱ的ΔG随温度变化的理论计算结果如下图所示。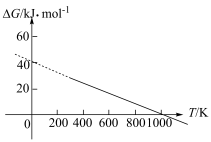
①反应Ⅱ自发进行的温度范围为
②1000 K时,将等物质的量的CO2和H2投入恒压密闭容器中,假设只发生反应Ⅱ,t min时达平衡状态,用CO2的分压变化表示t min内的平均反应速率v(CO2)=
(3)在恒压(p0 kPa)密闭容器中,通入5 mol CO2和20 mol H2反应,平衡时含碳物质的物质的量随温度的变化如图所示:
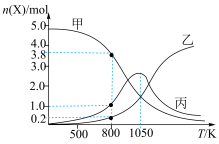
①曲线丙代表的物质的物质的量随温度升高先增大后减小的原因是
②CH4的选择性可表示为
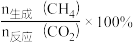 。800 K下,反应达平衡时,CH4的选择性为
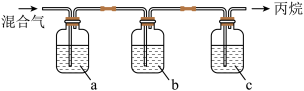
。800 K下,反应达平衡时,CH4的选择性为(1)丙烷中混有乙烯杂质,实验室用如图装置除杂,得到纯净的丙烷。若试剂a为酸性高锰酸钾溶液,则试剂b、c的名称分别为
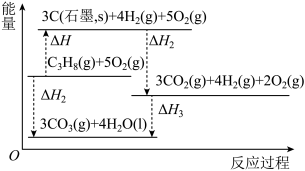
(2)如图为各组物质的能量总和及相互间转化的能量关系。丙烷气体分解得到石墨(C)和氢气的热化学方程式为
(3)在两个容积均为1 L的恒容密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入2 mol H2和一定量的CO2,在一定条件下发生反应2CO2(g) +6H2(g)
 C2 H4(g) +4H2O(g) △H。CO2的平衡转化率α(CO2)与温度的关系如图所示:
C2 H4(g) +4H2O(g) △H。CO2的平衡转化率α(CO2)与温度的关系如图所示:
①该反应的∆H
②在氢碳比为2.0时,Q点v(逆)
③氢碳比:x
④Q点对应温度下,该反应平衡常数K=



