甲烷干重整(DRM)以温室气体CH4和CO2为原料在催化条件下生成合成气CO和H2.体系中发生的反应有
ⅰ.CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1=+247kJ/mol
2CO(g)+2H2(g) △H1=+247kJ/mol
ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41kJ。mol1
CO(g)+H2O(g) △H2=+41kJ。mol1
ⅲ.CH4(g) C(s)+2H2(g) △H3=+74.9kJ/mol
C(s)+2H2(g) △H3=+74.9kJ/mol
ⅳ.2CO(g) C(s)+CO2(g) △H4
C(s)+CO2(g) △H4
(1)△H4=___________ kJ/mol。
(2)___________ (填“高温”或“低温”)有利于反应ⅰ自发进行。
(3)起始投入CH4和CO2各1kmol,DRM反应过程中所有物质在100kPa下的热力学平衡数据如图1所示。___________ (填“升高”、“不变”或“降低”),理由是___________ 。
②625℃时,起始投入CH4、CO2、H2、CO、H2O各0.5kmol,此时反应ⅱ的v正___________ v逆(填“>”“=”或“<”)。
(4)CO2在Ni基催化剂表面氢助解离有两种可能路径,图2为不同解离路径的能量变化,其中吸附在催化剂表面上的物种用*标注。___________ 。
②写出最有可能发生的“氢助解离”路径的决速步反应方程式___________ 。
ⅰ.CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1=+247kJ/mol
2CO(g)+2H2(g) △H1=+247kJ/molⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41kJ。mol1
CO(g)+H2O(g) △H2=+41kJ。mol1ⅲ.CH4(g)
 C(s)+2H2(g) △H3=+74.9kJ/mol
C(s)+2H2(g) △H3=+74.9kJ/molⅳ.2CO(g)
 C(s)+CO2(g) △H4
C(s)+CO2(g) △H4(1)△H4=
(2)
(3)起始投入CH4和CO2各1kmol,DRM反应过程中所有物质在100kPa下的热力学平衡数据如图1所示。
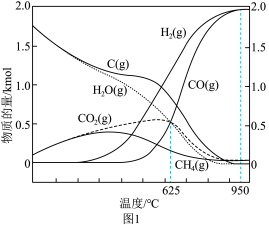
②625℃时,起始投入CH4、CO2、H2、CO、H2O各0.5kmol,此时反应ⅱ的v正
(4)CO2在Ni基催化剂表面氢助解离有两种可能路径,图2为不同解离路径的能量变化,其中吸附在催化剂表面上的物种用*标注。
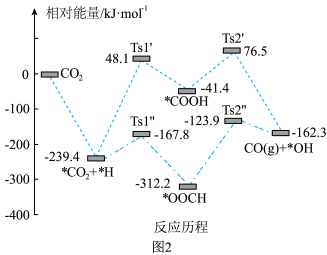
②写出最有可能发生的“氢助解离”路径的决速步反应方程式
更新时间:2024-05-11 20:37:57
|
相似题推荐
【推荐1】环氧乙烷( )、环氧丙烷(
)、环氧丙烷(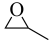 )都是重要的化工原料且用途广泛。回答下列问题:
)都是重要的化工原料且用途广泛。回答下列问题:
(1)已知:
①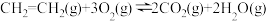

②2
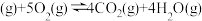
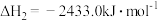
③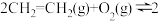


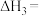
_____ 
(2)某温度下,物质的量均为1mol的CH2=CH2和O2在0.5L的刚性容器内发生反应③,5min后反应达到平衡,气体总压减少了20%。
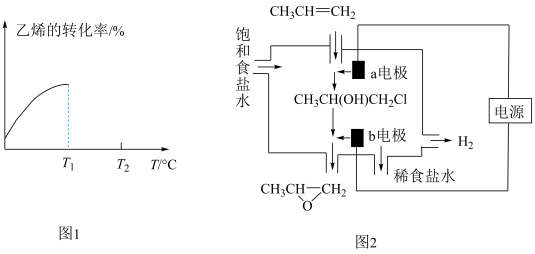
①平衡时CH2=CH2(g)的转化率为____ ,达到平衡后,欲增加CH2=CH2(g)的平衡转化率,可采取的措施是____ (填一条措施即可)。
②0~5min内,环氧乙烷的生成速率为____ 。
③该反应的平衡常数K_____ (精确到0.01)。
④当进料气CH2=CH2和O2的物质的量不变时,T1℃时达到反应平衡,请在图1中画出温度由T1℃变化到T2℃的过程中乙烯的转化率与温度的关系____ 。
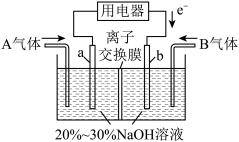
(3)将丙烯与饱和食盐水的电解产物反应,转化为氯丙醇[CH3CH(OH)CH2Cl][已知:CH3CH=CH2+H2O+Cl2→CH3CH(OH)CH2Cl+HCl],氯丙醇进一步反应生成环氧丙烷,其电解简易装置如图2所示。
①a电极上的电极反应式为______ 。
②b电极区域生成环氧丙烷的化学方程式为______ 。
 )、环氧丙烷(
)、环氧丙烷( )都是重要的化工原料且用途广泛。回答下列问题:
)都是重要的化工原料且用途广泛。回答下列问题:(1)已知:
①
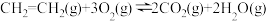

②2

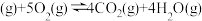
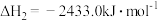
③
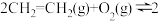



(2)某温度下,物质的量均为1mol的CH2=CH2和O2在0.5L的刚性容器内发生反应③,5min后反应达到平衡,气体总压减少了20%。
①平衡时CH2=CH2(g)的转化率为
②0~5min内,环氧乙烷的生成速率为
③该反应的平衡常数K
④当进料气CH2=CH2和O2的物质的量不变时,T1℃时达到反应平衡,请在图1中画出温度由T1℃变化到T2℃的过程中乙烯的转化率与温度的关系

(3)将丙烯与饱和食盐水的电解产物反应,转化为氯丙醇[CH3CH(OH)CH2Cl][已知:CH3CH=CH2+H2O+Cl2→CH3CH(OH)CH2Cl+HCl],氯丙醇进一步反应生成环氧丙烷,其电解简易装置如图2所示。
①a电极上的电极反应式为
②b电极区域生成环氧丙烷的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】开发氢能是实现社会可持续发展的需要。下图是以含H2S杂质的天然气为原料制取氢气的流程图。

回答下列问题:
(1)反应②的化学方程式为____________________________________________ 。
(2)反应④的离子方程式为____________________________________________ 。
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
Ⅱ:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是________  (填字母代号)。
(填字母代号)。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量。若1.00 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________ 。
③已知:反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
求:Ⅱ反应的逆反应方程式CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K=
CO(g)+H2O(g)的平衡常数K=________ (用K1和K2表示),且由表可知,反应CO2(g)+H2(g) CO(g)+H2O(g)是
CO(g)+H2O(g)是___________ 反应(填“吸热”或“放热”)。
(4)我国科研人员也提出了由CO2和CH4转化为高附加值产品和CH3COOH的催化反应历程,该历程示意图如下。下列说法不正确的是________

A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率

回答下列问题:
(1)反应②的化学方程式为
(2)反应④的离子方程式为
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1Ⅱ:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是
 (填字母代号)。
(填字母代号)。a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量。若1.00 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为
③已知:反应Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:| 700 ℃ | 900 ℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
求:Ⅱ反应的逆反应方程式CO2(g)+H2(g)
 CO(g)+H2O(g)的平衡常数K=
CO(g)+H2O(g)的平衡常数K= CO(g)+H2O(g)是
CO(g)+H2O(g)是(4)我国科研人员也提出了由CO2和CH4转化为高附加值产品和CH3COOH的催化反应历程,该历程示意图如下。下列说法不正确的是

A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】近年来,我国对雾霾的治理重视有加。研究NO2、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,发生反应的离子方程式是__________________ 。
(2)在恒温恒容的容器中充入3molCO,3molH2发生反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是
CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是____________ 。
A.CO和CH3OCH3(g)的生成速率相等
B.混合物中CO的体积分数保持不变
C.反应容器中的压强不再变化
D.反应容器内CO、H2、CH3OCH3(g)、H2O(g)四者共存
E.反应容器中混合气体的平均摩尔质量保持不变
(3)利用反应6NO2+8NH3=7N2+12H2O设计为电池可消除NO2,其简易装置如图所示。
①b极的电极反应式为______________________ 。
②常温下,若用该电池电解0.6L饱和KCl溶液,一段时间后,测得饱和KCl溶液pH变为13,则理论上a极上消耗A气体的体积为_____ mL(气体处于标准状况;假设电解过程中溶液体积不变)。
(4)化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:①2NO(g)=N2(g)+O2(g) ∆H1= -177kJ.mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ∆H2= -1253.4kJ.mol-1
则用NH3处理NO生成氮气和气态水的热化学方程式为___________________ 。
(5)氨氧化物可用碱溶液吸收。若NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,则该反应的化学方程式为____________ 。已知常温下.Ka(HNO2)=5×10-4,则反应HNO2(aq)+NaOH(aq) NaNO2(aq)+H2O(1)的平衡常数为
NaNO2(aq)+H2O(1)的平衡常数为________ 。
(1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,发生反应的离子方程式是
(2)在恒温恒容的容器中充入3molCO,3molH2发生反应2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是
CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是A.CO和CH3OCH3(g)的生成速率相等
B.混合物中CO的体积分数保持不变
C.反应容器中的压强不再变化
D.反应容器内CO、H2、CH3OCH3(g)、H2O(g)四者共存
E.反应容器中混合气体的平均摩尔质量保持不变
(3)利用反应6NO2+8NH3=7N2+12H2O设计为电池可消除NO2,其简易装置如图所示。

①b极的电极反应式为
②常温下,若用该电池电解0.6L饱和KCl溶液,一段时间后,测得饱和KCl溶液pH变为13,则理论上a极上消耗A气体的体积为
(4)化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:①2NO(g)=N2(g)+O2(g) ∆H1= -177kJ.mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ∆H2= -1253.4kJ.mol-1
则用NH3处理NO生成氮气和气态水的热化学方程式为
(5)氨氧化物可用碱溶液吸收。若NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,则该反应的化学方程式为
 NaNO2(aq)+H2O(1)的平衡常数为
NaNO2(aq)+H2O(1)的平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】进入秋冬季后,有些地区不时会遇到雾霾天气,影响人们的出行。氮氧化物(NOx)是雾霾的主要成分之一,消除氮氧化物有多种方法。回答下列问题:
(1)净化汽车尾气可减少空气中的NOx,净化时的主要原理为 。在恒容密闭容器中发生该反应时,c(CO2)随温度(T)和时间
。在恒容密闭容器中发生该反应时,c(CO2)随温度(T)和时间 的变化曲线如下图1所示。
的变化曲线如下图1所示。

①该反应的△H_______ 0(选填“>”或“<”)。
②在T2温度下,0~2s内的化学反应速率v(N2)=_______ 。
③能判断该反应达到平衡状态的标志是_______ (填标号)。
A.在单位时间内生成1molCO2的同时消耗了1molCO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再改变
(2)利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如下图2所示,则该历程总反应的化学方程式为_______ 。

(3)下图3所示的电解装置,可将雾霾中的NO、SO2转化为(NH4)2SO4和H2SO4,从而实现了废气的回收再利用,则通入NO一极的电极反应式为_______ ;若通入的NO体积为4.48L (标准状况下),则另外一个电极通入的SO2的质量至少为_______ g。

(1)净化汽车尾气可减少空气中的NOx,净化时的主要原理为
 。在恒容密闭容器中发生该反应时,c(CO2)随温度(T)和时间
。在恒容密闭容器中发生该反应时,c(CO2)随温度(T)和时间 的变化曲线如下图1所示。
的变化曲线如下图1所示。
①该反应的△H
②在T2温度下,0~2s内的化学反应速率v(N2)=
③能判断该反应达到平衡状态的标志是
A.在单位时间内生成1molCO2的同时消耗了1molCO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再改变
(2)利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如下图2所示,则该历程总反应的化学方程式为

(3)下图3所示的电解装置,可将雾霾中的NO、SO2转化为(NH4)2SO4和H2SO4,从而实现了废气的回收再利用,则通入NO一极的电极反应式为

您最近一年使用:0次
【推荐2】合成氨工业对国民经济和社会发展具有重要的意义,回答以下问题:
(1)如图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,正反应的活化能为___________ kJ/mol。

(2)请写出N2和H2反应的热化学方程式:___________ 。
(3)合成氨反应的化学平衡常数表达式为
___________ 。
(4)根据温度对化学平衡的影响规律可知,对于该反应温度越高,其化学平衡常数的值___________ 。(填“越大”、“越小”或“不变”)
(5)某温度下,若把 与
与 置于体积为
置于体积为 的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的
的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的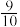 ,则平衡时氢气的转化率
,则平衡时氢气的转化率 =
=___________ (用百分数表示 。能说明该反应达到化学平衡状态的是
。能说明该反应达到化学平衡状态的是___________  填字母
填字母 。
。
a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(6)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)___________ 。
A. B.
B.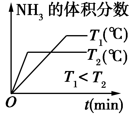 C.
C.
(7)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)∆H=—a kJ/mol ①
N2(g)+O2(g)=2NO(g) ∆H=+b kJ/mol②
求:若1molNH3还原NO至N2,则该反应过程中的反应热∆H=___________ kJ/mol(用含a、b的式子表示)。
(1)如图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,正反应的活化能为

(2)请写出N2和H2反应的热化学方程式:
(3)合成氨反应的化学平衡常数表达式为

(4)根据温度对化学平衡的影响规律可知,对于该反应温度越高,其化学平衡常数的值
(5)某温度下,若把
 与
与 置于体积为
置于体积为 的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的
的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的 ,则平衡时氢气的转化率
,则平衡时氢气的转化率 =
= 。能说明该反应达到化学平衡状态的是
。能说明该反应达到化学平衡状态的是 填字母
填字母 。
。a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(6)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)
A.
 B.
B. C.
C.
(7)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)∆H=—a kJ/mol ①
N2(g)+O2(g)=2NO(g) ∆H=+b kJ/mol②
求:若1molNH3还原NO至N2,则该反应过程中的反应热∆H=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g)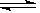 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)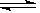 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)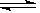 SO3(g)+NO(g)的ΔH=
SO3(g)+NO(g)的ΔH=_______ kJ·mol-1。
(2)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_______ 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=_________ 。(保留2位小数)
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)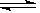 CH3OH(g)。
CH3OH(g)。
CO在不同温度下的平衡转化率与压强的关系如图所示。

该反应ΔH_____ 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是___________________________________ 。
(1)已知:2SO2(g)+O2(g)
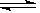 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-12NO(g)+O2(g)
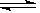 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1则反应NO2(g)+SO2(g)
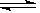 SO3(g)+NO(g)的ΔH=
SO3(g)+NO(g)的ΔH=(2)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
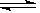 CH3OH(g)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。

该反应ΔH
您最近一年使用:0次
【推荐1】二氧化硫的污染治理是化学家关注的热点问题之一,回答下列问题。
I.二氧化硫的治理。已知25℃时,Kb(NH3·H2O)=1.8×10-5 Ksp(CaSO4)=7.1×10-5 Ka1(H2SO3)=1.5×10-2 Ka2(H2SO3)=1.0×10-7。
(1)亚硫酸盐法。将含二氧化硫的烟气通入1.0mol·L-1的Na2SO3溶液,写出该反应的化学方程式_______ 。若此过程中溶液体积不变,则溶液的pH将_______ (填“减小”“不变”或“增大)。
(2)双碱脱硫法。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH +SO
+SO ⇌CaSO4↓+2NH3·H2O
⇌CaSO4↓+2NH3·H2O
计算第2步反应的K=_______ (填数值,保留2位有效数字)。
(3)电解法。先用Na2SO4溶液吸收烟气中的SO2,再用离子膜电解法电解吸收液得到单质硫,同时在阳极得到副产物氧气,装置如图所示。

①b为电源的_______ (填“正极”或“负极”)。
②用Na2SO4溶液代替水吸收烟气中的SO2,目的是_______ 。
③若电解一段时间后通过质子交换膜的离子数为1.204×1024个,则通过处理烟气理论上能得到硫_______ kg。
II.二氧化硫的转化。
(4)适当调控硫酸工业的反应条件可提高二氧化硫的转化率,减少其排放。已知,对于放热的可逆反应,某一给定转化率下,最大反应速率对应的温度称为最适宜温度。在图中画出反应2SO2(g)+O2(g)⇌2SO3(g)的转化率与最适宜温度(曲线a)、平衡转化率与温度(曲线b)的关系曲线示意图(标明曲线 a 、 b )_______ 。

I.二氧化硫的治理。已知25℃时,Kb(NH3·H2O)=1.8×10-5 Ksp(CaSO4)=7.1×10-5 Ka1(H2SO3)=1.5×10-2 Ka2(H2SO3)=1.0×10-7。
(1)亚硫酸盐法。将含二氧化硫的烟气通入1.0mol·L-1的Na2SO3溶液,写出该反应的化学方程式
(2)双碱脱硫法。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH
 +SO
+SO ⇌CaSO4↓+2NH3·H2O
⇌CaSO4↓+2NH3·H2O计算第2步反应的K=
(3)电解法。先用Na2SO4溶液吸收烟气中的SO2,再用离子膜电解法电解吸收液得到单质硫,同时在阳极得到副产物氧气,装置如图所示。

①b为电源的
②用Na2SO4溶液代替水吸收烟气中的SO2,目的是
③若电解一段时间后通过质子交换膜的离子数为1.204×1024个,则通过处理烟气理论上能得到硫
II.二氧化硫的转化。
(4)适当调控硫酸工业的反应条件可提高二氧化硫的转化率,减少其排放。已知,对于放热的可逆反应,某一给定转化率下,最大反应速率对应的温度称为最适宜温度。在图中画出反应2SO2(g)+O2(g)⇌2SO3(g)的转化率与最适宜温度(曲线a)、平衡转化率与温度(曲线b)的关系曲线示意图(

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】(1)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)⇌CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
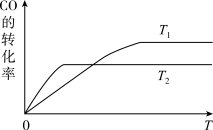
①T1______ T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1______ K2(填“>”、“<”或“=”)。
②若容器容积不变,下列措施不能增加CO转化率的是______ (填字母)。
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
(2)化学需氧量(COD)可量度水体受有机物污染的程度,以K2Cr2O7作强氧化剂处理水样时所消耗的K2Cr2O7的量换算成相当于O2的含量(以mg·L-1)来计量。
①处理时,水样应酸化,最好选用______ (“稀硝酸”、“稀硫酸”、“稀盐酸”)酸化。
②在该条件下,Cr2O 最终转化为Cr3+。取水样100mL,处理该水样时消耗了10mL0.025mol·L-1的K2Cr2O7溶液,求该水样的COD
最终转化为Cr3+。取水样100mL,处理该水样时消耗了10mL0.025mol·L-1的K2Cr2O7溶液,求该水样的COD______ (写出计算过程)

①T1
②若容器容积不变,下列措施不能增加CO转化率的是
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
(2)化学需氧量(COD)可量度水体受有机物污染的程度,以K2Cr2O7作强氧化剂处理水样时所消耗的K2Cr2O7的量换算成相当于O2的含量(以mg·L-1)来计量。
①处理时,水样应酸化,最好选用
②在该条件下,Cr2O
 最终转化为Cr3+。取水样100mL,处理该水样时消耗了10mL0.025mol·L-1的K2Cr2O7溶液,求该水样的COD
最终转化为Cr3+。取水样100mL,处理该水样时消耗了10mL0.025mol·L-1的K2Cr2O7溶液,求该水样的COD
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】完成下列问题。
(1)煤化工可以制取甲醇,甲醇﹣空气燃料电池,以KOH溶液为电解质溶液(电极材料为惰性电极),当KOH全部转化为KHCO3,停止放电,写出负极的电极反应式__________ 。
(2)煤化工中生产合成气的反应为: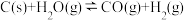
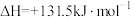 。
。
①该反应在_______ (填高温或低温)自发进行。
②在恒温恒容下,同时放入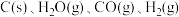 四种物质,下列事实能够说明反应
四种物质,下列事实能够说明反应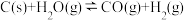
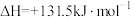 已达到平衡的是
已达到平衡的是____ 。
A.反应体系中,混合气体的密度不再改变
B.反应体系中,CO和H2的体积分数相等
C.反应体系中,当有2mol H−O键断裂的同时有1mol H−H键形成
D.混合气体的平均相对分子质量保持不变
(3)下列事实可以证明尿酸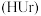 是弱电解质的是___________(填字母)。
是弱电解质的是___________(填字母)。
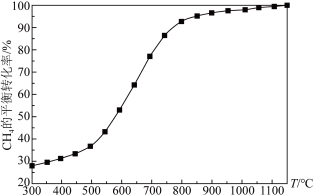
(4)天然气化工中生产合成气的主要反应为:2CH4(g)+O2(g)⇌2CO(g)+4H2(g)ΔH=akJ•mol-1。在恒容容器中按物质的量之比1:2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示,请在图中画出压强为5.05×105Pa时CH4的平衡转化率随温度的变化曲线___________ 。
(1)煤化工可以制取甲醇,甲醇﹣空气燃料电池,以KOH溶液为电解质溶液(电极材料为惰性电极),当KOH全部转化为KHCO3,停止放电,写出负极的电极反应式
(2)煤化工中生产合成气的反应为:
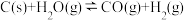
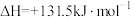 。
。①该反应在
②在恒温恒容下,同时放入
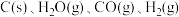 四种物质,下列事实能够说明反应
四种物质,下列事实能够说明反应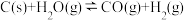
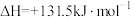 已达到平衡的是
已达到平衡的是A.反应体系中,混合气体的密度不再改变
B.反应体系中,CO和H2的体积分数相等
C.反应体系中,当有2mol H−O键断裂的同时有1mol H−H键形成
D.混合气体的平均相对分子质量保持不变
(3)下列事实可以证明尿酸
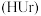 是弱电解质的是___________(填字母)。
是弱电解质的是___________(填字母)。A. 溶液显碱性 溶液显碱性 |
B.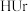 溶液可使紫色石蕊溶液变红 溶液可使紫色石蕊溶液变红 |
C. 时,等浓度的尿酸溶液的导电性比盐酸弱 时,等浓度的尿酸溶液的导电性比盐酸弱 |
D. 溶液与 溶液与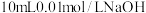 溶液完全反应 溶液完全反应 |
(4)天然气化工中生产合成气的主要反应为:2CH4(g)+O2(g)⇌2CO(g)+4H2(g)ΔH=akJ•mol-1。在恒容容器中按物质的量之比1:2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示,请在图中画出压强为5.05×105Pa时CH4的平衡转化率随温度的变化曲线

您最近一年使用:0次



