 不仅是一种温室气体,也是一种来源广泛且廉价易得的碳资源,可通过热化学、电化学等方法再利用。其中甲烷干重整反应可以将两类重要的温室气体
不仅是一种温室气体,也是一种来源广泛且廉价易得的碳资源,可通过热化学、电化学等方法再利用。其中甲烷干重整反应可以将两类重要的温室气体 和
和 进行重整,涉及主要反应如下:
进行重整,涉及主要反应如下:反应I:
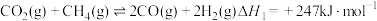
反应Ⅱ:

(1)若恒温、恒压的密闭容器中只发生反应I,下列能说明反应已达到化学平衡状态的是______。
| A.容器内气体密度不再发生变化 |
B. 和CO的物质的量之和不变 和CO的物质的量之和不变 |
C.化学反应速率 |
D.断裂4mol 键的同时生成2mol 键的同时生成2mol 键 键 |
(2)恒温刚性密闭容器中,按
 投料,初始总压3MPa,达到平衡状态时测得
投料,初始总压3MPa,达到平衡状态时测得 和
和 转化率分别为60%、40%。计算该温度下反应I的压强平衡常数
转化率分别为60%、40%。计算该温度下反应I的压强平衡常数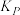 =
=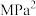 (用各物质的分压代替物质的量浓度计算,分压=总压×物质的量分数)。
(用各物质的分压代替物质的量浓度计算,分压=总压×物质的量分数)。(3)某研究小组为了评估甲烷干重整反应中不同催化剂的性能差异,在常压、催化剂作用下,按
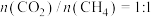 投料,不同温度下反应相同时间,测得
投料,不同温度下反应相同时间,测得 的转化率(柱形图)和产物
的转化率(柱形图)和产物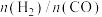 (
( )如图所示。请分析产物
)如图所示。请分析产物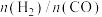 随温度变化的原因(不考虑催化剂失活)
随温度变化的原因(不考虑催化剂失活)
 ;
;(b)
 。因此该小组借助X射线衍射(如图)定性评估催化剂的积碳情况。已知积碳会在
。因此该小组借助X射线衍射(如图)定性评估催化剂的积碳情况。已知积碳会在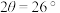 出现衍射峰,下列说法正确的是______。
出现衍射峰,下列说法正确的是______。
| A.碳附着在催化剂表面,使得活性位点与反应物之间的接触受阻,所以催化活性受到抑制 |
| B.一般甲烷干重整的反应温度都很高,因此副反应a很可能是实际过程中产生积碳的主要原因 |
| C.对比三种催化剂的X射线衍射结果可发现Ir型催化剂没有明显积碳,能在甲烷干重整过程中保持高稳定性 |
| D.该小组进一步评估新型金属复合催化剂(H型和M型)的积碳情况,将反应后的催化剂加热至恒重后,发现H型和M型催化剂的重量损失分别为16.7%和10.2%,这表明H型催化剂能在甲烷干重整过程中保持更高的稳定性 |
(5)该研究小组查阅资料发现还可利用电解还原
 ,电解过程中常需要调控溶液pH以实现有效转化。现有1.0L
,电解过程中常需要调控溶液pH以实现有效转化。现有1.0L
 溶液,在298K下加入醋酸钾固体将
溶液,在298K下加入醋酸钾固体将 调至
调至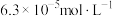 ,忽略溶液体积变化,所加醋酸钾固体的质量为
,忽略溶液体积变化,所加醋酸钾固体的质量为 ]
]
更新时间:2024-05-21 21:17:50
|
相似题推荐
【推荐1】某小组探究Cu与HNO3反应,发现有趣的现象。室温下,溶液A遇铜片立即产生气泡,而相同条件下3mol∙L-1稀硝酸(溶液B)遇铜片短时间内无明显变化,一段时间后才有少量气泡产生。
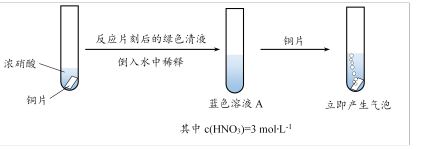
(1)铜与稀硝酸反应的化学方程式:______ 。
(2)分析溶液A的成分后,同学们探究溶液A与铜片能够立即发生反应的原因。
①假设1:______ 对该反应有催化作用。
实验验证:向B中加入少量硝酸铜,溶液呈浅蓝色,放入铜片,没有明显变化。
结论:假设1不成立。
②假设2:NO2对该反应有催化作用。
方案1:向放有铜片的B中通入少量NO2,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向放有铜片的B中加入数滴5mol∙L-1硝酸,无明显变化。补充该实验的目的是______ 。
方案2:向A中鼓入N2数分钟得溶液C。相同条件下,铜片与A、B、C溶液的反应速率:v(A)>v(C)>v(B)。该实验能够证明假设2成立的理由是______ 。
③经检验,A溶液中还含有少量HNO2。实验证明HNO2也对该反应有催化作用,操作和现象是:向含有铜片的B溶液中______ 。
结论:NO2和HNO2对铜与硝酸的反应都有催化作用。
(3)请推测Cu与稀硝酸反应中NO2和HNO2参与的可能催化过程:
①Cu+2NO2+2H+=Cu2++2HNO2
②______ 。
③______ 。

(1)铜与稀硝酸反应的化学方程式:
(2)分析溶液A的成分后,同学们探究溶液A与铜片能够立即发生反应的原因。
①假设1:
实验验证:向B中加入少量硝酸铜,溶液呈浅蓝色,放入铜片,没有明显变化。
结论:假设1不成立。
②假设2:NO2对该反应有催化作用。
方案1:向放有铜片的B中通入少量NO2,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向放有铜片的B中加入数滴5mol∙L-1硝酸,无明显变化。补充该实验的目的是
方案2:向A中鼓入N2数分钟得溶液C。相同条件下,铜片与A、B、C溶液的反应速率:v(A)>v(C)>v(B)。该实验能够证明假设2成立的理由是
③经检验,A溶液中还含有少量HNO2。实验证明HNO2也对该反应有催化作用,操作和现象是:向含有铜片的B溶液中
结论:NO2和HNO2对铜与硝酸的反应都有催化作用。
(3)请推测Cu与稀硝酸反应中NO2和HNO2参与的可能催化过程:
①Cu+2NO2+2H+=Cu2++2HNO2
②
③
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】甲烷是一种清洁燃料,与水制氢和天然气脱硫具有重要的现实意义。回答下列问题:
Ⅰ.一定条件下,甲烷和水蒸气催化制氢主要有如下两个反应:
①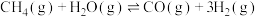
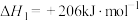
②
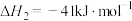
恒定压强为100kPa时,将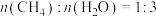 的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。
的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。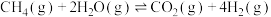

______  ,反应在
,反应在______ 条件下能自发进行。
(2)600℃时, 的平衡分压为
的平衡分压为______ kPa,反应②的物质的量分数的平衡常数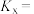
______ (用物质的量分数代替平衡浓度计算,保留2位有效数字)。
(3)系统中q的含量在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:______ 。
Ⅱ.与 重整,不但可以消除污染,还可以制氢。主要反应如下:
重整,不但可以消除污染,还可以制氢。主要反应如下: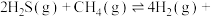
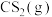
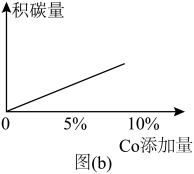
 。在研究反应发生的适宜条件时,Co助剂有稳定催化剂的作用。
。在研究反应发生的适宜条件时,Co助剂有稳定催化剂的作用。
(4)图(a)为800℃、 催化剂条件下投入等量
催化剂条件下投入等量 ,不同投料比分别达到平衡时
,不同投料比分别达到平衡时 转化率、平均反应速率图。C组图像中平均速率最低的原因可能是
转化率、平均反应速率图。C组图像中平均速率最低的原因可能是______ ;相同质量的同种催化剂,在载体上的分散度越高,催化作用越强,原因是______ 。______ 反应(填化学方程式)。
Ⅰ.一定条件下,甲烷和水蒸气催化制氢主要有如下两个反应:
①
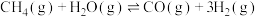
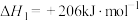
②

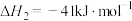
恒定压强为100kPa时,将
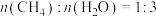 的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。
的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。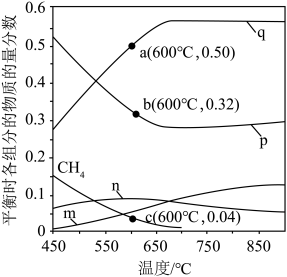
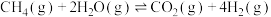

 ,反应在
,反应在(2)600℃时,
 的平衡分压为
的平衡分压为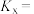
(3)系统中q的含量在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
Ⅱ.与
 重整,不但可以消除污染,还可以制氢。主要反应如下:
重整,不但可以消除污染,还可以制氢。主要反应如下: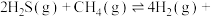
 。在研究反应发生的适宜条件时,Co助剂有稳定催化剂的作用。
。在研究反应发生的适宜条件时,Co助剂有稳定催化剂的作用。(4)图(a)为800℃、
 催化剂条件下投入等量
催化剂条件下投入等量 ,不同投料比分别达到平衡时
,不同投料比分别达到平衡时 转化率、平均反应速率图。C组图像中平均速率最低的原因可能是
转化率、平均反应速率图。C组图像中平均速率最低的原因可能是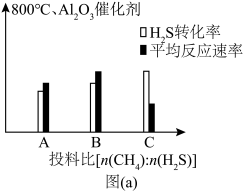
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】硫酸工厂尾气中常常含有较多的SO2,常采用如下方法进行处理。
Ⅰ.氨水吸收法。匀速向氨水中通入SO2,下列措施能提高尾气中SO2去除率的是___________ (填字母)。
a.增大氨水浓度
b.升高反应温度
c.使尾气与氨水充分接触
d.通入空气使HSO3-转化为SO
Ⅱ.O3氧化法。已知:3O2(g)⇌2O3(g) ΔH1=+287.2 kJ·mol-1
SO2(g)+0.5O2(g)⇌SO3(g) ΔH2=-98 kJ·mol-1
则SO2(g)+O3(g)⇌SO3(g)+O2(g) ΔH3=___________ KJ·mol-1。
Ⅲ.CO还原法。
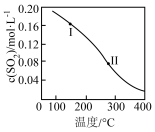
(1)SO2与CO反应的热化学方程式为2CO(g)+SO2(g)⇌S(l)+2CO2(g),ΔH=akJ·mol-1.在体积为1.0L的恒容密闭容器中加入0.4molCO和0.2molSO2.平衡时SO2的物质的量浓度随温度的变化如图所示(图中Ⅰ、Ⅱ点均处于曲线上)。则平衡常数K(状态Ⅰ)_________ K(状态Ⅱ)(填“大于”、“小于”或“等于”,下同)。逆反应速率v逆:v逆(状态Ⅰ)_________ v逆(状态Ⅱ)
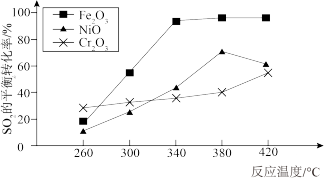
(2)其他条件相同,催化剂不同时,反应相同时间SO2的转化率随反应温度的变化如图所示,260℃条件下选择_____ (填“Fe2O3”、“NiO”或“Cr2O3”)作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择Fe2O3作催化剂的优势是______ 。
Ⅰ.氨水吸收法。匀速向氨水中通入SO2,下列措施能提高尾气中SO2去除率的是
a.增大氨水浓度
b.升高反应温度
c.使尾气与氨水充分接触
d.通入空气使HSO3-转化为SO

Ⅱ.O3氧化法。已知:3O2(g)⇌2O3(g) ΔH1=+287.2 kJ·mol-1
SO2(g)+0.5O2(g)⇌SO3(g) ΔH2=-98 kJ·mol-1
则SO2(g)+O3(g)⇌SO3(g)+O2(g) ΔH3=
Ⅲ.CO还原法。
(1)SO2与CO反应的热化学方程式为2CO(g)+SO2(g)⇌S(l)+2CO2(g),ΔH=akJ·mol-1.在体积为1.0L的恒容密闭容器中加入0.4molCO和0.2molSO2.平衡时SO2的物质的量浓度随温度的变化如图所示(图中Ⅰ、Ⅱ点均处于曲线上)。则平衡常数K(状态Ⅰ)

(2)其他条件相同,催化剂不同时,反应相同时间SO2的转化率随反应温度的变化如图所示,260℃条件下选择

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】甲烷、二氧化碳都是“碳一化学”的重要成员,在工业生产中应用广泛。回答下列问题:
(1)利用甲烷可实现 的消除。
的消除。
已知:甲烷的燃烧热(25℃、101kPa)为890.3
反应ⅰ.

反应ⅱ.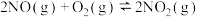
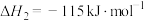

则消除 的反应:
的反应: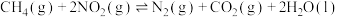

___________ 。反应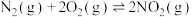 的
的
___________ (用含 、
、 的式子表示)。
的式子表示)。
(2)现向一密闭容器中充入一定量的 (g)和
(g)和 (g),保持总压为160kPa,发生反应:
(g),保持总压为160kPa,发生反应: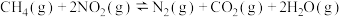
 。
。
①能表示该反应已经达到平衡状态的是___________ (填字母)。
A. B.混合气体的平均相对分子质量保持不变
B.混合气体的平均相对分子质量保持不变
C.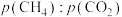 保持不变 D.甲烷与二氧化氮的转化率之比为1∶1
保持不变 D.甲烷与二氧化氮的转化率之比为1∶1
②若初始投料 ,
, 的平衡转化率与温度(T)的关系如图所示:
的平衡转化率与温度(T)的关系如图所示:
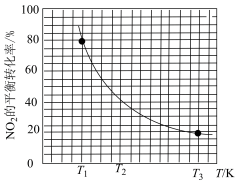
温度为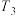 时,若反应从开始到平衡用时10min,则该时间段内用分压表示的平均反应速率
时,若反应从开始到平衡用时10min,则该时间段内用分压表示的平均反应速率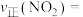
___________ 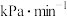 ;该温度下反应的压强平衡常数
;该温度下反应的压强平衡常数
___________ (分压=总压×物质的量分数)。
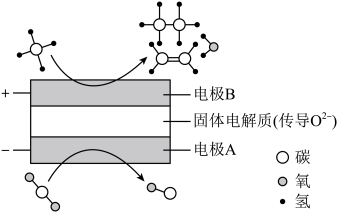
(3)某团队合成的低配位Cu在碱性条件下催化 还原生成乙烯的电化学装置如图所示。
还原生成乙烯的电化学装置如图所示。
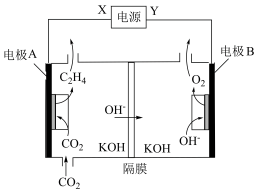
①Y为电源的___________ (填“正极”或“负极”)。
②电极A上消耗的 与电极B上生成的
与电极B上生成的 的物质的量之比为
的物质的量之比为___________ 。
(1)利用甲烷可实现
 的消除。
的消除。已知:甲烷的燃烧热(25℃、101kPa)为890.3

反应ⅰ.
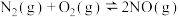
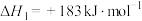

反应ⅱ.
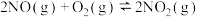
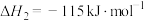

则消除
 的反应:
的反应: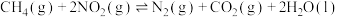

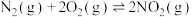 的
的
 、
、 的式子表示)。
的式子表示)。(2)现向一密闭容器中充入一定量的
 (g)和
(g)和 (g),保持总压为160kPa,发生反应:
(g),保持总压为160kPa,发生反应: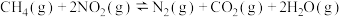
 。
。①能表示该反应已经达到平衡状态的是
A.
 B.混合气体的平均相对分子质量保持不变
B.混合气体的平均相对分子质量保持不变C.
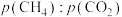 保持不变 D.甲烷与二氧化氮的转化率之比为1∶1
保持不变 D.甲烷与二氧化氮的转化率之比为1∶1②若初始投料
 ,
, 的平衡转化率与温度(T)的关系如图所示:
的平衡转化率与温度(T)的关系如图所示:
温度为
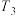 时,若反应从开始到平衡用时10min,则该时间段内用分压表示的平均反应速率
时,若反应从开始到平衡用时10min,则该时间段内用分压表示的平均反应速率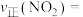
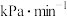 ;该温度下反应的压强平衡常数
;该温度下反应的压强平衡常数
(3)某团队合成的低配位Cu在碱性条件下催化
 还原生成乙烯的电化学装置如图所示。
还原生成乙烯的电化学装置如图所示。
①Y为电源的
②电极A上消耗的
 与电极B上生成的
与电极B上生成的 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】近日,我国建成首个“西氢东送”输氢管道示范工程。目前,市面上绝大多数氢气是灰氢,约占当今全球氢气产量的95%。灰氢主要是通过煤炭、天然气等制备合成气,再分离出氢气,也可以利用合成气(CO,H2)制备C1、C2等化工产品。
已知:“灰氢”制备主要原理如下:
反应1: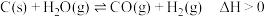
反应2:
(1)已知:①
②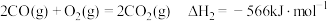
③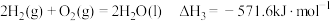
④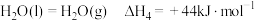
反应2中
_________  。
。
(2)乙醇是一种清洁能源和化工原料。工业上利用合成气合成乙醇: 。
。
①一定温度下,在某恒容密闭容器中充入 和2molH2(g)仅发生上述反应。下列说法正确的是
和2molH2(g)仅发生上述反应。下列说法正确的是________ (填字母)。
A.当混合气体的密度不再随时间变化时达到平衡
B.当混合气体的平均摩尔质量不再随时间变化时达到平衡
C.平衡时 的体积分数小于25%
的体积分数小于25%
D.其他条件不变,增大投料比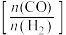 ,CO的平衡转化率增大
,CO的平衡转化率增大
②对于该反应,不同温度对CO的平衡转化率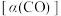 及催化剂的效率影响如图1所示。
及催化剂的效率影响如图1所示。

M点的平衡常数________ (填“大于”“小于”或“等于”)N点的平衡常数;其他条件不变,不加催化剂,则250℃时CO的平衡转化率________ (填“可能”或“不可能”)移至M1点。
(3)T℃时,在VL恒容密闭容器中充入6molCO(g)和8molH2(g),只发生反应: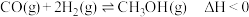 。初始压强为140kPa,测得H2的物质的量与时间的变化关系如图2中状态Ⅰ。图中坐标点A(1,6.5)表示1min时H2的物质的量为6.5mol。
。初始压强为140kPa,测得H2的物质的量与时间的变化关系如图2中状态Ⅰ。图中坐标点A(1,6.5)表示1min时H2的物质的量为6.5mol。
①T℃时,该反应平衡时的总压强为________ ,该反应的压强平衡常数
________  (结果保留两位有效数字,Kp为用分压计算的平衡常数,分压=总压×物质的量分数)。
(结果保留两位有效数字,Kp为用分压计算的平衡常数,分压=总压×物质的量分数)。
②其他条件不变,仅改变某一条件后,测得H2的物质的量随时间的变化关系分别如图2中状态Ⅱ和Ⅲ所示,则状态________ (填“Ⅰ”“Ⅱ”或“Ⅲ”)的平衡常数最小。
已知:“灰氢”制备主要原理如下:
反应1:
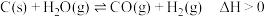
反应2:

(1)已知:①

②
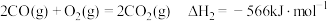
③
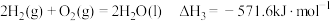
④
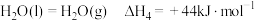
反应2中

 。
。(2)乙醇是一种清洁能源和化工原料。工业上利用合成气合成乙醇:
 。
。①一定温度下,在某恒容密闭容器中充入
 和2molH2(g)仅发生上述反应。下列说法正确的是
和2molH2(g)仅发生上述反应。下列说法正确的是A.当混合气体的密度不再随时间变化时达到平衡
B.当混合气体的平均摩尔质量不再随时间变化时达到平衡
C.平衡时
 的体积分数小于25%
的体积分数小于25%D.其他条件不变,增大投料比
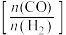 ,CO的平衡转化率增大
,CO的平衡转化率增大②对于该反应,不同温度对CO的平衡转化率
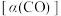 及催化剂的效率影响如图1所示。
及催化剂的效率影响如图1所示。
M点的平衡常数
(3)T℃时,在VL恒容密闭容器中充入6molCO(g)和8molH2(g),只发生反应:
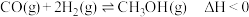 。初始压强为140kPa,测得H2的物质的量与时间的变化关系如图2中状态Ⅰ。图中坐标点A(1,6.5)表示1min时H2的物质的量为6.5mol。
。初始压强为140kPa,测得H2的物质的量与时间的变化关系如图2中状态Ⅰ。图中坐标点A(1,6.5)表示1min时H2的物质的量为6.5mol。①T℃时,该反应平衡时的总压强为

 (结果保留两位有效数字,Kp为用分压计算的平衡常数,分压=总压×物质的量分数)。
(结果保留两位有效数字,Kp为用分压计算的平衡常数,分压=总压×物质的量分数)。②其他条件不变,仅改变某一条件后,测得H2的物质的量随时间的变化关系分别如图2中状态Ⅱ和Ⅲ所示,则状态
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】乙酸是基本的有机化工原料。
I.工业上合成乙酸有多种方法。
(1)目前世界上一半以上的乙酸都采用甲醇与CO反应来制备。反应如下:
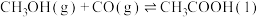
 。在恒压密闭容器中通入0.20mol的
。在恒压密闭容器中通入0.20mol的 和0.20mol的CO气体,测得甲醇的转化率随温度变化如图所示。
和0.20mol的CO气体,测得甲醇的转化率随温度变化如图所示。
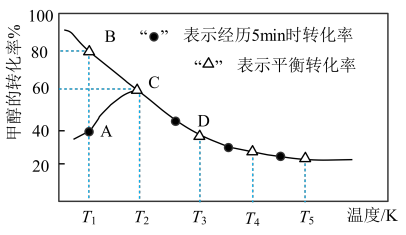
①恒容绝热条件下,不能说明上述反应达到平衡状态的是___________ 。
A.容器内温度不变 B. 的体积分数保持不变
的体积分数保持不变
C. 的物质的量浓度保持不变 D.
的物质的量浓度保持不变 D.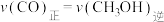
②温度为 时,5min时该反应中
时,5min时该反应中 的反应速率:
的反应速率: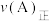
___________ 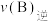 (填“>”,“=”或“<”)。
(填“>”,“=”或“<”)。
③温度为 时,上述反应达到平衡后,若此时保持容器体积、温度不变,再通入0.10mol
时,上述反应达到平衡后,若此时保持容器体积、温度不变,再通入0.10mol 和0.10molCO的混合气体,再次达到平衡,CO的转化率
和0.10molCO的混合气体,再次达到平衡,CO的转化率___________ 80%(填“>”,“=”或“<”)。
Ⅱ.乙酸制氢具有重要意义,制氢过程发生如下反应:
热裂解反应I: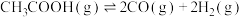
脱羧基反应II: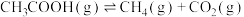
(2)已知反应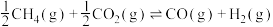
 ,由图所示,
,由图所示,
___________  (用图中有关E的代数式表示)。
(用图中有关E的代数式表示)。
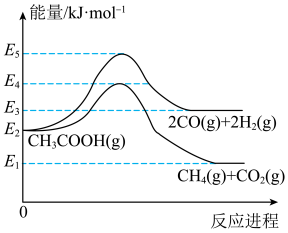
(3)在容积相同的密闭容器中,加入等量乙酸蒸气制氢,在相同时间测得温度与气体产率的关系如图所示。
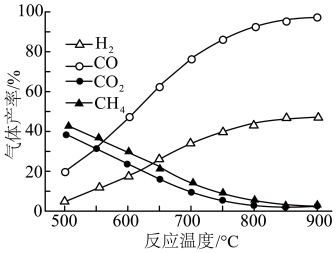
①约650℃之前,氢气产率低于甲烷的原因是___________ 。
②若保持其他条件不变,在乙酸蒸气中掺杂一定量水,氢气的产率显著提高而CO的产率下降,请用化学方程式表示可能发生的反应:___________ 。
(4)在一定温度下,利用合适的催化剂发生热裂解反应I和脱羧基反应Ⅱ,达到平衡时,总压强为p kPa,乙酸体积分数为20%;若热裂解反应消耗的乙酸占总的乙酸的20%,则脱羧基反应Ⅱ的平衡常数 为
为___________ kPa( 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
I.工业上合成乙酸有多种方法。
(1)目前世界上一半以上的乙酸都采用甲醇与CO反应来制备。反应如下:
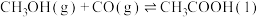
 。在恒压密闭容器中通入0.20mol的
。在恒压密闭容器中通入0.20mol的 和0.20mol的CO气体,测得甲醇的转化率随温度变化如图所示。
和0.20mol的CO气体,测得甲醇的转化率随温度变化如图所示。
①恒容绝热条件下,不能说明上述反应达到平衡状态的是
A.容器内温度不变 B.
 的体积分数保持不变
的体积分数保持不变C.
 的物质的量浓度保持不变 D.
的物质的量浓度保持不变 D.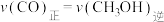
②温度为
 时,5min时该反应中
时,5min时该反应中 的反应速率:
的反应速率: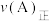
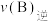 (填“>”,“=”或“<”)。
(填“>”,“=”或“<”)。③温度为
 时,上述反应达到平衡后,若此时保持容器体积、温度不变,再通入0.10mol
时,上述反应达到平衡后,若此时保持容器体积、温度不变,再通入0.10mol 和0.10molCO的混合气体,再次达到平衡,CO的转化率
和0.10molCO的混合气体,再次达到平衡,CO的转化率Ⅱ.乙酸制氢具有重要意义,制氢过程发生如下反应:
热裂解反应I:
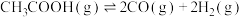
脱羧基反应II:
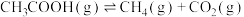
(2)已知反应
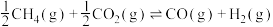
 ,由图所示,
,由图所示,
 (用图中有关E的代数式表示)。
(用图中有关E的代数式表示)。
(3)在容积相同的密闭容器中,加入等量乙酸蒸气制氢,在相同时间测得温度与气体产率的关系如图所示。

①约650℃之前,氢气产率低于甲烷的原因是
②若保持其他条件不变,在乙酸蒸气中掺杂一定量水,氢气的产率显著提高而CO的产率下降,请用化学方程式表示可能发生的反应:
(4)在一定温度下,利用合适的催化剂发生热裂解反应I和脱羧基反应Ⅱ,达到平衡时,总压强为p kPa,乙酸体积分数为20%;若热裂解反应消耗的乙酸占总的乙酸的20%,则脱羧基反应Ⅱ的平衡常数
 为
为 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】利用1—甲基萘(1— )制备四氢萘类物质(
)制备四氢萘类物质( ,包括1—
,包括1— 和5—
和5— )。反应过程中伴有生成十氢茶(1—
)。反应过程中伴有生成十氢茶(1—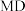 )的副反应,涉及反应如图:
)的副反应,涉及反应如图:

回答下列问题:
(1)已知一定条件下反应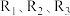 的焓变分别为
的焓变分别为 ,则反应
,则反应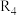 的焓变为
的焓变为_____ (用含 的代数式表示)。
的代数式表示)。
(2)四个平衡体系的平衡常数与温度的关系如图甲所示。
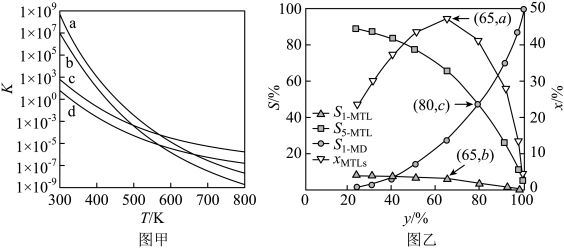
①c、d分别为反应 和
和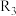 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为_____ 。
②已知反应 的速率方程
的速率方程 (
(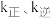 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时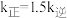 ,温度
,温度 下反应达到平衡时
下反应达到平衡时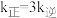 。由此推知,
。由此推知,
_____  。(填“>”,“<”或“=”)。
。(填“>”,“<”或“=”)。
③下列说法错误的是_____ 。
A.四个反应均为放热反应
B.压强越大,温度越低越有利于生成四氢萘类物质
C.反应体系中1—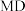 最稳定
最稳定
D.由上述信息可知, 时反应
时反应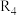 速率最快
速率最快
(3)1— 在
在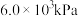 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性 (某生成物i的物质的量与消耗1—
(某生成物i的物质的量与消耗1— 的物质的量之比)和物质的量分数
的物质的量之比)和物质的量分数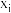 (
(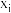 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1—
外其他各物种总物质的量之比)随1— 平衡转化率y的变化关系如图乙所示,1—
平衡转化率y的变化关系如图乙所示,1— 平衡转化率y为80%时,1—
平衡转化率y为80%时,1— 的产率=
的产率=_____ ;y为65%时反应 的平衡常数
的平衡常数
_____  。四氢萘类物质的物质的量分数
。四氢萘类物质的物质的量分数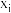 随1—
随1— 平衡转化率先增大后减小,结合平衡移动原理解释原因
平衡转化率先增大后减小,结合平衡移动原理解释原因_____ 。
 )制备四氢萘类物质(
)制备四氢萘类物质( ,包括1—
,包括1— 和5—
和5— )。反应过程中伴有生成十氢茶(1—
)。反应过程中伴有生成十氢茶(1— )的副反应,涉及反应如图:
)的副反应,涉及反应如图:
回答下列问题:
(1)已知一定条件下反应
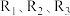 的焓变分别为
的焓变分别为 ,则反应
,则反应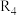 的焓变为
的焓变为 的代数式表示)。
的代数式表示)。(2)四个平衡体系的平衡常数与温度的关系如图甲所示。

①c、d分别为反应
 和
和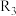 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为②已知反应
 的速率方程
的速率方程 (
(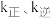 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时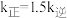 ,温度
,温度 下反应达到平衡时
下反应达到平衡时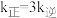 。由此推知,
。由此推知,
 。(填“>”,“<”或“=”)。
。(填“>”,“<”或“=”)。③下列说法错误的是
A.四个反应均为放热反应
B.压强越大,温度越低越有利于生成四氢萘类物质
C.反应体系中1—
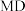 最稳定
最稳定D.由上述信息可知,
 时反应
时反应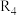 速率最快
速率最快(3)1—
 在
在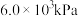 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性 (某生成物i的物质的量与消耗1—
(某生成物i的物质的量与消耗1— 的物质的量之比)和物质的量分数
的物质的量之比)和物质的量分数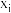 (
(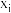 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1—
外其他各物种总物质的量之比)随1— 平衡转化率y的变化关系如图乙所示,1—
平衡转化率y的变化关系如图乙所示,1— 平衡转化率y为80%时,1—
平衡转化率y为80%时,1— 的产率=
的产率= 的平衡常数
的平衡常数
 。四氢萘类物质的物质的量分数
。四氢萘类物质的物质的量分数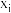 随1—
随1— 平衡转化率先增大后减小,结合平衡移动原理解释原因
平衡转化率先增大后减小,结合平衡移动原理解释原因
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】Ⅰ.汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一、请回答下列问题:
(1)已知:①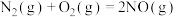
 kJ/mol
kJ/mol
②
 kJ/mol
kJ/mol
③
 kJ/mol
kJ/mol
若某反应的平衡常数表达式为 ,则此反应的热化学方程式为
,则此反应的热化学方程式为_______ 。
Ⅱ.汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入5 mol CO和4 mol NO发生反应,测得平衡时NO的体积分数与温度、压强的关系如图。

(2)已知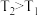 ,则反应
,则反应

___________ 0(填“>”“=”或“<”),理论上该反应在___________ (填“高温”或“低温”)条件下可自发进行。
(3)达到平衡后,为同时提高反应速率和CO的转化率,可采取的措施有______(填字母序号)。
(4)压强为20MPa、温度为 下,若反应进行到10 min达到平衡状态,该温度下用分压表示的平衡常数
下,若反应进行到10 min达到平衡状态,该温度下用分压表示的平衡常数
___________ MPa (用计算式表示)。
(用计算式表示)。
(5)在D点,对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中点A∽G中的___________ 点。
Ⅲ.已知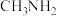 和
和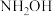 的水溶液中存在如下平衡:
的水溶液中存在如下平衡:
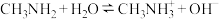

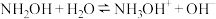

某温度下,10 mL浓度均为0.1 mol⋅L 的两种溶液,分别加水进行稀释,所得曲线如图所示[V表示溶液的体积,
的两种溶液,分别加水进行稀释,所得曲线如图所示[V表示溶液的体积,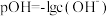 ],回答下列问题:
],回答下列问题:

(6) 水解的离子方程式为
水解的离子方程式为___________ 。
(7)该温度下
___________ 。
(1)已知:①
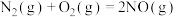
 kJ/mol
kJ/mol②

 kJ/mol
kJ/mol③

 kJ/mol
kJ/mol若某反应的平衡常数表达式为
 ,则此反应的热化学方程式为
,则此反应的热化学方程式为Ⅱ.汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入5 mol CO和4 mol NO发生反应,测得平衡时NO的体积分数与温度、压强的关系如图。

(2)已知
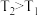 ,则反应
,则反应

(3)达到平衡后,为同时提高反应速率和CO的转化率,可采取的措施有______(填字母序号)。
| A.升高温度 | B.增加CO的浓度 |
| C.缩小容器的体积 | D.改用高效催化剂 |
(4)压强为20MPa、温度为
 下,若反应进行到10 min达到平衡状态,该温度下用分压表示的平衡常数
下,若反应进行到10 min达到平衡状态,该温度下用分压表示的平衡常数
 (用计算式表示)。
(用计算式表示)。(5)在D点,对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中点A∽G中的
Ⅲ.已知
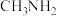 和
和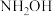 的水溶液中存在如下平衡:
的水溶液中存在如下平衡: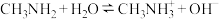

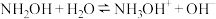

某温度下,10 mL浓度均为0.1 mol⋅L
 的两种溶液,分别加水进行稀释,所得曲线如图所示[V表示溶液的体积,
的两种溶液,分别加水进行稀释,所得曲线如图所示[V表示溶液的体积,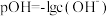 ],回答下列问题:
],回答下列问题:
(6)
 水解的离子方程式为
水解的离子方程式为(7)该温度下

您最近一年使用:0次
【推荐3】我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。甲烷重整是提高甲烷利用率的重要方式。
回答下列问题:
(1)高温下,在1 L密闭容器中通入1 mol甲烷发生如下反应: 。反应在初期阶段的速率方程为
。反应在初期阶段的速率方程为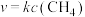 ,其中
,其中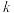 为反应速率常数。
为反应速率常数。
①设反应开始时的反应速率为 ,甲烷的转化率为
,甲烷的转化率为 时的反应速率为
时的反应速率为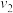 ,则
,则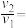
___________ 。
②对于处于初期阶段的该反应,下列说法正确的是___________ (填字母)。
A.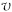 与甲烷浓度成正比
与甲烷浓度成正比
B.压强不变时,反应到达平衡状态
C.乙烷的生成速率逐渐增大
D.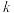 与温度无关
与温度无关
③平衡时,再通入1 mol甲烷,则反应的平衡常数K___________ (填“增大”“减小”或“不变”,下同),甲烷的转化率
___________ 。
(2) —
— 通过催化重整反应转化为合成气(CO和H2),不仅可以达到天然气高效利用目的,还可有效减少温室气体排放。已知:
通过催化重整反应转化为合成气(CO和H2),不仅可以达到天然气高效利用目的,还可有效减少温室气体排放。已知:
水蒸气重整: ①
①
水煤气变换: ②
②
写出 —
— 通过催化重整反应的热化学方程式:
通过催化重整反应的热化学方程式:___________ 。
反应中催化剂活性会因积碳反应而降低,在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为___________ 。

(3)在压强为1 atm的恒压密闭容器中加入l mol CH4(g)和l mol H2O(g),在某温度下只发生水蒸气重整反应,达到平衡时,H2的平衡分压为0.5 atm。此温度下反应的lnKp=___________ (已知:ln3≈1.l,ln4≈1.4)。
(4)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示。若生成的乙烯和乙烷的体积比为1:1,则阳极的电极反应式为___________ 。
回答下列问题:
(1)高温下,在1 L密闭容器中通入1 mol甲烷发生如下反应:
 。反应在初期阶段的速率方程为
。反应在初期阶段的速率方程为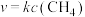 ,其中
,其中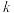 为反应速率常数。
为反应速率常数。①设反应开始时的反应速率为
 ,甲烷的转化率为
,甲烷的转化率为 时的反应速率为
时的反应速率为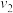 ,则
,则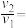
②对于处于初期阶段的该反应,下列说法正确的是
A.
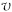 与甲烷浓度成正比
与甲烷浓度成正比B.压强不变时,反应到达平衡状态
C.乙烷的生成速率逐渐增大
D.
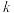 与温度无关
与温度无关③平衡时,再通入1 mol甲烷,则反应的平衡常数K

(2)
 —
— 通过催化重整反应转化为合成气(CO和H2),不仅可以达到天然气高效利用目的,还可有效减少温室气体排放。已知:
通过催化重整反应转化为合成气(CO和H2),不仅可以达到天然气高效利用目的,还可有效减少温室气体排放。已知:水蒸气重整:
 ①
①水煤气变换:
 ②
②写出
 —
— 通过催化重整反应的热化学方程式:
通过催化重整反应的热化学方程式:反应中催化剂活性会因积碳反应而降低,在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为

(3)在压强为1 atm的恒压密闭容器中加入l mol CH4(g)和l mol H2O(g),在某温度下只发生水蒸气重整反应,达到平衡时,H2的平衡分压为0.5 atm。此温度下反应的lnKp=
(4)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示。若生成的乙烯和乙烷的体积比为1:1,则阳极的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】已知25℃时,醋酸、HCN和碳酸的电离平衡常数如下表:
(1)用饱和氨水吸收CO2可得到NH4HCO3溶液。若已知CH3COONH4溶液pH=7,则NH4HCO3溶液显_______ (填“酸性”、“碱性”或“中性”)。
(2)在25℃时,在乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的pH=6,那么混合液中 =
=_______ 。
(3)写出少量CO2通入NaCN溶液的离子方程式:_______ 。
(4)某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=_______ mol/L。
(5)等体积、等浓度NaCN溶液和CH3COONa溶液中离子总数前者_______ 后者(填“>”“<”或“=”)。
(6)若常温下,将bmol·L–1的CH3COONa溶液与0.01mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka=_______ 。
| 物质的化学式 | CH3COOH | HCN | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K=4.9×10-10 | K1=4.3×10-7 | K2=5.6×10-11 |
(2)在25℃时,在乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的pH=6,那么混合液中
 =
=(3)写出少量CO2通入NaCN溶液的离子方程式:
(4)某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=
(5)等体积、等浓度NaCN溶液和CH3COONa溶液中离子总数前者
(6)若常温下,将bmol·L–1的CH3COONa溶液与0.01mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)以CO2与NH3为原料可合成尿素。已知
①2NH3(g)+CO2(g)=NH2COONH4(s) △H=-159.47 kJ·mol-1
②NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.49 kJ·mol-1
③H2O(l)=H2O(g) △H=+88.0 kJ·mol-1
写出NH3和CO2合成尿素和液态水的热化学方程式______________________________ 。
(2)海洋是地球上碳元素的最大吸收池。

①溶于海水中的CO2主要以四种无机碳形式存在,即:CO2、H2CO3、___________ 、___________ 。
②在海洋碳循环中,可通过如图所示的途径固碳。写出钙化作用的离子方程式___________ 。
(3)常温常压下,空气中的CO2溶于水中达到平衡时,其转化关系如下:
①CO2+H2O H2CO3 K=1.8×10-3
H2CO3 K=1.8×10-3
②H2CO3 H++HCO3- Ka1=4.3×10-7,
H++HCO3- Ka1=4.3×10-7,
③HCO3- H++CO32- Ka2=5.6×10-11
H++CO32- Ka2=5.6×10-11
通常情况下,海水的pH约为8,若忽略水的电离及H2CO3的第二级电离,则溶液中c(CO2)=____________________________________________ mol/L。(保留两位有效数字)
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。用1.0mol/L盐酸滴定吸收液,生成的V(CO2)随V(盐酸)变化关系如图1所示,则吸收液中离子浓度由大到小的顺序为__________ ,湖水中无机碳的浓度为___________ mol/L。

图1 图2
(5)用CO2和天然气可以制备CO和H2,CO2(g)+CH4(g) 2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1
2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1___________ p2(填“>”或“<)。若p2=3MPa,则T℃时该反应的平衡常数Kp=___________ MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)以CO2与NH3为原料可合成尿素。已知
①2NH3(g)+CO2(g)=NH2COONH4(s) △H=-159.47 kJ·mol-1
②NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.49 kJ·mol-1
③H2O(l)=H2O(g) △H=+88.0 kJ·mol-1
写出NH3和CO2合成尿素和液态水的热化学方程式
(2)海洋是地球上碳元素的最大吸收池。

①溶于海水中的CO2主要以四种无机碳形式存在,即:CO2、H2CO3、
②在海洋碳循环中,可通过如图所示的途径固碳。写出钙化作用的离子方程式
(3)常温常压下,空气中的CO2溶于水中达到平衡时,其转化关系如下:
①CO2+H2O
 H2CO3 K=1.8×10-3
H2CO3 K=1.8×10-3②H2CO3
 H++HCO3- Ka1=4.3×10-7,
H++HCO3- Ka1=4.3×10-7,③HCO3-
 H++CO32- Ka2=5.6×10-11
H++CO32- Ka2=5.6×10-11通常情况下,海水的pH约为8,若忽略水的电离及H2CO3的第二级电离,则溶液中c(CO2)=
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。用1.0mol/L盐酸滴定吸收液,生成的V(CO2)随V(盐酸)变化关系如图1所示,则吸收液中离子浓度由大到小的顺序为

图1 图2
(5)用CO2和天然气可以制备CO和H2,CO2(g)+CH4(g)
 2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1
2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】I、今有a.醋酸,b.盐酸,c.硫酸三种酸,请用三种酸的序号和“>”“<”或“=”填空。
(1)在同体积,同pH的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是_______________ 。
(2)物质的量浓度均为0.1 mol/L的三种酸溶液的pH由大到小的顺序是_______ ;如果取等体积的0.1 mol/L的三种酸溶液,用0.1 mol/L的NaOH中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是______________ 。
II、用实验确定某酸HB的弱电解质。两同学的方案是:
甲:①称取一定质量的HB配制0.1mol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HB是弱电解质。
乙:①用已知物质的量浓度的HB溶液、盐酸,分别配制pH = 1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HB是弱电解质。
(1)甲方案中,说明HB是弱电解质的理由是测得溶液的pH_____ 1(选填>、<、=)
(2)请你评价乙方案中难以实现之处和不妥之处:______________ 。
III、硼酸(H3BO3)是生产其它硼化物的基本原料。已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液,____________ (填“能”或“不能”)观察到气泡逸出。
已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式_________________________________ 。
(1)在同体积,同pH的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是
(2)物质的量浓度均为0.1 mol/L的三种酸溶液的pH由大到小的顺序是
II、用实验确定某酸HB的弱电解质。两同学的方案是:
甲:①称取一定质量的HB配制0.1mol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HB是弱电解质。
乙:①用已知物质的量浓度的HB溶液、盐酸,分别配制pH = 1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HB是弱电解质。
(1)甲方案中,说明HB是弱电解质的理由是测得溶液的pH
(2)请你评价乙方案中难以实现之处和不妥之处:
III、硼酸(H3BO3)是生产其它硼化物的基本原料。已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液,
已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式
您最近一年使用:0次



