饱和 溶液中,
溶液中,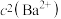 随
随 而变化,在
而变化,在 温度下,
温度下,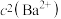 与
与 关系如右图所示。下列说法错误的是
关系如右图所示。下列说法错误的是
 溶液中,
溶液中,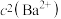 随
随 而变化,在
而变化,在 温度下,
温度下,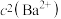 与
与 关系如右图所示。下列说法错误的是
关系如右图所示。下列说法错误的是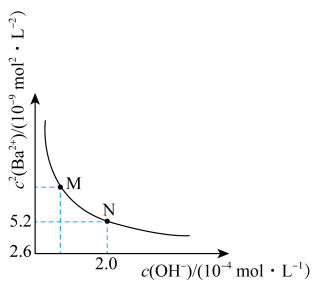
A. 的溶度积 的溶度积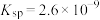 |
B.若忽略 的第二步水解, 的第二步水解,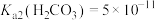 |
C.饱和 溶液中 溶液中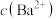 随 随 增大而减小 增大而减小 |
D. 点溶液中: 点溶液中: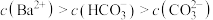 |
2024·河北邯郸·三模 查看更多[2]
更新时间:2024-05-21 19:37:00
|
相似题推荐
单选题
|
较难
(0.4)
解题方法
【推荐1】关于下列溶液的说法中正确的是
| A.在1mol/L NaHA溶液中一定存在:c(Na+)=c(H2A)+c(HA-)+c(A2- ) |
| B.室温下,pH均等于3的醋酸和盐酸溶液等体积混合后,溶液的pH基本不变 |
| C.向CH3COONa溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.相同物质的量浓度的CH3COONa、NaF水溶液,溶液阴阳离子总浓度:CH3COONa>NaF(已知:CH3COOH Ka=1.76×10-5;HF Ka=3.53×10-4) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
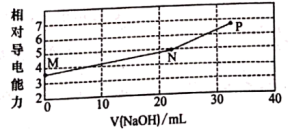
【推荐2】已知:常温下邻苯二甲酸H2A的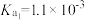 ,
,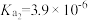 。用NaOH溶液滴定邻苯二甲酸氢钾(KHA)溶液,混合溶液的相对导电能力变化曲线如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列说法正确的是
。用NaOH溶液滴定邻苯二甲酸氢钾(KHA)溶液,混合溶液的相对导电能力变化曲线如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列说法正确的是
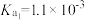 ,
,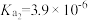 。用NaOH溶液滴定邻苯二甲酸氢钾(KHA)溶液,混合溶液的相对导电能力变化曲线如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列说法正确的是
。用NaOH溶液滴定邻苯二甲酸氢钾(KHA)溶液,混合溶液的相对导电能力变化曲线如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列说法正确的是
A.M点离子浓度: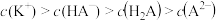 |
B.N点溶液中存在: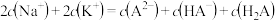 |
C.P点溶液中一定存在: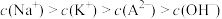 |
| D.从M到P点,水的电离程度逐渐增大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】亚氯酸钠(NaClO2)在溶液中对生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=﹣lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是


| A.HClO2的电离平衡常数的数值Ka=10-8 |
| B.pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH- |
| C.pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-) |
| D.同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下,将1.0 mol·L-1的氨水滴入10 mL1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是


| A.KW的比较:a点>b点 |
| B.水的电离程度:a>b>c>d |
| C.b点时溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| D.c点时溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】室温下向10mL、0.1mol/L的NaOH溶液中加入0.1mol/L的HA溶液,溶液pH的变化曲线如图所示。下列说法正确的是


| A.pH=7时,c(Na+)= c(A-)+c(HA) |
| B.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
| C.b点所示溶液中:c(A-)>c(HA) |
| D.a、b两点所示溶液中水的电离程度相同 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】设NA为阿伏加德罗常数的值,下列说法不正确的是
| A.46 g乙醇中含有的共价键数为8NA |
| B.12.4 g白磷(P4)中所包含的P−P共价键有0.4NA |
| C.标准状况下,2.24 L CH2Cl2含有的分子数大于0.1NA |
| D.常温下,2 L 0.1 mol∙L−1 FeCl3溶液与1 L 0.2 mol∙L−1 FeCl3溶液所含Fe3+数目不同 |
您最近一年使用:0次
单选题
|
较难
(0.4)
真题
解题方法
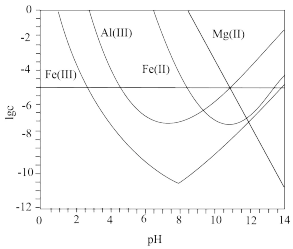
【推荐1】锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有 和
和 杂质离子,可在0~14范围内调节
杂质离子,可在0~14范围内调节 对其净化(即相关离子浓度
对其净化(即相关离子浓度 )。
)。 时,
时, 与
与 关系见下图(碱性过强时
关系见下图(碱性过强时 和
和 会部分溶解)。下列说法正确的是
会部分溶解)。下列说法正确的是
 和
和 杂质离子,可在0~14范围内调节
杂质离子,可在0~14范围内调节 对其净化(即相关离子浓度
对其净化(即相关离子浓度 )。
)。 时,
时, 与
与 关系见下图(碱性过强时
关系见下图(碱性过强时 和
和 会部分溶解)。下列说法正确的是
会部分溶解)。下列说法正确的是
A. 可被净化的 可被净化的 区间最大 区间最大 |
B.加入适量 ,可进一步提升净化程度 ,可进一步提升净化程度 |
C.净化的先后顺序: |
D.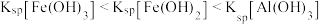 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】室温下,用饱和 溶液浸泡
溶液浸泡 粉末,一段时间后过滤,向滤渣中加入过量盐酸,产生气泡,滤渣仍有剩余。已知
粉末,一段时间后过滤,向滤渣中加入过量盐酸,产生气泡,滤渣仍有剩余。已知 。下列说法正确的是
。下列说法正确的是
 溶液浸泡
溶液浸泡 粉末,一段时间后过滤,向滤渣中加入过量盐酸,产生气泡,滤渣仍有剩余。已知
粉末,一段时间后过滤,向滤渣中加入过量盐酸,产生气泡,滤渣仍有剩余。已知 。下列说法正确的是
。下列说法正确的是| A.沉淀的转化只能按照溶解度由大到小的方向进行 |
B.滤渣中加入盐酸反应的离子方程式为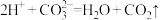 |
C.过滤后所得清液中一定存在: 且 且 |
D.若反应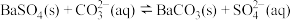 能够正向进行,则需要满足条件: 能够正向进行,则需要满足条件: |
您最近一年使用:0次
【推荐3】25℃时,在Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-1g(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。
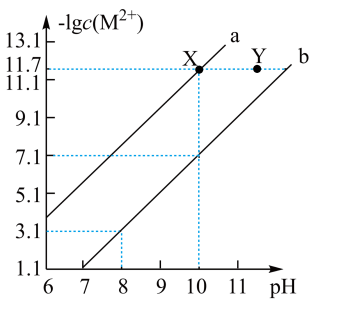
下列说法正确的是 ( )

下列说法正确的是 ( )
| A.向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液 |
| B.b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1(mol/L)3 |
| C.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:c(Fe2+):c(Cu2+)=1:104.6 |
| D.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】利用平衡移动原理,分析一定温度下 在不同pH的
在不同pH的 (起始浓度为
(起始浓度为 )体系中的可能产物。
)体系中的可能产物。
已知:
ⅰ.图1中曲线表示 体系中各含碳粒子的物质的量分数与pH的关系。
体系中各含碳粒子的物质的量分数与pH的关系。
ⅱ.图2表示不同pH下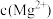 的变化。
的变化。
 在不同pH的
在不同pH的 (起始浓度为
(起始浓度为 )体系中的可能产物。
)体系中的可能产物。已知:
ⅰ.图1中曲线表示
 体系中各含碳粒子的物质的量分数与pH的关系。
体系中各含碳粒子的物质的量分数与pH的关系。ⅱ.图2表示不同pH下
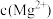 的变化。
的变化。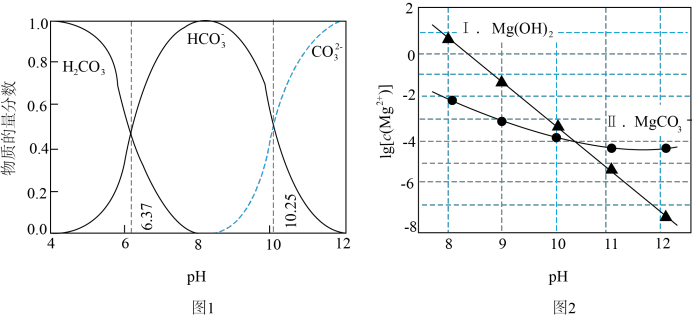
A.由图1,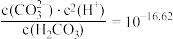 |
B.在 时,一定存在 时,一定存在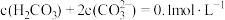 |
C.由图2,初始状态 、 、 ,无沉淀生成 ,无沉淀生成 |
D.由图1和图2,初始状态 、 、 ,主要发生反应: ,主要发生反应: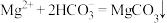  |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】向 溶液中滴加
溶液中滴加 溶液,
溶液, 的百分含量
的百分含量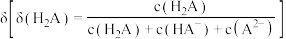 随溶液
随溶液 的变化如图所示:
的变化如图所示:
 溶液中滴加
溶液中滴加 溶液,
溶液, 的百分含量
的百分含量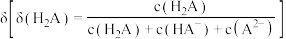 随溶液
随溶液 的变化如图所示:
的变化如图所示:
A. 的数量级为 的数量级为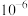 | B.a点对应的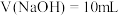 |
C.b点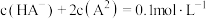 | D.c点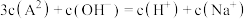 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】烟气脱硫可有效减少 引起的大气污染,同时还可得到有用产品。传统湿法脱硫多以碱性物质作吸收剂,新型脱硫方法选用离子液体(指在室温或接近室温时呈液态的盐类物质,由阴、阳离子组成)作吸收剂,通过物理和化学吸收实现脱硫。已知
引起的大气污染,同时还可得到有用产品。传统湿法脱硫多以碱性物质作吸收剂,新型脱硫方法选用离子液体(指在室温或接近室温时呈液态的盐类物质,由阴、阳离子组成)作吸收剂,通过物理和化学吸收实现脱硫。已知 时,几种酸的电离常数:
时,几种酸的电离常数:
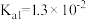 ,
,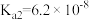 ;
;
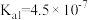 ,
,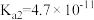 ;
;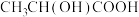 (乳酸)
(乳酸)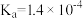 。研究发现:乳酸和乙醇胺(
。研究发现:乳酸和乙醇胺( )作用得到的离子液体——乙醇胺乳酸盐(
)作用得到的离子液体——乙醇胺乳酸盐(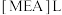 ),既可脱硫,也可吸收CO2。下列说法错误的是
),既可脱硫,也可吸收CO2。下列说法错误的是
 引起的大气污染,同时还可得到有用产品。传统湿法脱硫多以碱性物质作吸收剂,新型脱硫方法选用离子液体(指在室温或接近室温时呈液态的盐类物质,由阴、阳离子组成)作吸收剂,通过物理和化学吸收实现脱硫。已知
引起的大气污染,同时还可得到有用产品。传统湿法脱硫多以碱性物质作吸收剂,新型脱硫方法选用离子液体(指在室温或接近室温时呈液态的盐类物质,由阴、阳离子组成)作吸收剂,通过物理和化学吸收实现脱硫。已知 时,几种酸的电离常数:
时,几种酸的电离常数:
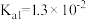 ,
,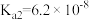 ;
;
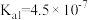 ,
,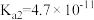 ;
;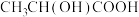 (乳酸)
(乳酸)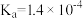 。研究发现:乳酸和乙醇胺(
。研究发现:乳酸和乙醇胺( )作用得到的离子液体——乙醇胺乳酸盐(
)作用得到的离子液体——乙醇胺乳酸盐(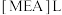 ),既可脱硫,也可吸收CO2。下列说法错误的是
),既可脱硫,也可吸收CO2。下列说法错误的是A.液态时的导电性: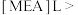 乳酸 乳酸 |
B.乳酸和乙醇胺中均含有 键、 键、 键和氢键 键和氢键 |
C. 是直线形非极性分子, 是直线形非极性分子, 是 是 形极性分子 形极性分子 |
D.相同条件下,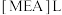 能吸收气体的体积: 能吸收气体的体积: |
您最近一年使用:0次



