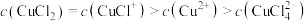常温常压下,H2S气体在水中的饱和浓度约为 ,已知:
,已知: ,
,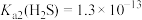 ;
;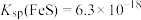 。下列说法
。下列说法不正确 的是
 ,已知:
,已知: ,
,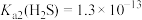 ;
;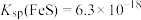 。下列说法
。下列说法A.饱和H2S溶液中存在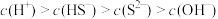 |
B.向 溶液中加几滴浓盐酸,使其浓度达到 溶液中加几滴浓盐酸,使其浓度达到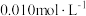 ,此时溶液中 ,此时溶液中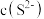 约为 约为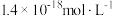 |
C.向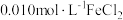 溶液中通入H2S气体直至饱和,溶液中有FeS沉淀生成 溶液中通入H2S气体直至饱和,溶液中有FeS沉淀生成 |
D.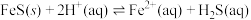 的平衡常数为 的平衡常数为 |
2024·浙江金华·三模 查看更多[2]
更新时间:2024-05-21 19:36:50
|
相似题推荐
单选题
|
较难
(0.4)
名校
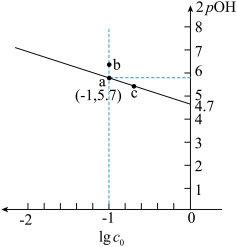
【推荐1】在 溶液中存在水解平衡:
溶液中存在水解平衡: ,水解常数
,水解常数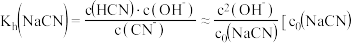 是
是 溶液的起始浓度]。
溶液的起始浓度]。 时,向
时,向 的
的 溶液中不断加水稀释,
溶液中不断加水稀释, 溶液浓度的对数值
溶液浓度的对数值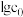 ,与
,与 的关系如图所示,下列说法错误的是
的关系如图所示,下列说法错误的是
 溶液中存在水解平衡:
溶液中存在水解平衡: ,水解常数
,水解常数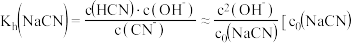 是
是 溶液的起始浓度]。
溶液的起始浓度]。 时,向
时,向 的
的 溶液中不断加水稀释,
溶液中不断加水稀释, 溶液浓度的对数值
溶液浓度的对数值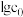 ,与
,与 的关系如图所示,下列说法错误的是
的关系如图所示,下列说法错误的是
A. 时, 时,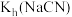 为 为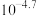 |
| B.升高温度,可使曲线上a点变到b点 |
C. ,向a点对应的溶液中加入固体 ,向a点对应的溶液中加入固体 , , 的水解程度减小 的水解程度减小 |
D.c点对应溶液中的 大于a点 大于a点 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温,下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是
| A.溶质的电离方程式为NaHCO3=Na++H++CO32- |
| B.25℃时加水稀释后,溶液中c(H+)与c(OH-)的乘积变大 |
| C.0.10 mol·L-1NaHCO3溶液pH小于0.10 mol·L-1Na2CO3溶液pH |
| D.0.10 mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
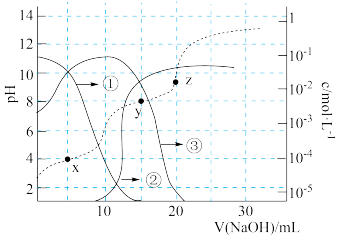
【推荐3】25℃时,用1.00  的NaOH溶液滴定100 mL某二元弱酸
的NaOH溶液滴定100 mL某二元弱酸 ,滴定过程中溶液的pH及
,滴定过程中溶液的pH及 、
、 及
及 的物质的量浓度变化如图所示,下列说法正确的是
的物质的量浓度变化如图所示,下列说法正确的是
 的NaOH溶液滴定100 mL某二元弱酸
的NaOH溶液滴定100 mL某二元弱酸 ,滴定过程中溶液的pH及
,滴定过程中溶液的pH及 、
、 及
及 的物质的量浓度变化如图所示,下列说法正确的是
的物质的量浓度变化如图所示,下列说法正确的是
A. 的 的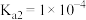 |
B.在Y点时,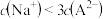 |
C.Z点的溶液中: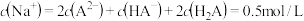 |
D.0.01  NaHA溶液中: NaHA溶液中: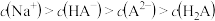 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】 时,用
时,用 溶液分别滴定弱酸
溶液分别滴定弱酸 、
、 、
、 三种溶液,
三种溶液, 随
随 变化关系如图所示,p表示负对数,M表示
变化关系如图所示,p表示负对数,M表示 、
、 、
、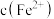 等。已知
等。已知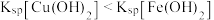 ,下列有关分析错误的是
,下列有关分析错误的是
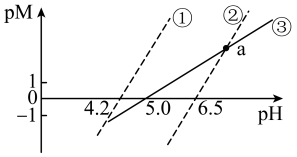
 时,用
时,用 溶液分别滴定弱酸
溶液分别滴定弱酸 、
、 、
、 三种溶液,
三种溶液, 随
随 变化关系如图所示,p表示负对数,M表示
变化关系如图所示,p表示负对数,M表示 、
、 、
、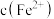 等。已知
等。已知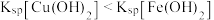 ,下列有关分析错误的是
,下列有关分析错误的是
A.②代表滴定 溶液的变化关系 溶液的变化关系 | B. 时, 时, 沉淀完全 沉淀完全 |
C.滴定 溶液到a点时,溶液 溶液到a点时,溶液 | D.经计算,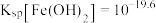 |
您最近一年使用:0次
【推荐2】某火电厂的粉煤灰的主要成分为 、
、 、
、 、
、 、
、 、
、 等。研究小组对其进行综合处理的流程:
等。研究小组对其进行综合处理的流程: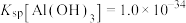 ,
,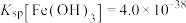 。已知:“酸浸”后钛主要以
。已知:“酸浸”后钛主要以 形式存在,强电解质
形式存在,强电解质 在溶液中仅能电离
在溶液中仅能电离 和一种阳离子,该离子会水解,下列说法正确的是
和一种阳离子,该离子会水解,下列说法正确的是

 、
、 、
、 、
、 、
、 、
、 等。研究小组对其进行综合处理的流程:
等。研究小组对其进行综合处理的流程: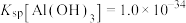 ,
,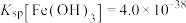 。已知:“酸浸”后钛主要以
。已知:“酸浸”后钛主要以 形式存在,强电解质
形式存在,强电解质 在溶液中仅能电离
在溶液中仅能电离 和一种阳离子,该离子会水解,下列说法正确的是
和一种阳离子,该离子会水解,下列说法正确的是
A.滤渣1为 |
| B.加入铁粉的主要目的是为了消耗过量硫酸 |
C.为使滤渣2沉淀完全,需“调 ”最小为4 ”最小为4 |
D. 溶液制备 溶液制备 过程中需要通入 过程中需要通入 的气流 的气流 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】室温下用0.1mol L﹣1Na2SO3溶液吸收SO2的一种脱硫工艺流程如图所示。已知H2SO3电离平衡常数分别为Ka1=1.0×10﹣2,Ka2=1.0×10﹣7,H2CO3电离平衡常数分别为Ka1=4.0×10﹣7、Ka2=5.0×10﹣11,Ksp(CaCO3)=3×10﹣9,Ksp(CaSO3)=3×10﹣7,忽略通入SO2所引起的溶液体积变化和H2O挥发。
L﹣1Na2SO3溶液吸收SO2的一种脱硫工艺流程如图所示。已知H2SO3电离平衡常数分别为Ka1=1.0×10﹣2,Ka2=1.0×10﹣7,H2CO3电离平衡常数分别为Ka1=4.0×10﹣7、Ka2=5.0×10﹣11,Ksp(CaCO3)=3×10﹣9,Ksp(CaSO3)=3×10﹣7,忽略通入SO2所引起的溶液体积变化和H2O挥发。
 L﹣1Na2SO3溶液吸收SO2的一种脱硫工艺流程如图所示。已知H2SO3电离平衡常数分别为Ka1=1.0×10﹣2,Ka2=1.0×10﹣7,H2CO3电离平衡常数分别为Ka1=4.0×10﹣7、Ka2=5.0×10﹣11,Ksp(CaCO3)=3×10﹣9,Ksp(CaSO3)=3×10﹣7,忽略通入SO2所引起的溶液体积变化和H2O挥发。
L﹣1Na2SO3溶液吸收SO2的一种脱硫工艺流程如图所示。已知H2SO3电离平衡常数分别为Ka1=1.0×10﹣2,Ka2=1.0×10﹣7,H2CO3电离平衡常数分别为Ka1=4.0×10﹣7、Ka2=5.0×10﹣11,Ksp(CaCO3)=3×10﹣9,Ksp(CaSO3)=3×10﹣7,忽略通入SO2所引起的溶液体积变化和H2O挥发。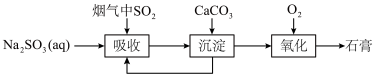
A.0.1mol L﹣1 Na2SO3溶液中:c(OH﹣)=c(H+)+c( L﹣1 Na2SO3溶液中:c(OH﹣)=c(H+)+c( )+c(H2SO3) )+c(H2SO3) |
B.NaHSO3溶液中:c( )<c(H2SO3) )<c(H2SO3) |
C.“沉淀”分离后的滤液中:c(Ca2+) c( c( )<Ksp(CaSO3) )<Ksp(CaSO3) |
D.“沉淀”时发生主要反应的离子方程式:CaCO3+ =CaSO3+ =CaSO3+ |
您最近一年使用:0次
单选题
|
较难
(0.4)
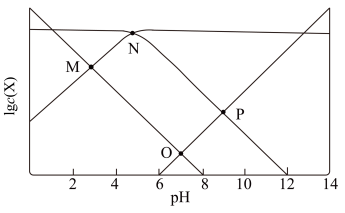
【推荐2】 时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1mol/L,
时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1mol/L, 、
、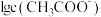 、
、 和
和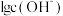 随
随 变化的关系如图所示。
变化的关系如图所示。 为
为 的电离常数,下列说法正确的是
的电离常数,下列说法正确的是
 时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1mol/L,
时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1mol/L, 、
、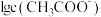 、
、 和
和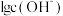 随
随 变化的关系如图所示。
变化的关系如图所示。 为
为 的电离常数,下列说法正确的是
的电离常数,下列说法正确的是
A.O点时, |
B.N点时, |
C.该体系中,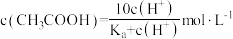 |
D. 由7到14的变化过程中, 由7到14的变化过程中, 的水解程度始终增大 的水解程度始终增大 |
您最近一年使用:0次

 、
、 、
、 、
、 等)为原料,制备超细
等)为原料,制备超细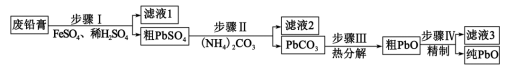
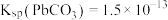 ,
,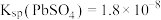 。②
。②

 沉淀中混有
沉淀中混有
 用碱溶解,然后趁热过滤、洗涤、干燥
用碱溶解,然后趁热过滤、洗涤、干燥 溶液中存在
溶液中存在 、
、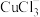 、
、 几种含铜微粒,向
几种含铜微粒,向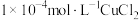 溶液中通入HCl气体,含Cu微粒的分布系数[例如:
溶液中通入HCl气体,含Cu微粒的分布系数[例如: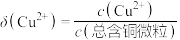 ]随
]随 浓度变化的关系如图所示。
浓度变化的关系如图所示。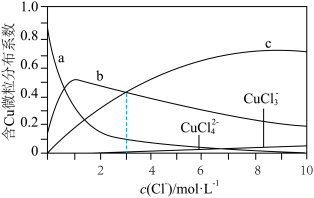
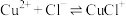




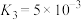
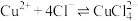
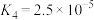
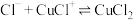 的平衡常数
的平衡常数
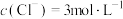 时,
时,