肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)已知:N2(g)+2O2(g)=2NO2(g) △H= +67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H= -1135.7kJ/mol
则肼完全燃烧的热化学方程式为________________________________ 。
(2)肼——空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。该电池放电时,正极的电极反应式是____________________ ,电池工作一段时间后,电解质溶液的pH将___________ (填“增大”、“减小”、“不变”)。
(3)下图是一个电化学装置示意图,用肼—空气燃料电池做此装置的电源。
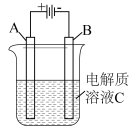
①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4。该装置的实际意义是__________ 。
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,若B极增重10.8g,该燃料电池理论上消耗____ mol N2H4。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因_______________ 。
(5)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)____ 0.1mol/L HCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”)。
(6)已知:在相同条件下N2H4·H2O的电离程度大于N2H5Cl的水解程度。常温下,若将0.2mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H 、Cl-、OH-、H+离子浓度由大到小的顺序为
、Cl-、OH-、H+离子浓度由大到小的顺序为_______________________________ 。
(1)已知:N2(g)+2O2(g)=2NO2(g) △H= +67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H= -1135.7kJ/mol
则肼完全燃烧的热化学方程式为
(2)肼——空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。该电池放电时,正极的电极反应式是
(3)下图是一个电化学装置示意图,用肼—空气燃料电池做此装置的电源。

①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4。该装置的实际意义是
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,若B极增重10.8g,该燃料电池理论上消耗
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因
(5)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)
(6)已知:在相同条件下N2H4·H2O的电离程度大于N2H5Cl的水解程度。常温下,若将0.2mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H
 、Cl-、OH-、H+离子浓度由大到小的顺序为
、Cl-、OH-、H+离子浓度由大到小的顺序为
10-11高三上·辽宁丹东·阶段练习 查看更多[1]
(已下线)2010年辽宁省丹东市四校协作体高三上学期第一次联合考试(理综)化学
更新时间:2016-12-09 00:53:38
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。升高温度,绝大多数的化学反应速率增大,但是2NO(g)+O2(g) 2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
I.2NO(g) N2O2(g)(快) ΔH1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) ΔH1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
Ⅱ.N2O2(g)+O2(g) 2NO2(g)(慢) ΔH2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) ΔH2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
请回答下列问题:
(1)反应2NO(g)+O2(g) 2NO2(g)的ΔH =
2NO2(g)的ΔH =___________ (用含ΔH1和ΔH2的式子表示)
(2)一定温度下,恒容的密闭容器中,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_________________ ,升高温度,K值___________ (填“增大”“减小”或“不变”)
(3)下列描述中能说明上述反应已达平衡的是__________ ;
A.容器内气体的平均摩尔质量保持不变
B.2v(NO)正=v(O2)逆
C.容器中气体的密度保持不变
D.单位时间内生成nmolO2的同时生成2nmolNO2
 2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:I.2NO(g)
 N2O2(g)(快) ΔH1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) ΔH1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)Ⅱ.N2O2(g)+O2(g)
 2NO2(g)(慢) ΔH2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) ΔH2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)请回答下列问题:
(1)反应2NO(g)+O2(g)
 2NO2(g)的ΔH =
2NO2(g)的ΔH =(2)一定温度下,恒容的密闭容器中,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=(3)下列描述中能说明上述反应已达平衡的是
A.容器内气体的平均摩尔质量保持不变
B.2v(NO)正=v(O2)逆
C.容器中气体的密度保持不变
D.单位时间内生成nmolO2的同时生成2nmolNO2
您最近一年使用:0次
【推荐2】环氧乙烷( )、环氧丙烷(
)、环氧丙烷(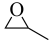 )都是重要的化工原料且用途广泛。回答下列问题:
)都是重要的化工原料且用途广泛。回答下列问题:
(1)已知:
①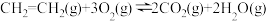

②2
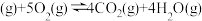
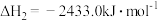
③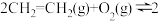


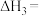
_____ 
(2)某温度下,物质的量均为1mol的CH2=CH2和O2在0.5L的刚性容器内发生反应③,5min后反应达到平衡,气体总压减少了20%。
①平衡时CH2=CH2(g)的转化率为____ ,达到平衡后,欲增加CH2=CH2(g)的平衡转化率,可采取的措施是____ (填一条措施即可)。
②0~5min内,环氧乙烷的生成速率为____ 。
③该反应的平衡常数K_____ (精确到0.01)。
④当进料气CH2=CH2和O2的物质的量不变时,T1℃时达到反应平衡,请在图1中画出温度由T1℃变化到T2℃的过程中乙烯的转化率与温度的关系____ 。
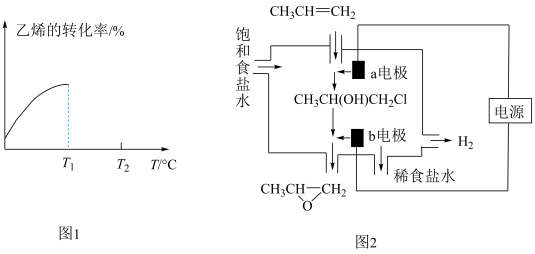
(3)将丙烯与饱和食盐水的电解产物反应,转化为氯丙醇[CH3CH(OH)CH2Cl][已知:CH3CH=CH2+H2O+Cl2→CH3CH(OH)CH2Cl+HCl],氯丙醇进一步反应生成环氧丙烷,其电解简易装置如图2所示。
①a电极上的电极反应式为______ 。
②b电极区域生成环氧丙烷的化学方程式为______ 。
 )、环氧丙烷(
)、环氧丙烷( )都是重要的化工原料且用途广泛。回答下列问题:
)都是重要的化工原料且用途广泛。回答下列问题:(1)已知:
①
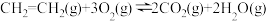

②2

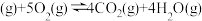
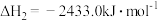
③
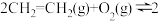


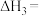

(2)某温度下,物质的量均为1mol的CH2=CH2和O2在0.5L的刚性容器内发生反应③,5min后反应达到平衡,气体总压减少了20%。
①平衡时CH2=CH2(g)的转化率为
②0~5min内,环氧乙烷的生成速率为
③该反应的平衡常数K
④当进料气CH2=CH2和O2的物质的量不变时,T1℃时达到反应平衡,请在图1中画出温度由T1℃变化到T2℃的过程中乙烯的转化率与温度的关系

(3)将丙烯与饱和食盐水的电解产物反应,转化为氯丙醇[CH3CH(OH)CH2Cl][已知:CH3CH=CH2+H2O+Cl2→CH3CH(OH)CH2Cl+HCl],氯丙醇进一步反应生成环氧丙烷,其电解简易装置如图2所示。
①a电极上的电极反应式为
②b电极区域生成环氧丙烷的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】CO和NO2是汽车尾气的主要污染物.汽车尾气的反应式之一为:2NO(g)+2CO(g)═N2(g)+2CO2(g).请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
2C(s)+O2═2CO(g)△H=﹣221kJ/mol
则2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=______ .
(2)一定温度下,在一体积为VL的密闭容器中充入一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=a mol、n(NO)=2a mol、n(N2)=b mol,且N2占平衡混合气体总价体积的1/4.
①该反应的平衡常数K=______ (用只含a、V的式子表示)
②判断该反应达到平衡的标志是______ (填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(3)在一定温度下,将2.0mol NO、2.4mol CO通入固定容积2L的密闭容器中,反应过程中部分物质的物质的量变化如图一所示,
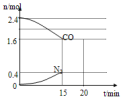
则①有害气体NO的转化率是______ ,0~15min CO2的平均反应速率v(CO2)=______ ②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是______ (填序号)
A.增加CO2的量 B.加入催化剂 C.降低温度 D.扩大容积体积
(4)通过NOX传感器可监测NOX的含量,其工作原理如图二所示,
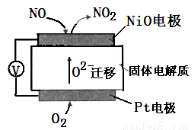
则①Pt电极上发生的是______ 反应(填“氧化”或“还原”)②NiO电极上的电极反应式为______ .
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
2C(s)+O2═2CO(g)△H=﹣221kJ/mol
则2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=
(2)一定温度下,在一体积为VL的密闭容器中充入一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=a mol、n(NO)=2a mol、n(N2)=b mol,且N2占平衡混合气体总价体积的1/4.
①该反应的平衡常数K=
②判断该反应达到平衡的标志是
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(3)在一定温度下,将2.0mol NO、2.4mol CO通入固定容积2L的密闭容器中,反应过程中部分物质的物质的量变化如图一所示,

则①有害气体NO的转化率是
A.增加CO2的量 B.加入催化剂 C.降低温度 D.扩大容积体积
(4)通过NOX传感器可监测NOX的含量,其工作原理如图二所示,

则①Pt电极上发生的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】硫化氢(H2S)、二氧化硫(SO2)是有害气体,可用多种方法进行脱除。
(1)实验室制取乙炔时,用硫酸铜溶液除去乙炔气体中混有的H2S气体,发生反应:H2S(aq)+Cu2+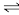 CuS(s)+2H+(aq),计算25℃时,该反应的平衡常数为
CuS(s)+2H+(aq),计算25℃时,该反应的平衡常数为___________ 。 (已知25℃时Ksp (CuS) =1.25×10−36,Ka1 (H2S) =10−7,Ka2 (H2S ) =10−12)
(2)通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应: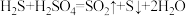 、
、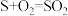 。
。
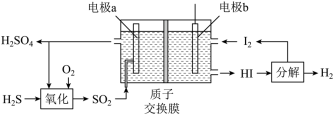
①电极a上发生反应的电极反应式为___________ 。
②理论上1 mol H2S参加反应可产生H2的物质的量为___________ 。
(3)硫酸工业的尾气中含SO2等污染性气体,通常用碱液如氨水进行吸收处理,实现绿色环保和废物利用。研究发现,Na2SO3溶液也可以用来处理废气中的SO2,发生反应Na2SO3+H2O+SO2=2NaHSO3。
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
①相同物质的量浓度的三种酸溶液HClO、H2CO3和H2SO3由水电离的c(H+)最大的是______ (填化学式)
②将浓度均为0.1 mol·L-1的NaHSO3和Na2SO3等体积混合,溶液pH=7.2,分析该溶液中c(HSO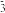 )
) _______ c(SO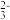 ) (填“>”,“>”或“=”)。
) (填“>”,“>”或“=”)。
③SO2也可用石灰乳吸收,得到的CaSO3浆料可用于制备NaHSO3溶液。写出用CaSO3浆料制备NaHSO3溶液实验方案:____ 。
已知:室温下,溶液中H2SO3、HSO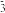 、SO
、SO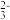 的物质的量分数随pH的分布如下图所示。
的物质的量分数随pH的分布如下图所示。
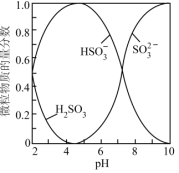
实验中可选用的试剂:
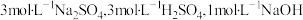
(1)实验室制取乙炔时,用硫酸铜溶液除去乙炔气体中混有的H2S气体,发生反应:H2S(aq)+Cu2+
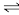 CuS(s)+2H+(aq),计算25℃时,该反应的平衡常数为
CuS(s)+2H+(aq),计算25℃时,该反应的平衡常数为(2)通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应:
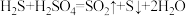 、
、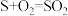 。
。
①电极a上发生反应的电极反应式为
②理论上1 mol H2S参加反应可产生H2的物质的量为
(3)硫酸工业的尾气中含SO2等污染性气体,通常用碱液如氨水进行吸收处理,实现绿色环保和废物利用。研究发现,Na2SO3溶液也可以用来处理废气中的SO2,发生反应Na2SO3+H2O+SO2=2NaHSO3。
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
| 弱酸 | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=4.0×10−8 | Ka1=4.3×10−7,Ka2=4.7×10−11 | Ka1=1.5×10−3,Ka2=6×10−8 |
①相同物质的量浓度的三种酸溶液HClO、H2CO3和H2SO3由水电离的c(H+)最大的是
②将浓度均为0.1 mol·L-1的NaHSO3和Na2SO3等体积混合,溶液pH=7.2,分析该溶液中c(HSO
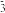 )
) 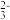 ) (填“>”,“>”或“=”)。
) (填“>”,“>”或“=”)。③SO2也可用石灰乳吸收,得到的CaSO3浆料可用于制备NaHSO3溶液。写出用CaSO3浆料制备NaHSO3溶液实验方案:
已知:室温下,溶液中H2SO3、HSO
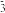 、SO
、SO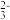 的物质的量分数随pH的分布如下图所示。
的物质的量分数随pH的分布如下图所示。
实验中可选用的试剂:
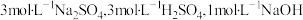
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】请回答下列问题:
(1)25℃时,pH=5的CH3COOH溶液中.加入少量NaOH固体,则溶液中
_______ (填“增大”、“减小”或“不变”)。
(2)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
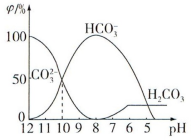
①在同一溶液中H2CO3、HCO3-、CO32-______ (填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________ 。溶液中各种离子的物质的量浓度大小关系为___________________________ 。
③反应的CO32-+H2O HCO3-+OH-的平衡常数Kh值为
HCO3-+OH-的平衡常数Kh值为_________ 。
(3)生物脱H2S的原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O。
2Fe2(SO4)3+2H2O。
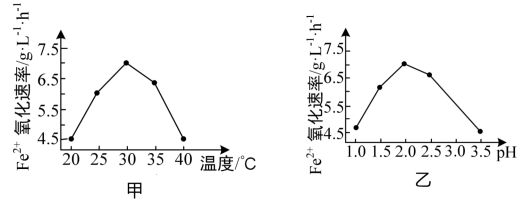
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是___________ 。
②由图甲和图乙判断使用硫杆菌的最佳条件为____________ 。在最佳条件下,该反应的加热
方式为_________ 。
(1)25℃时,pH=5的CH3COOH溶液中.加入少量NaOH固体,则溶液中

(2)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。

①在同一溶液中H2CO3、HCO3-、CO32-
②当pH =7时,溶液中含碳元素的微粒主要为
③反应的CO32-+H2O
 HCO3-+OH-的平衡常数Kh值为
HCO3-+OH-的平衡常数Kh值为(3)生物脱H2S的原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4
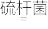 2Fe2(SO4)3+2H2O。
2Fe2(SO4)3+2H2O。
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是
②由图甲和图乙判断使用硫杆菌的最佳条件为
方式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】(1) 2010年10月1日下午18时59分57秒,中国探月二期工程先导星“嫦娥二号”在西昌点火升空,准确入轨。“嫦娥二号”所用燃料为液氢和液氧。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
H2(g)=H2(l) △H=-0.92kJ·mol-1 ;
O2(g)=O2(l) △H=-6.84kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式_______ ;
(2)美国的探月飞船“阿波罗号”使用的氢氧燃料电池,电解液为氢氧化钾溶液,其负极反应式为_______ ;
(3)设计方案实现2HCl+2Cu= CuCl2+H2↑反应,画出装置图_______ ;
(4)pH相同的四种电解质溶液:①Na2CO3 ②NaHCO3 ③CH3COONa ④ NaOH,
其物质的量浓度由大到小的顺序是(填编号)_______ 。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
H2(g)=H2(l) △H=-0.92kJ·mol-1 ;
O2(g)=O2(l) △H=-6.84kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式
(2)美国的探月飞船“阿波罗号”使用的氢氧燃料电池,电解液为氢氧化钾溶液,其负极反应式为
(3)设计方案实现2HCl+2Cu= CuCl2+H2↑反应,画出装置图
(4)pH相同的四种电解质溶液:①Na2CO3 ②NaHCO3 ③CH3COONa ④ NaOH,
其物质的量浓度由大到小的顺序是(填编号)
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】1869年,俄国化学家门捷列夫制作了第一张元素周期表,下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。(用元素符号填空)

(1)写出元素F在周期表中的位置___________ 。
(2)写出工业制取单质C的化学方程式___________ 。
(3)G﹑H﹑B三种元素简单离子的半径由小到大排序___________ 。
(4)元素B和D的最高价氧化物对应的水化物相互反应的离子方程式为:___________ 。
(5)用电子式表示化合物A2G的形成过程的过程:___________ ,该化合物的水溶液呈___________ (填“酸”、“碱”或“中”)性,原因___________ (用离子方程式说明)
(6)元素F、G形成的简单氢化物中,熔沸点更高的是___________ ,原因是___________ 。
(7)E的简单氢化物构成燃料电池,采用铂作电极材料,稀硫酸作电解质溶液,写出负极的电极反应式___________ 。

(1)写出元素F在周期表中的位置
(2)写出工业制取单质C的化学方程式
(3)G﹑H﹑B三种元素简单离子的半径由小到大排序
(4)元素B和D的最高价氧化物对应的水化物相互反应的离子方程式为:
(5)用电子式表示化合物A2G的形成过程的过程:
(6)元素F、G形成的简单氢化物中,熔沸点更高的是
(7)E的简单氢化物构成燃料电池,采用铂作电极材料,稀硫酸作电解质溶液,写出负极的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】制取乙二醇的过程如图:

完成下列填空:
(1)草酸二甲酯“催化还原”制乙二醇,此反应的平衡常数表达式为K= 。请书写此反应的化学方程式
。请书写此反应的化学方程式___ 。
将不同量的CO(g)和H2O(g)分别通入体积为3L的恒容密闭容器中,可以发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到三组数据(见下表)。
CO2(g)+H2(g),得到三组数据(见下表)。
(2)实验1达平衡时,CO(g)的浓度为___ mol/L。
(3)实验3跟实验2相比,改变的条件是___ 。
(4)下列描述中能说明上述反应已达平衡的是___ 。
a.v正(CO)=v逆(H2)
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中CO的转化率不再发生变化
草酸二甲酯的水解产物草酸(H2C2O4)为二元弱酸。常温下,向10mL0.1mol/L H2C2O4溶液中逐滴加入0.1mol/L溶液,所得滴定曲线如图所示。
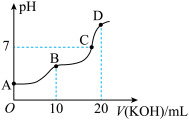
(5)B点对应的溶液中存在KOH的平衡有:H2O H++OH-、
H++OH-、___ 和___ 。
(6)由图可分析得出等物质的量浓度的草酸钾和草酸氢钾混合溶液显___ (填“酸性”、“中性”、“碱性”)。

完成下列填空:
(1)草酸二甲酯“催化还原”制乙二醇,此反应的平衡常数表达式为K=
 。请书写此反应的化学方程式
。请书写此反应的化学方程式将不同量的CO(g)和H2O(g)分别通入体积为3L的恒容密闭容器中,可以发生如下反应:CO(g)+H2O(g)
 CO2(g)+H2(g),得到三组数据(见下表)。
CO2(g)+H2(g),得到三组数据(见下表)。实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
H2O | CO | CO2 | |||
1 | 650 | 2 | 4 | 1.6 | 5 |
2 | 900 | 1 | 2 | 0.4 | 3 |
3 | 900 | 1 | 2 | 0.4 | 1 |
(3)实验3跟实验2相比,改变的条件是
(4)下列描述中能说明上述反应已达平衡的是
a.v正(CO)=v逆(H2)
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中CO的转化率不再发生变化
草酸二甲酯的水解产物草酸(H2C2O4)为二元弱酸。常温下,向10mL0.1mol/L H2C2O4溶液中逐滴加入0.1mol/L溶液,所得滴定曲线如图所示。

(5)B点对应的溶液中存在KOH的平衡有:H2O
 H++OH-、
H++OH-、(6)由图可分析得出等物质的量浓度的草酸钾和草酸氢钾混合溶液显
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】现有前20号的A、B、C、D、E五种元素,相关信息于下表:
(1)B的核外电子排布式为________ ,CB3的晶体类型为________ 。
(2)B、C、D三元素的电负性大小顺序为__________________________ (填元素符号)。
(3)C的氢化物的空间构型为________ ,其氢化物在同族元素所形成的氢化物中沸点最高的原因是______________________________________________________ 。
(4)E2D的水溶液呈_____ (填“酸性”、“碱性”或“中性”),用离子方程式解释理由:_______________________ 。
(5)已知:12.8 g液态C2 A4与足量A2O2反应生成C2和气态A2O,放出256.65 kJ的热量。
A2O (l)=== A2O (g) ΔH=+44 kJ·mol-1。
2 A2O2(l)===2A2O (l)+O2(g) ΔH=-196.4 kJ·mol-1。
则液态C2 A4与足量O2反应生成C2和液态A2O的热化学方程式为:________________________________________________ 。
| 元素 | 信息 |
| A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | B原子得一个电子后2p轨道全满 |
| C | C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大 |
| D | D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于其中子数 |
| E | E+和B-具有相同的电子层结构 |
(1)B的核外电子排布式为
(2)B、C、D三元素的电负性大小顺序为
(3)C的氢化物的空间构型为
(4)E2D的水溶液呈
(5)已知:12.8 g液态C2 A4与足量A2O2反应生成C2和气态A2O,放出256.65 kJ的热量。
A2O (l)=== A2O (g) ΔH=+44 kJ·mol-1。
2 A2O2(l)===2A2O (l)+O2(g) ΔH=-196.4 kJ·mol-1。
则液态C2 A4与足量O2反应生成C2和液态A2O的热化学方程式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】电池是人类生产和生活中重要的能量来源,电池的发明是化学对人类的一项重大贡献。
(1)依据NaOH与HCl的反应原理设计原电池,你认为是否可行?___ (填“是”或“否”),理由是___ 。
(2)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为___ ,正极反应式为___ 。
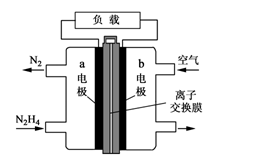
(3)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2↑。请回答下列问题:
①电池的负极材料为___ 。
②电池正极发生的电极反应为___ 。
③SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是___ ,反应的化学方程式为___ 。
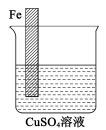
(4)计一个实验方案,使如图装置中的铁棒上析出铜,而铁不溶解___ (请作图表示)。
(1)依据NaOH与HCl的反应原理设计原电池,你认为是否可行?
(2)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为

(3)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2↑。请回答下列问题:
①电池的负极材料为
②电池正极发生的电极反应为
③SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是
(4)计一个实验方案,使如图装置中的铁棒上析出铜,而铁不溶解

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】NO2和N2O4之间发生反应:N2O4⇌2NO2,一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
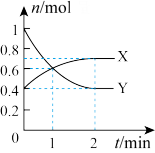
(1)曲线_______ (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。在0到2min中内用X表示该反应的速率是_______ ,
(2)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中 v(NO2)=0.5 mol·L-1·min-1,乙中v(N2O4)=0.2mol·L-1·min-1,则_______ 中反应更快。
(3)下列描述能表示反应达平衡状态的是_______ 。
A.容器中X与Y的物质的量相等
B.容器内气体的颜色不再改变
C.2v(X)=v(Y)
D.容器内气体的平均相对分子质量不再改变
E.容器内气体的密度不再发生变化
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅱ电极上生成氧化物Y(N2O5),则石墨I电极是_______ (填“正极”或“负极”),当有1molN2O5生成时,电路中转移电子的物质的量为_______ mol


(1)曲线
(2)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中 v(NO2)=0.5 mol·L-1·min-1,乙中v(N2O4)=0.2mol·L-1·min-1,则
(3)下列描述能表示反应达平衡状态的是
A.容器中X与Y的物质的量相等
B.容器内气体的颜色不再改变
C.2v(X)=v(Y)
D.容器内气体的平均相对分子质量不再改变
E.容器内气体的密度不再发生变化
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅱ电极上生成氧化物Y(N2O5),则石墨I电极是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
真题
解题方法
【推荐3】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)= CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ·mol-1
CH3CH=CH2(g)= CH4(g)+HC≡CH(g)△H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)= CH3CH=CH2(g)+H2(g)的△H=_____ kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为___________ ;放电时,CO32-移向电池的_______ (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1=_____________ 。(已知:10-5.60=2.5×10-6)
(4)常温下,0.1mol/L的NaHCO3溶液的pH大于8,则溶液c(H2CO3)______ c(CO32-)(填“>”、“=”或“<”),原因是_______________________ (用离子方程式和必要的文字说明)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)= CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ·mol-1
CH3CH=CH2(g)= CH4(g)+HC≡CH(g)△H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)= CH3CH=CH2(g)+H2(g)的△H=
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3
 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1=(4)常温下,0.1mol/L的NaHCO3溶液的pH大于8,则溶液c(H2CO3)
您最近一年使用:0次



