元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、 [Cu(NH3)4]2+(深蓝色)等形式存在。CuCl为难溶于水的白色固体。回答下列问题:
(1)在浓的强碱溶液中,Cu2+与Al3+的化学性质相似。在少量的CuSO4溶液中,逐渐加入浓的NaOH溶液直至过量,可观察到的现象是_____________________ 。
(2)CuCl溶于浓盐酸时发生的反应为CuCl+HCl H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是
H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是___________________ 。在热的CuCl2溶液中加入铜粉,可制得CuCl,其反应的离子方程式为___________________ ,但实际上该反应较难持续进行,其原因是____________________ ,使反应彻底进行的操作是___________________ 。
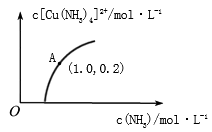
(3)[Cu(H2O)4]2+和[Cu(NH3)4]2+在溶液中可以相互转化。:t℃时,初始浓度为1mol•L-1的CuSO4溶液中{ Cu2+实际以[Cu(H2O)4]2+的形式存在},[Cu(NH3)4]2+的浓度随氨水浓度[c(NH3)]的变化如图所示
①CuSO4溶液与过量氨水发生反应的总的离子方程式为________________ 。
②由图可知,溶液的酸性增大,[Cu(H2O)4]2+ 转化为[Cu(NH3)4]2+的平衡转化率___________ (填“增大”“减小”或“不变”)。根据A点数据,计算出该温度下的平衡常数K=__________ 。
③升高温度,溶液中[Cu(H2O)4]2+的平衡转化率减小,则该反应的ΔH_____ (填“>”“<”或“=”)0
④硫酸四氯合铜{[Cu(NH3)4]SO4}在碱性镀铜工艺中常用作电镀液的主要成分,电镀时,要控制局部温度不得高于150℃,可能的原因是_______________ 。电解时。阴极的电极反应式为___________________ 。
(1)在浓的强碱溶液中,Cu2+与Al3+的化学性质相似。在少量的CuSO4溶液中,逐渐加入浓的NaOH溶液直至过量,可观察到的现象是
(2)CuCl溶于浓盐酸时发生的反应为CuCl+HCl
 H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是
H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是(3)[Cu(H2O)4]2+和[Cu(NH3)4]2+在溶液中可以相互转化。:t℃时,初始浓度为1mol•L-1的CuSO4溶液中{ Cu2+实际以[Cu(H2O)4]2+的形式存在},[Cu(NH3)4]2+的浓度随氨水浓度[c(NH3)]的变化如图所示
①CuSO4溶液与过量氨水发生反应的总的离子方程式为
②由图可知,溶液的酸性增大,[Cu(H2O)4]2+ 转化为[Cu(NH3)4]2+的平衡转化率
③升高温度,溶液中[Cu(H2O)4]2+的平衡转化率减小,则该反应的ΔH
④硫酸四氯合铜{[Cu(NH3)4]SO4}在碱性镀铜工艺中常用作电镀液的主要成分,电镀时,要控制局部温度不得高于150℃,可能的原因是
更新时间:2017-03-07 13:37:21
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】据2021年最新统计,中国机动车保有量达到3.8亿辆,稳居世界第一。
Ⅰ.不断改进汽车尾气净化技术是减轻大气污染的重要举措。其中一种“净化反应”的原理为:2CO(g)+2NO(g) 2CO2(g)+N2(g) △H。
2CO2(g)+N2(g) △H。
(1)已知N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
C(g)+O2(g)=CO2(g) △H2=—393.5kJ·mol-1
2C(g)+O2(g)=2CO(g) △H3=—221kJ·mol-1
净化反应的△H=____ kJ·mol-1。
(2)下列可判断净化反应达到平衡的是____ 。
(3)净化反应净速率v=v正—v逆=k正p2(CO)·p2(NO)—k逆p2(CO2)·p(N2),其中k正、k逆分别为正、逆反应的速率常数,p为气体的分压(分压=总压×物质的量分数)。
①升高温度,k正—k逆____ (填“增大”、“减小”或“不变”)。
②按照n(CO)∶n(NO)=1∶1投料反应,在不同压强下,净化反应中CO的平衡转化率随反应温度的变化如图1所示。当压强为p1、温度为t1℃时,某时刻测得N2的体积分数为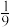 ,此时
,此时 =
=___ 。

(4)Ⅱ.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) △H<0。其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图2。
4N2(g)+6H2O(g) △H<0。其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图2。

①工业上选择催化剂乙的原因是____ 。
②在催化剂甲作用下,图中M点对应温度为210℃。210℃之前,NO转化率随温度升高而增大的原因是_____ ;210℃之后,NO转化率降低的原因可能是____ 。
(5)Ⅲ.比亚迪双模电动车不依赖专业充电站,采用了镍镉可充电电池。其总反应为:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2。当电动车车行驶30min,电池的平均电流强度为aA,正极质量增加
Cd(OH)2+2Ni(OH)2。当电动车车行驶30min,电池的平均电流强度为aA,正极质量增加___ g(用含a和F的字母表示计算结果)。[已知:①Q=It,Q的单位为C;②法拉第常数为F,单位为C·mol-1]。
Ⅰ.不断改进汽车尾气净化技术是减轻大气污染的重要举措。其中一种“净化反应”的原理为:2CO(g)+2NO(g)
 2CO2(g)+N2(g) △H。
2CO2(g)+N2(g) △H。(1)已知N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
C(g)+O2(g)=CO2(g) △H2=—393.5kJ·mol-1
2C(g)+O2(g)=2CO(g) △H3=—221kJ·mol-1
净化反应的△H=
(2)下列可判断净化反应达到平衡的是
| A.混合气体的平均相对分子质量不变 | B.p(CO)∶p(N2)=2∶1 |
| C.NO的质量保持不变 | D.v(NO)=2v(N2) |
①升高温度,k正—k逆
②按照n(CO)∶n(NO)=1∶1投料反应,在不同压强下,净化反应中CO的平衡转化率随反应温度的变化如图1所示。当压强为p1、温度为t1℃时,某时刻测得N2的体积分数为
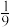 ,此时
,此时 =
=
(4)Ⅱ.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g) △H<0。其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图2。
4N2(g)+6H2O(g) △H<0。其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图2。
①工业上选择催化剂乙的原因是
②在催化剂甲作用下,图中M点对应温度为210℃。210℃之前,NO转化率随温度升高而增大的原因是
(5)Ⅲ.比亚迪双模电动车不依赖专业充电站,采用了镍镉可充电电池。其总反应为:Cd+2NiOOH+2H2O
 Cd(OH)2+2Ni(OH)2。当电动车车行驶30min,电池的平均电流强度为aA,正极质量增加
Cd(OH)2+2Ni(OH)2。当电动车车行驶30min,电池的平均电流强度为aA,正极质量增加
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】努力实现碳达峰、碳中和展现了我国积极参与和引领全球气候治理的大国担当。 的综合利用是实现碳中和的保证。
的综合利用是实现碳中和的保证。
Ⅰ.回收利用 解决空间站供氧问题物质转化如图所示:
解决空间站供氧问题物质转化如图所示:
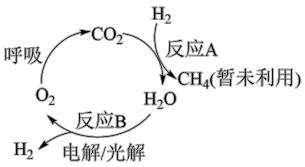
(1)反应A为 ,是回收利用
,是回收利用 的关键步骤。
的关键步骤。
已知:
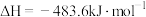

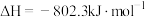
反应A的
__________
(2)将原料气按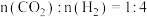 置于恒容密闭容器中发生反应A,在相同时间内测得
置于恒容密闭容器中发生反应A,在相同时间内测得 的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
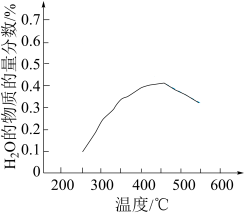
①理论上,能提高 平衡转化率的措施有
平衡转化率的措施有__________ (选填编号)
a.降温 b.缩小容器体积
c.向容器中冲入Ar,增大压强 d.提高原料气中 的比例
的比例
②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高 的转化效率,原因是
的转化效率,原因是_____ 。
(3)下列关于空间站内物质和能量变化的说法中,不正确的是_____ (填字母)。
a.反应B的主要能量变化是“电能→化学能”或“光能→化学能”
b.物质转化中O、H原子的利用率均为100%
c.不用 作供氧剂的原因可能是
作供氧剂的原因可能是 不易实现循环利用
不易实现循环利用
Ⅱ.利用 生产乙烯:
生产乙烯:
 ;在三个容积均为
;在三个容积均为 的密闭容器中以不同的氢碳比
的密闭容器中以不同的氢碳比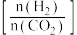 充入
充入 和
和 ,在一定条件下
,在一定条件下 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
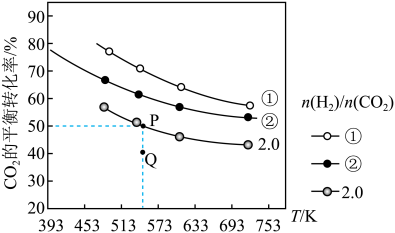
(4)下列说法正确的是__________ (双选)
a.该反应的
b.氢碳比: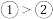
c.在氢碳比为2.0时,Q点:
(5)在上述 的密闭容器中充入
的密闭容器中充入 和
和 发生反应,
发生反应, 后到达P点,那么这
后到达P点,那么这 内
内 的反应速率为
的反应速率为__________ 。
 的综合利用是实现碳中和的保证。
的综合利用是实现碳中和的保证。Ⅰ.回收利用
 解决空间站供氧问题物质转化如图所示:
解决空间站供氧问题物质转化如图所示:
(1)反应A为
 ,是回收利用
,是回收利用 的关键步骤。
的关键步骤。已知:

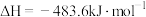

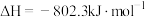
反应A的

(2)将原料气按
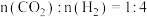 置于恒容密闭容器中发生反应A,在相同时间内测得
置于恒容密闭容器中发生反应A,在相同时间内测得 的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
①理论上,能提高
 平衡转化率的措施有
平衡转化率的措施有a.降温 b.缩小容器体积
c.向容器中冲入Ar,增大压强 d.提高原料气中
 的比例
的比例②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高
 的转化效率,原因是
的转化效率,原因是(3)下列关于空间站内物质和能量变化的说法中,不正确的是
a.反应B的主要能量变化是“电能→化学能”或“光能→化学能”
b.物质转化中O、H原子的利用率均为100%
c.不用
 作供氧剂的原因可能是
作供氧剂的原因可能是 不易实现循环利用
不易实现循环利用Ⅱ.利用
 生产乙烯:
生产乙烯:
 ;在三个容积均为
;在三个容积均为 的密闭容器中以不同的氢碳比
的密闭容器中以不同的氢碳比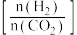 充入
充入 和
和 ,在一定条件下
,在一定条件下 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
(4)下列说法正确的是
a.该反应的

b.氢碳比:
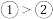
c.在氢碳比为2.0时,Q点:

(5)在上述
 的密闭容器中充入
的密闭容器中充入 和
和 发生反应,
发生反应, 后到达P点,那么这
后到达P点,那么这 内
内 的反应速率为
的反应速率为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】将CO2转化为有经济价值的产物,可以推动经济高质量发展和改善生态环境质量,实现碳中和。请回答下列问题:
(1)以CO2为原料加氢合成二甲醚(CH3OCH3)、甲醇(CH3OH)有利于实现碳中和。已知:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.01kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.01kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-24.52kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.52kJ·mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41.17kJ·mol-1
CO(g)+H2O(g) △H3=+41.17kJ·mol-1
则反应④2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)的△H4=
CH3OCH3(g)+3H2O(g)的△H4=____ kJ·mol-1。
(2)在一定条件下,向恒容密闭容器中通入一定量的CO2和H2仅发生反应④,下列能说明反应④已达到平衡状态的是____ (填标号)。
(3)温度为T℃时,向体积为2L的恒容密闭容器中通入1molCO2和1molH2,仅发生反应③,10min后达到平衡时氢气的体积分数为25%,则0~10min内,v(CO2)=____ mol·L-1·min-1,该反应的平衡常数为____ 。若该反应中v正=k正•c(CO2)•c(H2),v逆=k逆•c(CO)•c(H2O),其中k正、k逆为速率常数,仅与温度有关,当反应过程中CO2的物质的量为0.6mol时,v正∶v逆=____ 。
(4)CO2催化加氢生成乙烯也是CO2的热点研究领域。
2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H<0
C2H4(g)+4H2O(g) △H<0
a.达到平衡后,欲提高乙烯(C2H4)的产率,并加快反应的速率,可采取的措施是____ (写出其中符合条件的一种)。
b.如图所示,向甲、乙两个密闭容器中分别充入1molCO2和3molH2(其中甲为恒容容器,乙为恒压容器),发生CO2催化加氢生成乙烯的反应,起始温度、体积相同(T1℃、4L密闭容器),达到平衡时,乙容器的容积为2.8L,则平衡时甲容器中CO2的物质的量____ (填“大于”、“小于”或“等于”)0.2mol。
(1)以CO2为原料加氢合成二甲醚(CH3OCH3)、甲醇(CH3OH)有利于实现碳中和。已知:
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.01kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.01kJ·mol-1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2=-24.52kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.52kJ·mol-1③CO2(g)+H2(g)
 CO(g)+H2O(g) △H3=+41.17kJ·mol-1
CO(g)+H2O(g) △H3=+41.17kJ·mol-1则反应④2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)的△H4=
CH3OCH3(g)+3H2O(g)的△H4=(2)在一定条件下,向恒容密闭容器中通入一定量的CO2和H2仅发生反应④,下列能说明反应④已达到平衡状态的是
| A.CO2、H2、CH3OCH3分子数之比为2∶6∶1 |
| B.混合气体的平均摩尔质量保持不变 |
| C.单位时间内,每断裂2个C=O键,同时形成3个O-H键 |
| D.混合气体的密度不再变化 |
(4)CO2催化加氢生成乙烯也是CO2的热点研究领域。
2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) △H<0
C2H4(g)+4H2O(g) △H<0a.达到平衡后,欲提高乙烯(C2H4)的产率,并加快反应的速率,可采取的措施是
b.如图所示,向甲、乙两个密闭容器中分别充入1molCO2和3molH2(其中甲为恒容容器,乙为恒压容器),发生CO2催化加氢生成乙烯的反应,起始温度、体积相同(T1℃、4L密闭容器),达到平衡时,乙容器的容积为2.8L,则平衡时甲容器中CO2的物质的量

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】Ⅰ.稀土金属包括17种金属,已广泛应用于电子、石油化工、冶金等各个行业。德国《每日镜报》援引一名德国经济界驻京代表的话说,中国人玩稀土就像当年欧佩克玩石油一样:稀土这种资源被描述成中国要挟他国的“独门武器”,是因为中国控制世界稀土市场约98%的份额。稀土金属的制备常用电解法,步骤如下:
第一步:稀土氯化物晶体(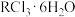 )的制备(R表示稀土金属,常见稳定价态为+3价)。
)的制备(R表示稀土金属,常见稳定价态为+3价)。
由于R—O键比R—Cl(或R—F)键牢固,所以稀土金属在自然界大多以R—O键的形式存在,人们常常以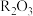 表示矿物中稀土金属的含量。将矿物用浓盐酸处理再经分离提纯得到
表示矿物中稀土金属的含量。将矿物用浓盐酸处理再经分离提纯得到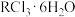 。
。
第二步:无水稀土氯化物的制备。
将稀土氧化物晶体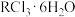 脱水制取
脱水制取 ,脱水温度为200~300℃。
,脱水温度为200~300℃。
第三步:电解。
第四步:再通过较为复杂的方法分离各种稀土金属。
请回答下列问题:
(1)生产时选择电解熔融稀土金属氯化物,而不用熔融稀土金属氧化物的原因是___________ 。
(2)若要测定某矿物中稀土金属含量,方法之一是将矿物处理为氧化物,然后转化为草酸盐,再用热重分析法测定(产物为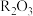 )。若在实验室来进行,应将提纯后的草酸盐放在
)。若在实验室来进行,应将提纯后的草酸盐放在___________ 中加热,灼烧至恒重。某实验小组进行实验,实验数据如下表所示:
则该样品中稀土金属含量为___________ (不考虑处理过程中的损失,含量以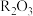 计,用百分数表示)。
计,用百分数表示)。
Ⅱ.脱水时会有部分稀土氯氧化物ROCl(红色)生成,这种难熔的物质会使电解时的熔体粘度增大,导电性降低,并使析出的金属液滴不易从盐相中聚集和离析出来。这些悬浮的ROCl在电解时大部分会沉积于电解槽的底部,将阴极金属覆盖住,使电解难以继续进行,红色的ROCl被称为“红泥”。“红泥”不被电解。
(3)为防止ROCl的生成,脱水可在 存在的条件下进行,理由是
存在的条件下进行,理由是___________ ,同时,在 存在时,若有ROCl产生,也能转化为
存在时,若有ROCl产生,也能转化为 。试用化学反应方程式予以解释
。试用化学反应方程式予以解释__________ 。
(4)电解时电解槽电极之一为石墨,实验表明,即使是使用含水的稀土氯化物,槽内也并无红泥的蓄积,但发现作为电极的石墨发生严重的腐蚀现象。其中石墨作___________ 极,试写出该电极上的电极反应式___________ (电解温度:850~900℃,“红泥”被消除时有气体产生,且有 生成)。
生成)。
第一步:稀土氯化物晶体(
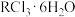 )的制备(R表示稀土金属,常见稳定价态为+3价)。
)的制备(R表示稀土金属,常见稳定价态为+3价)。由于R—O键比R—Cl(或R—F)键牢固,所以稀土金属在自然界大多以R—O键的形式存在,人们常常以
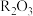 表示矿物中稀土金属的含量。将矿物用浓盐酸处理再经分离提纯得到
表示矿物中稀土金属的含量。将矿物用浓盐酸处理再经分离提纯得到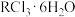 。
。第二步:无水稀土氯化物的制备。
将稀土氧化物晶体
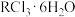 脱水制取
脱水制取 ,脱水温度为200~300℃。
,脱水温度为200~300℃。第三步:电解。
第四步:再通过较为复杂的方法分离各种稀土金属。
请回答下列问题:
(1)生产时选择电解熔融稀土金属氯化物,而不用熔融稀土金属氧化物的原因是
(2)若要测定某矿物中稀土金属含量,方法之一是将矿物处理为氧化物,然后转化为草酸盐,再用热重分析法测定(产物为
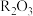 )。若在实验室来进行,应将提纯后的草酸盐放在
)。若在实验室来进行,应将提纯后的草酸盐放在| 矿物样品质量(g) | 剩余固体质量(g) | |
| 第一次实验 | 1.48 | 0.89 |
| 第二次实验 | 1.51 | 0.90 |
| 第三次实验 | 1.51 | 0.91 |
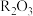 计,用百分数表示)。
计,用百分数表示)。Ⅱ.脱水时会有部分稀土氯氧化物ROCl(红色)生成,这种难熔的物质会使电解时的熔体粘度增大,导电性降低,并使析出的金属液滴不易从盐相中聚集和离析出来。这些悬浮的ROCl在电解时大部分会沉积于电解槽的底部,将阴极金属覆盖住,使电解难以继续进行,红色的ROCl被称为“红泥”。“红泥”不被电解。
(3)为防止ROCl的生成,脱水可在
 存在的条件下进行,理由是
存在的条件下进行,理由是 存在时,若有ROCl产生,也能转化为
存在时,若有ROCl产生,也能转化为 。试用化学反应方程式予以解释
。试用化学反应方程式予以解释(4)电解时电解槽电极之一为石墨,实验表明,即使是使用含水的稀土氯化物,槽内也并无红泥的蓄积,但发现作为电极的石墨发生严重的腐蚀现象。其中石墨作
 生成)。
生成)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】二氧化碳、甲烷等是主要的温室气体。研发二氧化碳和甲烷的利用技术对治理生态环境具有重要意义。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=akJ/molK1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=bkJ/molK2
2CO(g)+O2(g)=2CO2(g) ΔH3=ckJ/mol K3
则催化重整反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的ΔH4=_______ ,平衡常数K4=_______ (用含K1、K2、K3的代数式表示)。
(2)催化重整反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)中,测得CH4的平衡转化率与温度及压强的关系如下图所示:

①该反应ΔH_______ 0(填“>”“<”“=”)
②由图可知,P1、P2、P3、P4由大到小的顺序为_______ 。
③在压强为P4、投料比n(CH4)/n(CO2)=1、950℃的条件下,X点平衡常数Kp=_______ 。
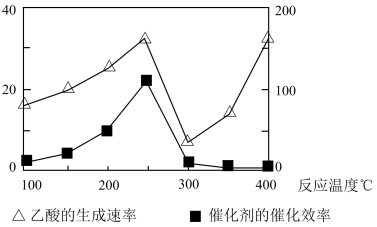
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率却在降低的原因是_______ 。
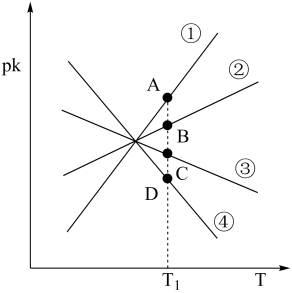
(4)反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.17kJ/mol的正、逆反应速率可分别表示为v正=k正c(CO2)•c(H2)、v逆=k逆c(CO)•c(H2O),则如图所示的四条斜线中,能表示pk正(pk=-lgk)随T变化关系的是_______ (填序号)。
(5)一种以甲醇为原料,利用SnO2(mSnO2/CC)和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
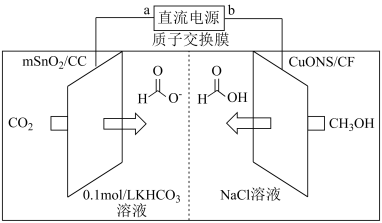
①电解过程中阳极电极反应式为_______ 。
②当有4molH+通过质子交换膜时,装置中生成HCOO-和HCOOH共计_______ mol。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=akJ/molK1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=bkJ/molK2
2CO(g)+O2(g)=2CO2(g) ΔH3=ckJ/mol K3
则催化重整反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的ΔH4=
(2)催化重整反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)中,测得CH4的平衡转化率与温度及压强的关系如下图所示:

①该反应ΔH
②由图可知,P1、P2、P3、P4由大到小的顺序为
③在压强为P4、投料比n(CH4)/n(CO2)=1、950℃的条件下,X点平衡常数Kp=
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率却在降低的原因是

(4)反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.17kJ/mol的正、逆反应速率可分别表示为v正=k正c(CO2)•c(H2)、v逆=k逆c(CO)•c(H2O),则如图所示的四条斜线中,能表示pk正(pk=-lgk)随T变化关系的是

(5)一种以甲醇为原料,利用SnO2(mSnO2/CC)和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。

①电解过程中阳极电极反应式为
②当有4molH+通过质子交换膜时,装置中生成HCOO-和HCOOH共计
您最近一年使用:0次
【推荐3】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g)ΔH。若:N
N2(g)+3H2(g)ΔH。若:N N键、H—H键和N—H键的键能值分别记作a、b和c(单位,kJ•mol-1),则上述反应的ΔH=
N键、H—H键和N—H键的键能值分别记作a、b和c(单位,kJ•mol-1),则上述反应的ΔH=____________ (用含(a、b、c的代数式表示)kJ•mol-1。
(2)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位mmol•min-1)与催化剂的对应关系如表所示。
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是____________ (填写催化剂的化学式)。
②温度为T时.在恒容的密闭容器中加入2molNH3此时压强为p0用Ru催化氨气分解,若平衡时氨气的转化率为50%.,则该温度下反应2NH3(g) N2(g)+3H2(g)的化学平衡常数Kp=
N2(g)+3H2(g)的化学平衡常数Kp=____________ 。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
(3)关于合成氨工艺的理解,下列说法不正确的是____________ (填字母)。
A.合成氨工业常采用的反应温度为500℃左右,主要是为了节约能源
B.使用初始反应速率更快的催化剂Ru.,不能提高平衡时NH3的产率
C.合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高
(4)电化学法合成氨:利用低温固体质子导体作电解质,用Pt—C3N4作阴极,催化电解H2(g)和N2(g)合成NH3原理示意如图所示。

①Pt—C3N4,电极上产生NH3的电极反应式为____________ 。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:____________ 。
(1)氨气分解反应的热化学方程式如下:2NH3(g)
 N2(g)+3H2(g)ΔH。若:N
N2(g)+3H2(g)ΔH。若:N N键、H—H键和N—H键的键能值分别记作a、b和c(单位,kJ•mol-1),则上述反应的ΔH=
N键、H—H键和N—H键的键能值分别记作a、b和c(单位,kJ•mol-1),则上述反应的ΔH=(2)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位mmol•min-1)与催化剂的对应关系如表所示。
| 催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
| 初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
②温度为T时.在恒容的密闭容器中加入2molNH3此时压强为p0用Ru催化氨气分解,若平衡时氨气的转化率为50%.,则该温度下反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数Kp=
N2(g)+3H2(g)的化学平衡常数Kp=(3)关于合成氨工艺的理解,下列说法不正确的是
A.合成氨工业常采用的反应温度为500℃左右,主要是为了节约能源
B.使用初始反应速率更快的催化剂Ru.,不能提高平衡时NH3的产率
C.合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高
(4)电化学法合成氨:利用低温固体质子导体作电解质,用Pt—C3N4作阴极,催化电解H2(g)和N2(g)合成NH3原理示意如图所示。

①Pt—C3N4,电极上产生NH3的电极反应式为
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】近日,雾霾又上了度娘热搜榜。其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
(1)氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质。
①写出该反应的化学反应方程式:_____________ 。
②已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1=-907.28kJ•mol-1;
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2=-1269.02kJ•mol-1。105℃时,则上述脱硝反应的△H=_______ ,该反应________ (填“能” “否”或“不能确定”)自发进行,
③上述脱硝反应中氧化剂和还原剂的物质的量之比为________ 。每生成1mol还原产物,则反应中转移电子数为_________ mol。
(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g) N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
0~10min内甲容器中反应的平均速率:v(O3) =_______ mol·L-1·min-1 。
②T1________ T2 (填“>”“<”或“=”),T1时,该反应的平衡常数为____________ 。
③下列措施能提高容器乙中NO2转化率的是________ (填序号)。
A.向容器中充入He,增大容器的压强
B.升高容器的温度
C.向容器中再充人一定量的NO2
D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mol NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,v(正)________ v(逆) (填“>”“<”或“=”)。
(1)氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质。
①写出该反应的化学反应方程式:
②已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1=-907.28kJ•mol-1;
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2=-1269.02kJ•mol-1。105℃时,则上述脱硝反应的△H=
③上述脱硝反应中氧化剂和还原剂的物质的量之比为
(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)
 N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:| 容器 | 甲 | 乙 |
| 容积/L | 1 | 1 |
| 温度/K | T1 | T2 |
| 起始充入量 | lmolO3 2mol NO2 | lmolO3 2mol NO2 |

0~10min内甲容器中反应的平均速率:v(O3) =
②T1
③下列措施能提高容器乙中NO2转化率的是
A.向容器中充入He,增大容器的压强
B.升高容器的温度
C.向容器中再充人一定量的NO2
D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mol NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,v(正)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。
(1)已知反应CO(g)+2H2(g)== CH3OH(g) ∆H= —99kJ.mol—1中的相关化学键键能如下:
则x=___________________ 。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g) CH3OH(g) ,
CH3OH(g) ,
CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
①a、b两点的反应速率:v(b)____ v(a)(填“>”、“<”或“=”)。②该反应的△S______ 0,图中的T1______ T2(填“>”、“<”或“=”)。
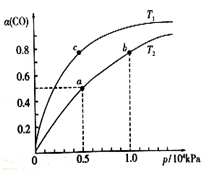
③该合成反应的温度一般控制在240~270℃,选择此温度范围的原因是:
I.此温度范围下的催化剂活性高;
II.______________________________________________________ 。
④图中a点的压强平衡常数KP=_______________ (KPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
I:CO(g)+2H2(g) CH3OH(g) ∆H1
CH3OH(g) ∆H1
II:CO2(g)+H2(g) CO(g) + H2O(g) ∆H2
CO(g) + H2O(g) ∆H2
III:CO2(g)+3H2(g) CH3OH(g) + H2O(g) ∆H3
CH3OH(g) + H2O(g) ∆H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如下图所示。

则∆H1___________ ∆H3(填“>”、“<”或“=”), 理由是__________________________ 。
(1)已知反应CO(g)+2H2(g)== CH3OH(g) ∆H= —99kJ.mol—1中的相关化学键键能如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | x | 465 | 413 |
则x=
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)
 CH3OH(g) ,
CH3OH(g) ,CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
①a、b两点的反应速率:v(b)

③该合成反应的温度一般控制在240~270℃,选择此温度范围的原因是:
I.此温度范围下的催化剂活性高;
II.
④图中a点的压强平衡常数KP=
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
I:CO(g)+2H2(g)
 CH3OH(g) ∆H1
CH3OH(g) ∆H1II:CO2(g)+H2(g)
 CO(g) + H2O(g) ∆H2
CO(g) + H2O(g) ∆H2III:CO2(g)+3H2(g)
 CH3OH(g) + H2O(g) ∆H3
CH3OH(g) + H2O(g) ∆H3上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如下图所示。

则∆H1
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】Ⅰ.已知:CO2(g)+ 3H2(g) ⇌CH3OH(g)+ H2O(g) △H
现在体积为1L的密闭容器中,充入CO2和H2。实验测得反应体系中物质的物质的量与时间关系如下表,
回答下列问题:
(1)表格中的n1=______________
(2)0-5min内 v (H2)=_______________
(3)该条件下CO2的平衡转化率为__________________
Ⅱ.在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g)。一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) △H
CO(g)+3H2(g) △H
已知CH4的转化率与温度、压强的关系如图1所示。回答下列问题:

(4)100℃时平衡常数为_________________ .
(5)图1中的p1_______ p2(填“<”、“>”或“=”),其理由是:_________________
(6)若100℃时该可逆反应的平衡常数是K1,200℃该该可逆反应的平衡常数是K2,则K1___ K2(填“<”、“>”或“=”).其理由是__________________
现在体积为1L的密闭容器中,充入CO2和H2。实验测得反应体系中物质的物质的量与时间关系如下表,
n(CO2) | n(H2) | n(CH2CH(g) | n(H2O(g) | |
0 | 1.00mol | 3.25mol | 0.00 | 0.00 |
5min | 0.50mol | 0.50mol | ||
10min | 0.25mol | 0.75mol | ||
15min | 0.25mol | n1 |
回答下列问题:
(1)表格中的n1=
(2)0-5min内 v (H2)=
(3)该条件下CO2的平衡转化率为
Ⅱ.在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g)。一定条件下发生反应:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H
CO(g)+3H2(g) △H已知CH4的转化率与温度、压强的关系如图1所示。回答下列问题:

(4)100℃时平衡常数为
(5)图1中的p1
(6)若100℃时该可逆反应的平衡常数是K1,200℃该该可逆反应的平衡常数是K2,则K1
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g) C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
CO(g)+3H2(g) CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
写出CO与H2O (g)反应生成H2和CO2的热化学方程式____________________________________ 。
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,已知T℃k(NH3•H2O)=1.74×10-5,k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是______________ 。
a.c(NH4+)>c(HS-)>c(OH-)>c(H+) b. c(HS-)>c(NH4+)>c(S2-)>c(H+)
c.c(NH4+)>c(HS-)>c(H2S)>c(H+) d.c(HS-)>c(S2-)>c(H+)>c(OH-)
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
①一定温度时,在一个体积为2L的恒容密闭容器中,加入1molCH4和1.4mol水蒸气发生上述反应,5min后达平衡,生成0.2molCO,用H2表示该反应的速率为_______________ ,此反应的平衡常数为__________________ (结果保留到小数点后三位)
②下列说法中能说明此反应达到平衡状态的是____________ 。
A.体系的压强不再发生变化 B.生成1mol CH4的同时消耗3mol H2
C.各组分的物质的量浓度不再改变 D.体系的密度不再发生变化
E.反应速率V(CH4) :V(H2O) :v(CO) :v(H2)= 1:1:1:3
(4)甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g) CO2(g) +3H2(g) ΔH = +49kJ·mol-1
CO2(g) +3H2(g) ΔH = +49kJ·mol-1
①分析适当增大水醇比[n(H2O) ∶n (CH3OH)]对甲醇水蒸气重整制氢的好处____________ 。
②某温度下,将[n(H2O) ∶n (CH3OH)]=l∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为______________________ 。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:C(s)+2H2(g)
 CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-12CO(g)
 C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1CO(g)+3H2(g)
 CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
CH4(g)+H2O (g) ΔH=-203 kJ·mol-1写出CO与H2O (g)反应生成H2和CO2的热化学方程式
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,已知T℃k(NH3•H2O)=1.74×10-5,k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是
a.c(NH4+)>c(HS-)>c(OH-)>c(H+) b. c(HS-)>c(NH4+)>c(S2-)>c(H+)
c.c(NH4+)>c(HS-)>c(H2S)>c(H+) d.c(HS-)>c(S2-)>c(H+)>c(OH-)
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g)
 CO(g)+3H2(g)。
CO(g)+3H2(g)。①一定温度时,在一个体积为2L的恒容密闭容器中,加入1molCH4和1.4mol水蒸气发生上述反应,5min后达平衡,生成0.2molCO,用H2表示该反应的速率为
②下列说法中能说明此反应达到平衡状态的是
A.体系的压强不再发生变化 B.生成1mol CH4的同时消耗3mol H2
C.各组分的物质的量浓度不再改变 D.体系的密度不再发生变化
E.反应速率V(CH4) :V(H2O) :v(CO) :v(H2)= 1:1:1:3
(4)甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)
 CO2(g) +3H2(g) ΔH = +49kJ·mol-1
CO2(g) +3H2(g) ΔH = +49kJ·mol-1①分析适当增大水醇比[n(H2O) ∶n (CH3OH)]对甲醇水蒸气重整制氢的好处
②某温度下,将[n(H2O) ∶n (CH3OH)]=l∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】煤的气化和天然气净化过程中会产生H2S,将其吸收与转化是环境保护和资源利用的有效措施。回答下列问题:
(1)利用足量纯碱溶液可吸收低浓度H2S,生成的含硫物质主要是___________ (填化学式。H2S的Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11)。
(2)电解氧化法处理H2S的原理是:在氧化反应器中,利用Fe3+氧化H2S;在电解反应器中实现Fe3+的再生,并副产氢气,总反应为H2S(g) S(s)+H2(g) △H1,相关物质的燃烧热数据如下表:
S(s)+H2(g) △H1,相关物质的燃烧热数据如下表:
则△H1=___________ kJ·mol-1。
(3)H2S高温裂解转化为H2和硫蒸气S2 反应方程式:2H2S(g) 2H2(g)+S2(g) 。维持体系压强为100 kPa,反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图所示。
2H2(g)+S2(g) 。维持体系压强为100 kPa,反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图所示。

①H2S高温裂解反应的△H___________ 0(填“>”或“<”)。曲线c代表的物质是___________ (填化学式)
②反应温度为1300℃时,H2S的平衡转化率为___________ ,反应的平衡常数Kp=___________ (计算结果保留1位小数)。
(1)利用足量纯碱溶液可吸收低浓度H2S,生成的含硫物质主要是
(2)电解氧化法处理H2S的原理是:在氧化反应器中,利用Fe3+氧化H2S;在电解反应器中实现Fe3+的再生,并副产氢气,总反应为H2S(g)
 S(s)+H2(g) △H1,相关物质的燃烧热数据如下表:
S(s)+H2(g) △H1,相关物质的燃烧热数据如下表:| 物质 | H2S(g) | S(s) | H2(g) |
| 燃烧热AH/(kJ·mol-1) | -562.0 | -296.8 | -258.8 |
(3)H2S高温裂解转化为H2和硫蒸气S2 反应方程式:2H2S(g)
 2H2(g)+S2(g) 。维持体系压强为100 kPa,反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图所示。
2H2(g)+S2(g) 。维持体系压强为100 kPa,反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图所示。
①H2S高温裂解反应的△H
②反应温度为1300℃时,H2S的平衡转化率为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】费托合成是以合成气为原料,在催化作用下合成液态烃的工艺流程,是我国煤化工的重点发展方向。催化剂的选择性、高稳定性是研究重点,目前主要以纳米铁系催化剂以及钴系催化剂为主,实验室常以固定床或者搅拌釜作为该反应的研究装置,已知该反应的机理如图所示:

已知2CO(g)+4H2(g) C2H4(g)+2H2O(g)△H=-237kJ/mol反应Ⅰ
C2H4(g)+2H2O(g)△H=-237kJ/mol反应Ⅰ
CO(g)+3H2(g) CH4(g)+H2O(g)△H=-178kJ/mol反应Ⅱ
CH4(g)+H2O(g)△H=-178kJ/mol反应Ⅱ
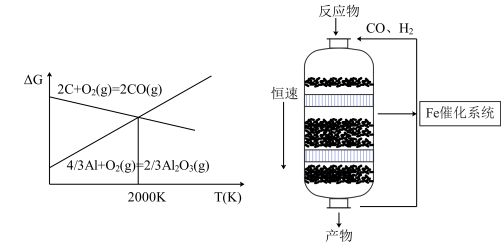
(1)C是一种良好的还原剂,可用来还原各种金属氧化物,如图为C和Al分别和氧气反应的吉布斯自由能变与温度的关系,已知ΔG<0,反应自发,写出C在2000K以上还原Al2O3的化学方程式:__ ,由如图推测2000K以上该反应是反应___ (填“自发”或者“不自发”)。
(2)在固定床反应器中,生产条件为5MPa,200℃~250℃,流速100mL/min,若不考虑其它产物的情况,下列说法错误 的是___ 。
A.采用纳米铁催化剂可以提高催化剂表面积,加快化学反应速率
B.合成气在催化剂表面没有化学键的形成,催化剂改变了化学反应历程
C.固定床反应器中合成气的流速影响产物的转化率和选择性
D.适当升高温度(不考虑催化剂失活)可以提高CO的平衡转化率
E.反应开始前往往先通入H2处理一段时间是为了激活催化剂,去除表面氧化膜
(3)已知固定床反应器中增加装置压强会导致产物中C2H4选择性上升,可能的原因是___ 。
(4)实验中通常也以搅拌釜作为恒容反应容器,在搅拌釜中加入铁系催化剂,再通入10MPa合成气后关闭进气,升温到200℃维持稳定,开启搅拌桨,一直反应到约10~20h后装置内气压不再发生改变(不考虑装置漏气)。在保持其他条件不变的情况下,为了提高C2H4的选择性可以采取的措施是___ 。
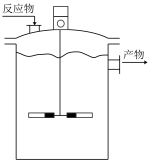
A.适当升高温度 B.改变催化剂 C.适当降低温度 D.加快搅拌速度
(5)搅拌釜反应器中按照投料比 =3:1通入气体,起始压强为8MPa,关闭进气阀,控制反应温度为200℃,反应结束后测得CO的转化率为20%,C2H4的选择性为50%,求该条件下反应Ⅱ的Kp=
=3:1通入气体,起始压强为8MPa,关闭进气阀,控制反应温度为200℃,反应结束后测得CO的转化率为20%,C2H4的选择性为50%,求该条件下反应Ⅱ的Kp=___ (MPa)-2(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)表示的平衡常数记作Kp)。
(6)某课题小组采用气相色谱研究该反应中C1到C4的各种烃类分布,以N2作为载气(流动相),已知不同气体在同一色谱柱中出峰时间不相同,如图为该产物色谱图中的部分内容,请利用气相色谱设计一种方法判断哪一个峰是乙烯___ 。



已知2CO(g)+4H2(g)
 C2H4(g)+2H2O(g)△H=-237kJ/mol反应Ⅰ
C2H4(g)+2H2O(g)△H=-237kJ/mol反应ⅠCO(g)+3H2(g)
 CH4(g)+H2O(g)△H=-178kJ/mol反应Ⅱ
CH4(g)+H2O(g)△H=-178kJ/mol反应Ⅱ(1)C是一种良好的还原剂,可用来还原各种金属氧化物,如图为C和Al分别和氧气反应的吉布斯自由能变与温度的关系,已知ΔG<0,反应自发,写出C在2000K以上还原Al2O3的化学方程式:

(2)在固定床反应器中,生产条件为5MPa,200℃~250℃,流速100mL/min,若不考虑其它产物的情况,下列说法
A.采用纳米铁催化剂可以提高催化剂表面积,加快化学反应速率
B.合成气在催化剂表面没有化学键的形成,催化剂改变了化学反应历程
C.固定床反应器中合成气的流速影响产物的转化率和选择性
D.适当升高温度(不考虑催化剂失活)可以提高CO的平衡转化率
E.反应开始前往往先通入H2处理一段时间是为了激活催化剂,去除表面氧化膜
(3)已知固定床反应器中增加装置压强会导致产物中C2H4选择性上升,可能的原因是
(4)实验中通常也以搅拌釜作为恒容反应容器,在搅拌釜中加入铁系催化剂,再通入10MPa合成气后关闭进气,升温到200℃维持稳定,开启搅拌桨,一直反应到约10~20h后装置内气压不再发生改变(不考虑装置漏气)。在保持其他条件不变的情况下,为了提高C2H4的选择性可以采取的措施是

A.适当升高温度 B.改变催化剂 C.适当降低温度 D.加快搅拌速度
(5)搅拌釜反应器中按照投料比
 =3:1通入气体,起始压强为8MPa,关闭进气阀,控制反应温度为200℃,反应结束后测得CO的转化率为20%,C2H4的选择性为50%,求该条件下反应Ⅱ的Kp=
=3:1通入气体,起始压强为8MPa,关闭进气阀,控制反应温度为200℃,反应结束后测得CO的转化率为20%,C2H4的选择性为50%,求该条件下反应Ⅱ的Kp=(6)某课题小组采用气相色谱研究该反应中C1到C4的各种烃类分布,以N2作为载气(流动相),已知不同气体在同一色谱柱中出峰时间不相同,如图为该产物色谱图中的部分内容,请利用气相色谱设计一种方法判断哪一个峰是乙烯


您最近一年使用:0次



