下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 浓硫酸与乙醇170℃共热,制得的气体通入酸性KMnO4溶液 | 溶液紫色褪去 | 制得的气体为乙烯 |
B | 测定等浓度的Na2CO3和Na2SO3的溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C | 向2.0ml浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1AgNO3溶液,振荡 | 沉淀呈黄色 | Ksp(AgCl)>Ksp(AgI) |
D | 向待测液中先滴加Ba(NO3)2溶液, 再滴加稀盐酸 | 出现白色沉淀 | 原待测液中一定含有SO42- |
| A.A | B.B | C.C | D.D |
更新时间:2017-03-07 14:43:12
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】25℃时,关于某酸(用H2A表示)下列说法中,不正确的是
| A.pH=a的Na2A溶液中,由水电离产生的c(OH-)=10a-14 |
| B.将pH=a的H2A稀释为pH=a+l的过程中,c(H2A)/c(H+)减小,则H2A为弱酸 |
| C.测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| D.0.2 mol·L-1 H2A 溶液中的 c(H+)=a,0.1 mol·L-1 H2A溶液中的 c(H+)=b,若a<2 b,则H2A为弱酸 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温时, 的
的 溶液用
溶液用 调节
调节 得到一组
得到一组 的溶液,各含砷微粒的物质的量的分布分数如图所示,下列说法错误的是
的溶液,各含砷微粒的物质的量的分布分数如图所示,下列说法错误的是
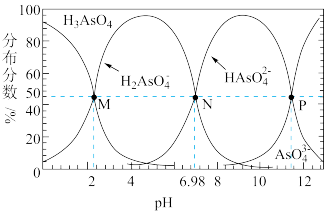
 的
的 溶液用
溶液用 调节
调节 得到一组
得到一组 的溶液,各含砷微粒的物质的量的分布分数如图所示,下列说法错误的是
的溶液,各含砷微粒的物质的量的分布分数如图所示,下列说法错误的是
A. 点时, 点时,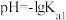 |
B. 的 的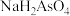 溶液中: 溶液中: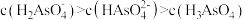 |
C. 点时, 点时, |
D. 点时, 点时,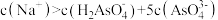 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】某温度下,向10mL 0.1mol/LCuSO4溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中−lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是

[已知:lg2=0.3,Ksp(ZnS)=3×10-25]

[已知:lg2=0.3,Ksp(ZnS)=3×10-25]
A.Na2S溶液呈碱性,是因为S2-离子发生了水解,用离子方程式可表示为:S2-+2H2O H2S+2OH- H2S+2OH- |
| B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) |
| C.向100mL Zn2+、Cu2+浓度均为10-5mol·L-1的混合溶液中逐滴加入10-4mol·L-1的Na2S溶液,Zn2+先沉淀 |
| D.该温度下Ksp(CuS)=4×10-36 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】下列实验过程可以达到实验目的的是( )
| 选项 | 实验目的 | 实验过程 |
| A | 配制Fe(NO3)2溶液 | 将Fe(NO3)2·9H2O溶于较浓硝酸,然后加水稀释 |
| B | 探究SO2的漂白性 | 向盛有2mL黄色氯化铁溶液的试管中通入SO2,观察颜色变化 |
| C | 探究AgBr、AgI的溶度积大小 | 向2支盛有2mL不同浓度NaBr、NaI溶液的试管中分别滴入2滴相同浓度的AgNO3稀溶液,观察实验现象 |
| D | 探究催化剂对化学反应速率的影响 | 向2支试管中分别加入2mL0.01mol· L-1 KMnO4溶液,一支中加小粒MnSO4固体,然后2支试管中同时加入2mL0.1mol·L-1H2C2O4溶液,比较褪色时间快慢 |
A.A  | B.B  | C.C  | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】根据下列实验操作和现象所得到的结论不正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向浓度均为0.1mol/L的MgCl2、CuC12混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| B | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | X不一定具有氧化性 |
| C | 某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 不能说明该溶液中一定含有SO42- |
| D | 加热盛有(NH4)2CO3固体的试管,并在试管口放置湿润的红色石蕊试纸,试纸变蓝 | (NH4)2CO3显碱性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
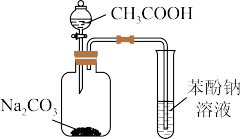
【推荐1】用如图所示装置检验乙烯时不需要虚线框中除杂装置的是( )


| 选项 | 乙烯的制备 | 试剂X | 试剂Y |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | I2的CCl4溶液 |
| C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | I2的CCl4溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】下列实验中,操作、现象及结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将CH3CH2Br与NaOH溶液共热,冷却后,取出上层水溶 液加入AgNO3溶液 | 产生淡黄色沉淀 | CH3CH2Br中含有溴原子 |
| B | 向2mL10%的NaOH溶液中滴入2%的CuSO4溶液4至6滴,得到新制的 悬浊液,然后加入乙醛溶液0.5mL,振荡后加热 悬浊液,然后加入乙醛溶液0.5mL,振荡后加热 | 产生砖红色沉淀 | 醛基具有还原性 |
| C | 将乙醇与浓硫酸共热至170℃所得气体直接通入溴水 | 溴水褪色 | 乙醇发生消去反应的产物为乙烯 |
| D | 将HCl和CaCO3反应后的气体通入苯酚钠溶液中 | 溶液变浑浊 | 碳酸的酸性比苯酚的酸性强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】根据实验操作和和现象得出的结论正确的是
| 选项 | 实验操作和和现象 | 结论 |
| A | 在试管中加入10mL溴水和5mL正己烷。将试管在光照下振荡后静置,溶液分层,上、下两层液体几乎均是无色的,用玻璃棒蘸取浓氨水伸入试管内液面上方,有白烟出现 | 正己烷与溴在光照下发生取代反应 |
| B | 铜与浓硫酸反应后的试管中加蒸馏水稀释,溶液变蓝色 | 铜与浓硫酸反应有CuSO4生成 |
| C | 用铂丝蘸取某溶液在酒精灯外焰上灼烧,火焰呈黄色 | 该溶液中一定含有Na+,不含K+ |
| D | 某溶液中加入AgNO3溶液有白色沉淀生成,加盐酸沉淀不溶解 | 该溶液中一定有Cl- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】SnCl2易水解,是常见的抗氧化剂。实验室以SnCl2为原料制备SnSO4·2H2O的流程如下:

下列说法错误的是

下列说法错误的是
| A.溶解时,不可将SnCl2固体直接溶解在水里 |
B.反应1的离子方程式为Sn2++ =SnO↓+H++CO2↑ =SnO↓+H++CO2↑ |
| C.可用HNO3酸化的AgNO3溶液检验SnO沉淀是否已被洗涤干净 |
| D.操作1为蒸发浓缩、冷却结晶、过滤、洗涤、干燥 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】某无色透明溶液中可能含有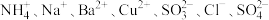 中的几种、取 100mL溶液,向其中加入少量溴水,溶液仍呈无色,继续滴加足量盐酸和Ba(NO3)2混合,产生沉淀,沉淀经洗涤、高温干燥后质量为4.66g。滤液加足量NaOH、加热、生成气体在标准状况下体积为 1120mL。以下推测正确的是
中的几种、取 100mL溶液,向其中加入少量溴水,溶液仍呈无色,继续滴加足量盐酸和Ba(NO3)2混合,产生沉淀,沉淀经洗涤、高温干燥后质量为4.66g。滤液加足量NaOH、加热、生成气体在标准状况下体积为 1120mL。以下推测正确的是
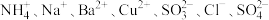 中的几种、取 100mL溶液,向其中加入少量溴水,溶液仍呈无色,继续滴加足量盐酸和Ba(NO3)2混合,产生沉淀,沉淀经洗涤、高温干燥后质量为4.66g。滤液加足量NaOH、加热、生成气体在标准状况下体积为 1120mL。以下推测正确的是
中的几种、取 100mL溶液,向其中加入少量溴水,溶液仍呈无色,继续滴加足量盐酸和Ba(NO3)2混合,产生沉淀,沉淀经洗涤、高温干燥后质量为4.66g。滤液加足量NaOH、加热、生成气体在标准状况下体积为 1120mL。以下推测正确的是A.原溶液中肯定存在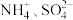 |
B.原溶液中一定不含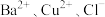 |
C.原溶液中可能存在 Na⁺、 |
| D.另取试液滴加足量盐酸、BaCl2溶液,即可确定离子组成 |
您最近一年使用:0次

 、
、 溶液的性质。
溶液的性质。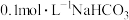 溶液的
溶液的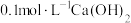 溶液等体积混合,产生白色沉淀
溶液等体积混合,产生白色沉淀 产生白色沉淀,溶液
产生白色沉淀,溶液

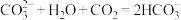
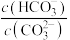 的值增大
的值增大