人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
【配制KMnO4标准溶液】如图所示是配制50 mL KMnO4标准溶液的过程示意图。
(1)请你观察图示判断,其中不正确的操作有______ (填序号)。
(2)其中确定50 mL溶液体积的容器是______ (填名称)。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将_____ (填“偏大”或“偏小”)。
【测定血液样品中Ca2+的浓度】抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4反应的离子方程式为2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O,则方程式中的x=______ 。
(5)经过计算,血液样品中Ca2+的浓度为_____ mg/cm3。
【配制KMnO4标准溶液】如图所示是配制50 mL KMnO4标准溶液的过程示意图。
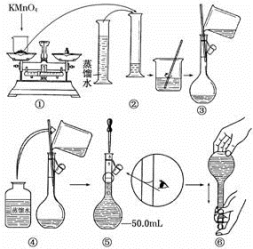
(1)请你观察图示判断,其中不正确的操作有
(2)其中确定50 mL溶液体积的容器是
(3)如果用图示的操作配制溶液,所配制的溶液浓度将
【测定血液样品中Ca2+的浓度】抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4反应的离子方程式为2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O,则方程式中的x=
(5)经过计算,血液样品中Ca2+的浓度为
15-16高一上·江苏淮安·期末 查看更多[27]
吉林省汪清县汪清四中2020-2021学年高二下学期期末考试化学试题湖南省长沙市南雅中学2021-2022学年高一上学期第三次(12月)月考化学试题福建省建瓯市芝华中学2022-2023学年高三上学期暑期考试化学试题江苏省马坝高级中学2022-2023学年高三上学期第一次检测化学试题山东省滨州市博兴县第二中学2021-2022学年高三上学期第一次月考化学试题吉林省通化县综合高级中学2019-2020学年高二下学期期末考试化学试题新疆呼图壁县第一中学2020-2021学年高三上学期9月月考化学试题安徽省六安市城南中学2021届高三上学期第二次月考化学试题吉林省油田高级中学2019-2020学年高一上学期期中考试化学试题湖南省宁乡市第一高级中学2021届高三上学期11月摸底考试化学试题黑龙江省伊春市伊美区第二中学2021届高三上学期开学考试化学试题安徽省太和第一中学2021届高三上学期第一次校本教材反馈测试化学试题甘肃省白银市会宁县第四中学2021届高三上学期第一次月考化学试题宁夏吴忠市青铜峡市高级中学2021届高三上学期开学考试化学试题吉林省实验中学2019-2020学年高二下学期期末考试化学试题吉林省长春市实验中学2019-2020学年高二下学期期末考试化学试题(已下线)考点02 物质的量——《备战2020年高考精选考点专项突破题集》山东省泰安市宁阳县第一中学2020届高三上学期第二次段考化学试题山东省泰安市第一中学2020届高三10月月考化学试题福建省泉州第一中学2018-2019学年高二第二学期期末考试化学试题百所名校联考-从实验学化学吉林省吉林市第五十五中学2018-2019学年高二下学期期末考试化学试题【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第二次月考化学试题(已下线)2019高考热点题型和提分秘籍 第一章 物质的量 第2讲 物质的量在化学实验中的应用( 题型专练)陕西省渭南市尚德中学2019届高三上学期第一次教学质量检测化学试题2018版化学(苏教版)高考总复习专题一课时跟踪训练:物质的量浓度及其溶液的配制2015-2016学年江苏省淮阴中学高一上学期期末化学试卷
更新时间:2017-08-20 19:22:15
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e- =Cu2+,还原反应式:2Fe3++2e- =2Fe2+。据此,回答下列问题:
(1)将反应3NO2+H2O=2H++2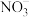 +NO拆写为两个“半反应式”:
+NO拆写为两个“半反应式”:
氧化反应式:_______ 。还原反应式:_______ 。
(2)某化学反应的反应物和产物如下:Al+NaNO3+H2O Al(OH)3+N2+NaAlO2
Al(OH)3+N2+NaAlO2
①该反应的氧化剂是_______ 。
②该反应的氧化产物是_______ 。
③配平该反应的化学方程式_______ 。
④反应过程中转移300个e-,生成_______ 个N2。
(1)将反应3NO2+H2O=2H++2
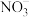 +NO拆写为两个“半反应式”:
+NO拆写为两个“半反应式”:氧化反应式:
(2)某化学反应的反应物和产物如下:Al+NaNO3+H2O
 Al(OH)3+N2+NaAlO2
Al(OH)3+N2+NaAlO2①该反应的氧化剂是
②该反应的氧化产物是
③配平该反应的化学方程式
Al+ NaNO3+ H2O Al(OH)3+ N2+ NaAlO2
Al(OH)3+ N2+ NaAlO2
④反应过程中转移300个e-,生成
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】溴及其化合物广泛应用于有机合成、化学分析等领域。海水提溴过程中溴元素的变化如下:

(1)过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气,生成Br2。Cl2氧化Br-应在_______ 条件下进行,目的是避免_______ 。 调节海水pH可提高Cl2的利用率,用平衡原理解释其原因是_______ 。
(2)过程Ⅱ,用热空气可将溴吹出,其原因是_______ ;再用浓碳酸钠溶液吸收。完成并配平下列方程式_______ 。
_______Br2 + _______Na2CO3 → _______NaBrO3 + _______CO2 + _______
(3)过程Ⅲ,用硫酸酸化可得Br2和Na2SO4的混合溶液。相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是_______ 。
(4)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
则原溶液中NaI的物质的量为_______ mol。

(1)过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气,生成Br2。Cl2氧化Br-应在
(2)过程Ⅱ,用热空气可将溴吹出,其原因是
_______Br2 + _______Na2CO3 → _______NaBrO3 + _______CO2 + _______
(3)过程Ⅲ,用硫酸酸化可得Br2和Na2SO4的混合溶液。相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是
(4)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
| 粒子 | I2 | Br2 | IO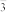 |
| 物质的量/mol | 0.5 | 1.3 |
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】含硫化合物在自然界中广泛存在。请按要求回答下列问题:
(1)火山喷发产生 在大气中发生如下反应:
在大气中发生如下反应:
①

②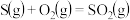
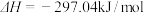 。
。
写出 与
与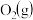 反应产生
反应产生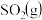 和
和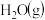 的热化学方程式:
的热化学方程式:_________________ 。
(2) 和
和 混合加热的反应是
混合加热的反应是
①某温度下,在 恒容密闭容器中,通入
恒容密闭容器中,通入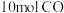 和
和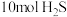 ,平衡时测得
,平衡时测得 的转化率为60%,则该温度下反应的平衡常数
的转化率为60%,则该温度下反应的平衡常数
__________ 。
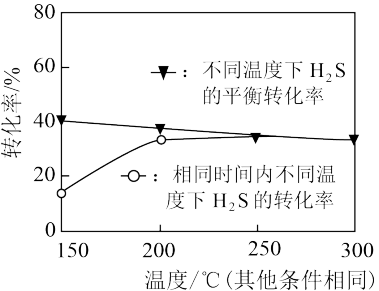
②由图分析该反应的
______ 0(填“<”“>”)。
③如图250℃以前,曲线 变化的可能原因:
变化的可能原因:_____________ 。
(3)工业上可用 碱性溶液脱硫,吸收大气污染物之一
碱性溶液脱硫,吸收大气污染物之一 。
。
①该反应的离子方程式为_______________________________ 。
②用 作催化剂,催化该反应的过程如图示:
作催化剂,催化该反应的过程如图示:
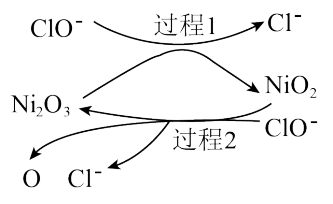
过程2中, 所起的作用是
所起的作用是______________________________ 。(填“氧化剂”“还原剂”或“既作氧化剂又作还原剂”)。
(4)不同温度下 溶液与
溶液与 酸性溶液反应速率的探究:均取
酸性溶液反应速率的探究:均取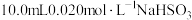 溶液(含少量淀粉)与
溶液(含少量淀粉)与 (过量)酸性溶液混合(已知:
(过量)酸性溶液混合(已知: ),做不同温度下系列实验,
),做不同温度下系列实验,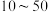 ℃间溶液由无色变蓝的时间,55℃未观察到溶液变蓝,实验记录结果如图所示:
℃间溶液由无色变蓝的时间,55℃未观察到溶液变蓝,实验记录结果如图所示:
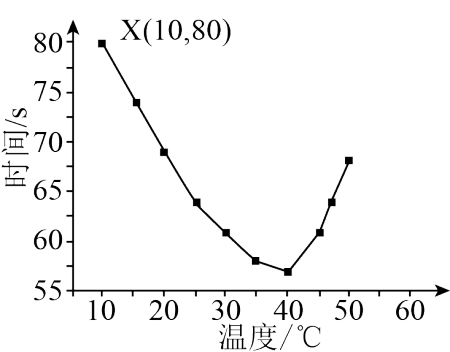
①X点 的反应速率为
的反应速率为______ 。
②40℃之前溶液由无色变蓝速率变快的主要因素是__________________ ;40℃之后溶液由无色变蓝的时间变长,且55℃未观察到溶液变蓝,可能的原因是__________________ 。
(1)火山喷发产生
 在大气中发生如下反应:
在大气中发生如下反应:①


②
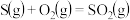
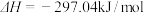 。
。写出
 与
与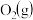 反应产生
反应产生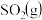 和
和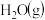 的热化学方程式:
的热化学方程式:(2)
 和
和 混合加热的反应是
混合加热的反应是
①某温度下,在
 恒容密闭容器中,通入
恒容密闭容器中,通入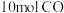 和
和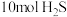 ,平衡时测得
,平衡时测得 的转化率为60%,则该温度下反应的平衡常数
的转化率为60%,则该温度下反应的平衡常数
②由图分析该反应的

③如图250℃以前,曲线
 变化的可能原因:
变化的可能原因:
(3)工业上可用
 碱性溶液脱硫,吸收大气污染物之一
碱性溶液脱硫,吸收大气污染物之一 。
。①该反应的离子方程式为
②用
 作催化剂,催化该反应的过程如图示:
作催化剂,催化该反应的过程如图示:
过程2中,
 所起的作用是
所起的作用是(4)不同温度下
 溶液与
溶液与 酸性溶液反应速率的探究:均取
酸性溶液反应速率的探究:均取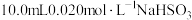 溶液(含少量淀粉)与
溶液(含少量淀粉)与 (过量)酸性溶液混合(已知:
(过量)酸性溶液混合(已知: ),做不同温度下系列实验,
),做不同温度下系列实验,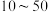 ℃间溶液由无色变蓝的时间,55℃未观察到溶液变蓝,实验记录结果如图所示:
℃间溶液由无色变蓝的时间,55℃未观察到溶液变蓝,实验记录结果如图所示:
①X点
 的反应速率为
的反应速率为②40℃之前溶液由无色变蓝速率变快的主要因素是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了4 种实验方案:
方案1.取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。
(1)实验时所需的定量实验仪器为___________ ,判断是否达到恒重的标准是___________ 。
方案2.用0.100mol/L 盐酸滴定。具体过程如图:
(2)操作1 所需要的仪器有______________________ 。
(3)操作2 时选择的指示剂为甲基橙, 当溶液___________ 时,说明达到了操作2 终点。
(4)为减少实验的偶然误差,通常的处理办法是______________________ 。
(5)操作2 时若锥形瓶内有少量液体溅出,则测定结果___________ ;若盛装待测液的锥形瓶未用待测液润洗,测定结果___________ (“偏低”或“无影响” )。
方案3.用稀酸将CO32-转化为CO2测定CO2的质量。实验装直如图:
操作步骤有:①检查装直的气密性;②在干燥管内装满碱石灰,称量质量为m1g;①称量a g 样品装入广口瓶B 中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓在空气数分钟,再称量干燥管,质量为m2 g。
(6)该方案样品中纯碱的质量分数为_____ (用代数式表示)。
(7)有同学认为空气中的水蒸气会进入干燥管导致测量结果______ (选填“偏高”、“偏低”、“无影响” )。改进措施可以是___ 。
方案4.用稀酸将CO32-转化为CO2,测定CO2的体积。
(8)下列装置中,适合该方案的是____ (选填序号)。
A.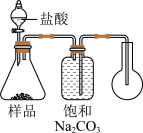 B.
B. 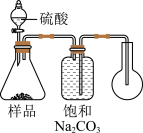 C.
C. 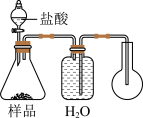 D,
D, 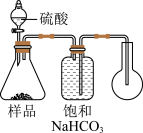
方案1.取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。
(1)实验时所需的定量实验仪器为
方案2.用0.100mol/L 盐酸滴定。具体过程如图:

(2)操作1 所需要的仪器有
(3)操作2 时选择的指示剂为甲基橙, 当溶液
(4)为减少实验的偶然误差,通常的处理办法是
(5)操作2 时若锥形瓶内有少量液体溅出,则测定结果
方案3.用稀酸将CO32-转化为CO2测定CO2的质量。实验装直如图:
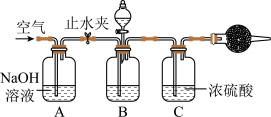
操作步骤有:①检查装直的气密性;②在干燥管内装满碱石灰,称量质量为m1g;①称量a g 样品装入广口瓶B 中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓在空气数分钟,再称量干燥管,质量为m2 g。
(6)该方案样品中纯碱的质量分数为
(7)有同学认为空气中的水蒸气会进入干燥管导致测量结果
方案4.用稀酸将CO32-转化为CO2,测定CO2的体积。
(8)下列装置中,适合该方案的是
A.
 B.
B.  C.
C.  D,
D, 
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氯化铜在工农业生产中具有重要的用途。某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。已知:SOCl2的熔点为-105℃,沸点为76℃,遇水剧烈水解生成两种酸性气体。回答下列问题:

(1)在空气中直接加热CuCl2·2H2O晶体得不到纯净的无水CuCl2的原因是___________________ (用化学方程式表示)。
(2)仪器a的名称是____________ ,锥形瓶中得到的物质x的化学式为______________ 。
(3)碱石灰中含有CaO和NaOH,NaOH的电子式为__________ ,碱石灰的作用是______________ 。
(4)三颈烧瓶中CuCl2·2H2O和SOCl2发生反应的化学方程式是_______________________ 。
(5)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取 0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL(滴定反应为I2+2S2O32-=S4O42-+2I-)。
①滴定到终点时的现象是_____________________________________ 。
②该试样中铜元素的百分含量为__________ 。

(1)在空气中直接加热CuCl2·2H2O晶体得不到纯净的无水CuCl2的原因是
(2)仪器a的名称是
(3)碱石灰中含有CaO和NaOH,NaOH的电子式为
(4)三颈烧瓶中CuCl2·2H2O和SOCl2发生反应的化学方程式是
(5)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取 0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL(滴定反应为I2+2S2O32-=S4O42-+2I-)。
①滴定到终点时的现象是
②该试样中铜元素的百分含量为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】FeCl3、FeCl2在工业生产中有很多用途,其中FeCl2是一种常用的还原剂、媒染剂,某实验小组用如下两种方法来制备无水FeCl2。有关物质的性质如下:
(1)用H2还原无水FeCl3制取FeCl2。有关装置如图1所示:
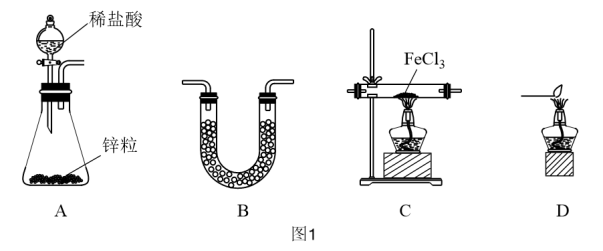
①A装置中装锌粒的仪器名称是___________ 。
②H2还原无水FeCl3制取FeCl2的化学方程式为___________ 。
③按气流由左到右的方向,上述仪器的连接顺序为___________ (填字母,装置可多次使用)。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按图2装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
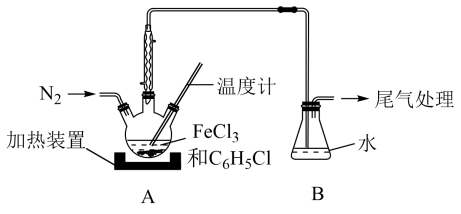
①仪器a的作用是___________ 。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品,回收滤液中C6H5Cl的操作方法是___________ 。
③在反应开始之前先通一段时间N2的目的是___________ ,在反应完成后继续通一段时间N2的作用是___________ 。
④反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol•L-1NaOH溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为19.50mL、20.50mL、19.70mL,则氯化铁的转化率为___________ 。
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H2Cl2、苯,易溶于乙醇,易吸水 | ||
| 熔点/℃ | -45 | 53 | 易升华 | |
| 沸点/℃ | 132 | 173 | ||

①A装置中装锌粒的仪器名称是
②H2还原无水FeCl3制取FeCl2的化学方程式为
③按气流由左到右的方向,上述仪器的连接顺序为
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按图2装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

①仪器a的作用是
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品,回收滤液中C6H5Cl的操作方法是
③在反应开始之前先通一段时间N2的目的是
④反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol•L-1NaOH溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为19.50mL、20.50mL、19.70mL,则氯化铁的转化率为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】分类是认识和研究物质及其变化的一种常用的科学方法。依据物质类别和元素价态可以对物质的性质进行解释和预测。
(1)阅读资料,回答下列相关问题。
资料:人们常用“84”消毒液进行消毒。“84”消毒液的名称源于北京某医院在1984年研制成功的一种高效含氯消毒液。“84”消毒液呈无色或淡黄色,可由 与NaOH溶液反应制得,其主要成分为NaClO、NaCl。
与NaOH溶液反应制得,其主要成分为NaClO、NaCl。
①资料涉及的物质中,属于碱的是_______ (填化学式,下同);属于盐的是_______ 。
②实验室中,常用二氧化锰与浓盐酸制取 ,反应的化学方程式为
,反应的化学方程式为_______ 。
③ 与NaOH溶液反应制取“84”消毒液的化学方程式为
与NaOH溶液反应制取“84”消毒液的化学方程式为_______ 。
④“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中 使消毒杀菌能力增强,其中发生的化学反应符合规律:_______+_______=_______+_______。
使消毒杀菌能力增强,其中发生的化学反应符合规律:_______+_______=_______+_______。_______ (填物质类别 )
(2)“84”消毒液需要在阴暗处密封保存,否则容易失效,是因为“84”消毒液会与空气中的 发生反应,生成物会发生
发生反应,生成物会发生_______ (用化学方程式表示)。
(3)“84”消毒液不能与洁厕灵(含盐酸)混用,混用会发生如下反应: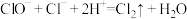 。
。
①该反应中起氧化作用的微粒是_______ 。
②若反应中生成了0.01mol ,转移电子的物质的量为
,转移电子的物质的量为_______ mol。
(4)2016年巴西奥运会期间,工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。可能的原因是NaClO将 氧化,NaClO变成NaCl,失去杀菌能力,产生的
氧化,NaClO变成NaCl,失去杀菌能力,产生的 促进藻类快速生长。写出该反应的化学方程式并用单线桥标出电子转移的方向和数目
促进藻类快速生长。写出该反应的化学方程式并用单线桥标出电子转移的方向和数目_______ 。
(5)实验室要配制480mL 制备“84”消毒液用的NaOH溶液。
制备“84”消毒液用的NaOH溶液。
①实验需要称量的NaOH的质量为_______ g。必须用到的仪器有托盘天平、药匙、玻璃棒、烧杯、胶头滴管和_______ 。
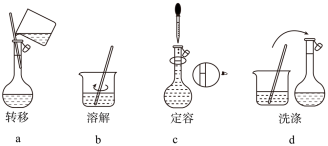
②下列实验操作步骤的顺序为_______ (填字母序号)。
③配制过程中,下列操作会引起所配制溶液浓度偏低的是_______ (填字母序号)。
a.NaOH固体已经潮解
b.定容时,俯视容量瓶刻度
c.未洗涤烧杯和玻璃棒
d.摇匀后,发现液面低于刻度线,继续加水至刻度线
(1)阅读资料,回答下列相关问题。
资料:人们常用“84”消毒液进行消毒。“84”消毒液的名称源于北京某医院在1984年研制成功的一种高效含氯消毒液。“84”消毒液呈无色或淡黄色,可由
 与NaOH溶液反应制得,其主要成分为NaClO、NaCl。
与NaOH溶液反应制得,其主要成分为NaClO、NaCl。①资料涉及的物质中,属于碱的是
②实验室中,常用二氧化锰与浓盐酸制取
 ,反应的化学方程式为
,反应的化学方程式为③
 与NaOH溶液反应制取“84”消毒液的化学方程式为
与NaOH溶液反应制取“84”消毒液的化学方程式为④“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中
 使消毒杀菌能力增强,其中发生的化学反应符合规律:_______+_______=_______+_______。
使消毒杀菌能力增强,其中发生的化学反应符合规律:_______+_______=_______+_______。(2)“84”消毒液需要在阴暗处密封保存,否则容易失效,是因为“84”消毒液会与空气中的
 发生反应,生成物会发生
发生反应,生成物会发生(3)“84”消毒液不能与洁厕灵(含盐酸)混用,混用会发生如下反应:
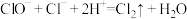 。
。①该反应中起氧化作用的微粒是
②若反应中生成了0.01mol
 ,转移电子的物质的量为
,转移电子的物质的量为(4)2016年巴西奥运会期间,工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。可能的原因是NaClO将
 氧化,NaClO变成NaCl,失去杀菌能力,产生的
氧化,NaClO变成NaCl,失去杀菌能力,产生的 促进藻类快速生长。写出该反应的化学方程式并用单线桥标出电子转移的方向和数目
促进藻类快速生长。写出该反应的化学方程式并用单线桥标出电子转移的方向和数目(5)实验室要配制480mL
 制备“84”消毒液用的NaOH溶液。
制备“84”消毒液用的NaOH溶液。①实验需要称量的NaOH的质量为
②下列实验操作步骤的顺序为

③配制过程中,下列操作会引起所配制溶液浓度偏低的是
a.NaOH固体已经潮解
b.定容时,俯视容量瓶刻度
c.未洗涤烧杯和玻璃棒
d.摇匀后,发现液面低于刻度线,继续加水至刻度线
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】金属及其化合物在人类生产、生活中发挥着重要作用。
(1)中国四大发明之一的指南针由天然磁石制成的,其主要成分是_______(填字母)。
(2)在钢铁厂的生产中,炽热的铁水注入模具之前,必须对模具进行充分的干燥处理,不得留有水,原因是_______ (用化学方程式表示)。
(3)铝制餐具不宜长期存放酸性、碱性或咸的食物,其中Al和NaOH溶液反应的离子方程式是_______
(4)“84消毒液”有效成分是NaClO。某次实验需要使用900mL0.2 mol·L-1的NaClO溶液,欲用NaClO固体配制该溶液,实验中需要称量_______ gNaClO晶体,下图不需要的仪器是_______ (写出仪器名称),若定容时仰视刻度线,则所配溶液浓度_______ 0.2 mol·L-1 (填“>”或“<”)
(5)双氧水能使酸性高锰酸钾溶液褪色,请完成以下相关反应的离子方程式:_______ 。
______ +_____H2O2+______=______Mn2++_____H2O+______
+_____H2O2+______=______Mn2++_____H2O+______
(1)中国四大发明之一的指南针由天然磁石制成的,其主要成分是_______(填字母)。
| A.Fe | B.FeO | C.Fe3O4 | D.Fe2O3 |
(3)铝制餐具不宜长期存放酸性、碱性或咸的食物,其中Al和NaOH溶液反应的离子方程式是
(4)“84消毒液”有效成分是NaClO。某次实验需要使用900mL0.2 mol·L-1的NaClO溶液,欲用NaClO固体配制该溶液,实验中需要称量

(5)双氧水能使酸性高锰酸钾溶液褪色,请完成以下相关反应的离子方程式:
______
 +_____H2O2+______=______Mn2++_____H2O+______
+_____H2O2+______=______Mn2++_____H2O+______
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________ mL的容量瓶。
(2)在量取浓盐酸时宜选用下列量筒中的________ 。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:(将操作补充完整)
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,____________________________________________ 。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)________ 。
(4)若用1mol/L HCl溶液润洗容量瓶,再转移溶液,所配制的溶液浓度将_________ (填“偏大”“偏小”或“无影响”)。
(1)配制稀盐酸时,应选用容量为
(2)在量取浓盐酸时宜选用下列量筒中的
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:(将操作补充完整)
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)
(4)若用1mol/L HCl溶液润洗容量瓶,再转移溶液,所配制的溶液浓度将
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:
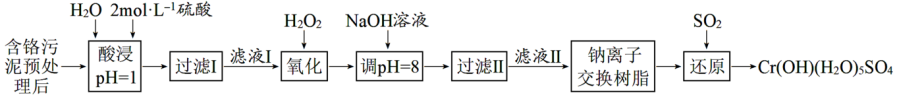
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②Cr2O +H2O
+H2O 2CrO
2CrO +2H+
+2H+
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)实验室用18.4mol·L-1的浓硫酸配制480mL2mol·L-1的硫酸,配制时所用玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需________ 。
(2)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O 转化为
转化为__________ (填微粒的化学式)。
(3)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有_______ 。
(4)写出上述流程中用SO2进行还原时发生反应的离子方程式:____________ 。
(5)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用0.1000mol·L-1 AgNO3标准溶液滴定待测液,已知:
①滴定时可选为滴定指示剂的是_______ (填编号),滴定终点的现象是_________ 。
A.NaCl B.K2CrO4 C.KI D.NaCN
②取某废水25.00mL,滴定终点时消耗AgNO3标准溶液10.00mL,则废水中SCN-的物质的量浓度为______________ 。

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②Cr2O
 +H2O
+H2O 2CrO
2CrO +2H+
+2H+③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9)溶解 |
(1)实验室用18.4mol·L-1的浓硫酸配制480mL2mol·L-1的硫酸,配制时所用玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需
(2)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O
 转化为
转化为(3)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有
(4)写出上述流程中用SO2进行还原时发生反应的离子方程式:
(5)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用0.1000mol·L-1 AgNO3标准溶液滴定待测液,已知:
| 银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白色 | 黄色 | 白色 | 砖红色 | 白色 |
| Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
①滴定时可选为滴定指示剂的是
A.NaCl B.K2CrO4 C.KI D.NaCN
②取某废水25.00mL,滴定终点时消耗AgNO3标准溶液10.00mL,则废水中SCN-的物质的量浓度为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】草酸(H2C2O4)及其盐(其中C的化合价均为+3价)是重要的化工原料,其中最常用的是三草酸合铁酸钾和草酸钴,已知草酸钴不溶于水,三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·3H2O)易溶于水,难溶于乙醇。这两种草酸盐受热均可发生分解等反应,反应及气体产物检验装置如图。
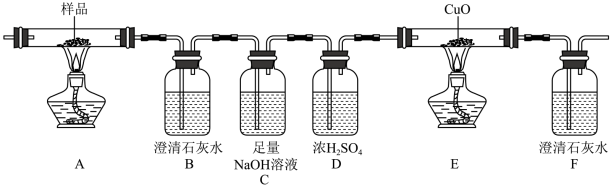
(1)已知草酸钴晶体(CoC2O4·2H2O)在200°C左右可完全失去结晶水,用如图装置在空气中加热草酸(CoC2O4·2H2O,相对分子质量=183)样品,受热过程中在不同温度范围内分别得到一种固体物质,该反应中的氧化剂是_______ 。
(2)用以上装置隔绝空气加热三草酸合铁酸钾晶体可发生分解反应。
①检查装置气密性后,先通一段时间的N2,其目的_______ ;结束实验时,先熄灭酒精灯,继续通入N2至常温。实验过程中观察到B、F中澄清石灰水都变浑浊,E中有红色固体生成,则分解得到的气体产物是_______ 。
②C的作用是_______ 。
(3)已知草酸及其盐中C的化合价均为+3价,三草酸合铁酸钾K3[Fe(C2O4)3]的一种制备流程如图,回答下列问题:
Fe(s)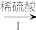 FeSO4(aq)
FeSO4(aq)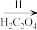 FeC2O4· 2H2O
FeC2O4· 2H2O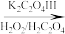 K3[Fe(C2O4)3]
K3[Fe(C2O4)3]
上述I、II、III三步中涉及到氧化还原反应的有_______ 。上述流程得到K3[Fe(C2O4)3]溶液后,加入乙醇,然后进行过滤。加入乙醇的理由是_______

(1)已知草酸钴晶体(CoC2O4·2H2O)在200°C左右可完全失去结晶水,用如图装置在空气中加热草酸(CoC2O4·2H2O,相对分子质量=183)样品,受热过程中在不同温度范围内分别得到一种固体物质,该反应中的氧化剂是
(2)用以上装置隔绝空气加热三草酸合铁酸钾晶体可发生分解反应。
①检查装置气密性后,先通一段时间的N2,其目的
②C的作用是
(3)已知草酸及其盐中C的化合价均为+3价,三草酸合铁酸钾K3[Fe(C2O4)3]的一种制备流程如图,回答下列问题:
Fe(s)
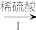 FeSO4(aq)
FeSO4(aq)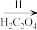 FeC2O4· 2H2O
FeC2O4· 2H2O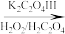 K3[Fe(C2O4)3]
K3[Fe(C2O4)3]上述I、II、III三步中涉及到氧化还原反应的有
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】过硼酸钠(NaBO3•4H2O)是一种用途广泛的无机过氧化物,可用作织物的漂白、染色,医药上可作为消毒剂和杀菌剂。一种由硼镁矿(Mg2B2O5•H2O)制取过硼酸钠的工艺流程图如下:
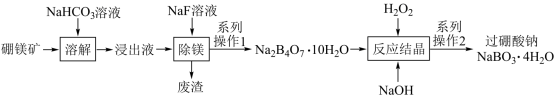
已知:过硼酸钠为白色晶状颗粒,熔点63℃,能溶于酸、碱,微溶于水,难溶于乙醇。在上述转化过程中硼元素的化合价始终未发生变化。回答下列问题:
(1)为加快“溶解”步骤的的速率可采取的措施___ (写一种即可)。
(2)“浸出液”中c(Mg2+)=2×10-3 mol/L,当Mg2+开始沉淀时,溶液中c(F-)=___ mol/L。[忽略溶液体积变化,已知Ksp(MgF2)= 2×10-11]
(3)过硼酸钠(NaBO3•4H2O)中硼元素的化合价为_____ 。
(4)写出“反应结晶”步骤中发生的化学反应方程式_____ 。
(5)“反应结晶”步骤在冰水浴中进行的原因___ 。
(6)过硼酸钠的水溶液不稳定,极易生成偏硼酸钠(NaBO2)并放出氧气,写出该反应的化学反应方程式____ 。
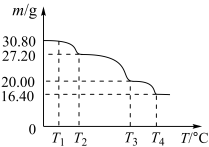
(7)过硼酸钠晶体(NaBO3•4H2O)可用作洗衣业的无氯漂白剂、清洗材料和牙齿增白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T2℃时所得晶体的化学式为___ 。
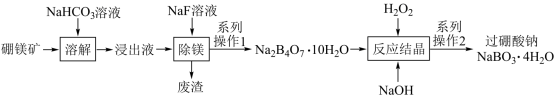
已知:过硼酸钠为白色晶状颗粒,熔点63℃,能溶于酸、碱,微溶于水,难溶于乙醇。在上述转化过程中硼元素的化合价始终未发生变化。回答下列问题:
(1)为加快“溶解”步骤的的速率可采取的措施
(2)“浸出液”中c(Mg2+)=2×10-3 mol/L,当Mg2+开始沉淀时,溶液中c(F-)=
(3)过硼酸钠(NaBO3•4H2O)中硼元素的化合价为
(4)写出“反应结晶”步骤中发生的化学反应方程式
(5)“反应结晶”步骤在冰水浴中进行的原因
(6)过硼酸钠的水溶液不稳定,极易生成偏硼酸钠(NaBO2)并放出氧气,写出该反应的化学反应方程式
(7)过硼酸钠晶体(NaBO3•4H2O)可用作洗衣业的无氯漂白剂、清洗材料和牙齿增白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T2℃时所得晶体的化学式为

您最近半年使用:0次



