查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色) 、Cr(OH)4-(绿色) 、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)铬(24Cr)属于________ (选填编号)。
a.主族元素 b.副族元素 c.Ⅶ族元素 d.过渡元素
(2)CrO42−和Cr2O72−在溶液中可相互转化。室温下,初始浓度为1.0 mol·L−1的Na2CrO4溶液中c(Cr2O72−)随c(H+)的变化如图所示。
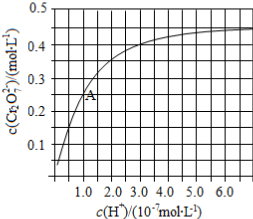
①用离子方程式表示Na2CrO4溶液中的转化反应____________ 。
②由图可知,溶液酸性增大,CrO42−的平衡转化率__________ (填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________ 。
③升高温度,溶液中CrO42−的平衡转化率减小,则该反应的ΔH_________ 0(填“>”“<”或“=”)。
(3)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去。已知:
某含铬废水处理的主要流程如图所示:
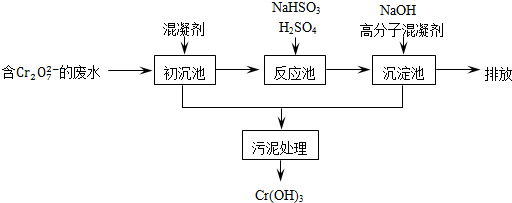
①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,其作用为__________ (用离子方程式表示)。
②反应池中用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为________ ,根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子的先后顺序是____________ ,证明Cr3+沉淀完全的方法是__________ 。
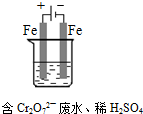
(4)工业可用电解法来处理含 Cr2O72-废水。实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑,Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是__________ ,得到的金属阳离子在阴极区可沉淀完全,用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是__________ g。
(1)铬(24Cr)属于
a.主族元素 b.副族元素 c.Ⅶ族元素 d.过渡元素
(2)CrO42−和Cr2O72−在溶液中可相互转化。室温下,初始浓度为1.0 mol·L−1的Na2CrO4溶液中c(Cr2O72−)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应
②由图可知,溶液酸性增大,CrO42−的平衡转化率
③升高温度,溶液中CrO42−的平衡转化率减小,则该反应的ΔH
(3)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去。已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
某含铬废水处理的主要流程如图所示:

①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,其作用为
②反应池中用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为
(4)工业可用电解法来处理含 Cr2O72-废水。实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑,Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是

更新时间:2017-12-25 10:17:30
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】I.无水四氯化锡(SnCl4)用于制作FTO导电玻璃,FTO导电玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等领域,可用如图所示装置制备四氯化锡。
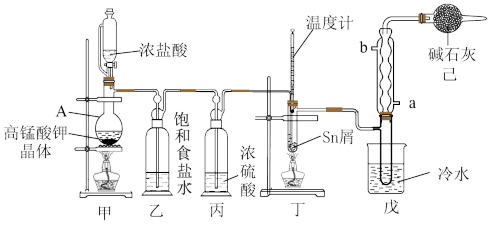
有关信息如下表所示:
(1)仪器A中发生反应的化学方程为_______
(2)将装置按图示连接好,在滴入浓盐酸之前需要什么操作_______ ,待观察到装置丁内充满黄绿色气体后,开始加热装置丁。如果缺少装置乙,装置丁内还可能发生的副反应的化学方程式为_______ ,装置已的作用是_______
II.FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了以下实验:
探究FeBr2的还原性。取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。甲同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
已知:①Br2易溶于有机溶剂四氯化碳(CCl4)且所得溶液呈橙红色;
②四氯化碳(CCl4)不溶于水且密度比水大。
(4)若假设2正确,向FeBr2溶液中通入少许Cl2,反应的离子方程式为_______ 。
(5)乙同学仔细观察发现甲同学做的实验①中,上层溶液呈浅黄色,于是他提出两个自己的观点,请你帮他补充:_______ ;_______ 。

有关信息如下表所示:
| 化学式 | Sn | SnCl2 | SnCl4 |
| 熔点/°C | 232 | 247 | -34 |
| 沸点/°C | 2602 | 623 | 114 |
| 其他性质 | 银白色固体 | 无色晶体,Sn2+易被Fe3+、I2等氧化为Sn4+ | 无色液体,易溶于水并能与水反应 |
(2)将装置按图示连接好,在滴入浓盐酸之前需要什么操作
II.FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了以下实验:
探究FeBr2的还原性。取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。甲同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
已知:①Br2易溶于有机溶剂四氯化碳(CCl4)且所得溶液呈橙红色;
②四氯化碳(CCl4)不溶于水且密度比水大。
| 实验步骤、预期现象 | 结论 |
| ①取适量溶液于试管中,向其中加入 | 假设1正确 |
| ②另取适量溶液于试管中,向其中加入 | 假设2正确 |
(5)乙同学仔细观察发现甲同学做的实验①中,上层溶液呈浅黄色,于是他提出两个自己的观点,请你帮他补充:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】NaClO3可用于制取二氧化氯、亚氯酸钠及高氯酸盐等。以原盐(主要成分为NaCl)为原料制备氯酸钠的工艺流程如下:

已知:Cr2O72-+H2O 2CrO42-+2H+。
2CrO42-+2H+。
回答下列问题:
(1)“粗制盐水”中加入NaOH和Na2CO3的目的是___________________ 。
(2)过滤时,使用的玻璃仪器有烧杯、玻璃棒和____________ 。
(3)在pH:6.4~6.8,温度:40~50℃的条件下电解,理论上最终产物只有NaClO3。电解时阳极的产物为C12,溶液中发生的反应有C12+H2O====HClO+H++C1-,HClO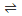 H++C1O-和
H++C1O-和__________ 。
(4)电解槽中温度不宜过高,其原因是_________________________ 。加入的Na2Cr2O7可以调节电解液酸度,若酸度过大,则电解液中主要存在__________ (填“Cr2O72-”或“CrO42-”)。
(5)为检测电解后盐水中NaClO3的物质的量浓度进行下列实验:
I.准确吸取10.00mL电解后的盐水,加入适量的3%H2O2溶液充分搅拌并煮沸。
Ⅱ.准确吸取0.10mol·L-1的(NH4)2Fe(SO4)2标准溶液25.00 mL于300mL锥形瓶中,加入足量稀硫酸。
III.将I的溶液加入Ⅱ的锥形瓶中,隔绝空气煮沸10min,加热充分反应。冷却至室温后,加入10mL0.4mol·L-1MnSO4溶液、5mL 85%磷酸溶液,用c mol·L-1的KMnO4标准溶液滴定剩余的Fe2+至溶液变为微红色,即滴定终点,此时消耗高锰酸钾V mL。
①步骤I中加入H2O2溶液的作用是______________________ 。
②步骤Ⅱ中C1O3-被Fe2+还原为C1-的离子方程式为________________________ 。
③该盐水中NaClO3的物质的量浓度为________ mol·L-1。

已知:Cr2O72-+H2O
 2CrO42-+2H+。
2CrO42-+2H+。回答下列问题:
(1)“粗制盐水”中加入NaOH和Na2CO3的目的是
(2)过滤时,使用的玻璃仪器有烧杯、玻璃棒和
(3)在pH:6.4~6.8,温度:40~50℃的条件下电解,理论上最终产物只有NaClO3。电解时阳极的产物为C12,溶液中发生的反应有C12+H2O====HClO+H++C1-,HClO
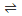 H++C1O-和
H++C1O-和(4)电解槽中温度不宜过高,其原因是
(5)为检测电解后盐水中NaClO3的物质的量浓度进行下列实验:
I.准确吸取10.00mL电解后的盐水,加入适量的3%H2O2溶液充分搅拌并煮沸。
Ⅱ.准确吸取0.10mol·L-1的(NH4)2Fe(SO4)2标准溶液25.00 mL于300mL锥形瓶中,加入足量稀硫酸。
III.将I的溶液加入Ⅱ的锥形瓶中,隔绝空气煮沸10min,加热充分反应。冷却至室温后,加入10mL0.4mol·L-1MnSO4溶液、5mL 85%磷酸溶液,用c mol·L-1的KMnO4标准溶液滴定剩余的Fe2+至溶液变为微红色,即滴定终点,此时消耗高锰酸钾V mL。
①步骤I中加入H2O2溶液的作用是
②步骤Ⅱ中C1O3-被Fe2+还原为C1-的离子方程式为
③该盐水中NaClO3的物质的量浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】将不同类型的矿物协同浸出可以节约原料。
(1)方铅矿(主要成分为PbS,含少量FeS2等)与软锰矿(主要成分为MnO2,含有少量SiO2、Al2O3等)可协同浸出Pb、Mn。协同浸取的过程为:将一定质量比的方铅矿和软锰矿投入足量稀盐酸和NaCl的混合溶液中,控制反应的温度为70℃,并不断搅拌,酸浸后浸出液中含Mn2+、Fe3+、Al3+、 、Cl-,沉淀中含S、难溶矿渣及少量PbCl2。
、Cl-,沉淀中含S、难溶矿渣及少量PbCl2。
已知:i.PbCl2难溶于冷水,可发生反应: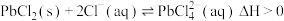 ;
;
ii.室温时Ksp(PbCl2)=1.6×10-5,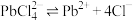 的平衡常数K=3.2×10-2。
的平衡常数K=3.2×10-2。
①写出浸取时生成PbCl2的反应离子方程式:___________ 。
②室温时反应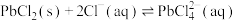 的平衡常数K=
的平衡常数K=________ 。
③其他条件一定,改变起始NaCl的浓度,反应相同时间,测得浸出液中Fe、Mn、Pb的浸出率与起始NaCl的浓度的关系如图所示。NaCl浓度越大,Fe的浸出率越低的原因是________ 。
(2)上述软锰矿与闪锌矿(主要成分为ZnS)可协同浸出Zn、Mn。协同浸取的过程为:将一定质量比的软锰矿和闪锌矿投入足量稀硫酸中,控制反应的温度为80℃,并不断搅拌,酸浸后浸出液中含Mn2+、Zn2+、Al3+、 ,沉淀中含S、难溶矿渣。浸出过程中发现若加入少量FeSO4晶体,可以加快Zn、Mn浸出速率。
,沉淀中含S、难溶矿渣。浸出过程中发现若加入少量FeSO4晶体,可以加快Zn、Mn浸出速率。
①研究表明,FeSO4参与了Zn、Mn的浸出反应,该反应的过程可描述为___________ 。
②加入少量FeSO4可以加快浸出速率的原因是___________ 。
(1)方铅矿(主要成分为PbS,含少量FeS2等)与软锰矿(主要成分为MnO2,含有少量SiO2、Al2O3等)可协同浸出Pb、Mn。协同浸取的过程为:将一定质量比的方铅矿和软锰矿投入足量稀盐酸和NaCl的混合溶液中,控制反应的温度为70℃,并不断搅拌,酸浸后浸出液中含Mn2+、Fe3+、Al3+、
 、Cl-,沉淀中含S、难溶矿渣及少量PbCl2。
、Cl-,沉淀中含S、难溶矿渣及少量PbCl2。已知:i.PbCl2难溶于冷水,可发生反应:
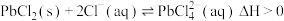 ;
; ii.室温时Ksp(PbCl2)=1.6×10-5,
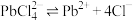 的平衡常数K=3.2×10-2。
的平衡常数K=3.2×10-2。①写出浸取时生成PbCl2的反应离子方程式:
②室温时反应
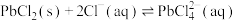 的平衡常数K=
的平衡常数K=③其他条件一定,改变起始NaCl的浓度,反应相同时间,测得浸出液中Fe、Mn、Pb的浸出率与起始NaCl的浓度的关系如图所示。NaCl浓度越大,Fe的浸出率越低的原因是

(2)上述软锰矿与闪锌矿(主要成分为ZnS)可协同浸出Zn、Mn。协同浸取的过程为:将一定质量比的软锰矿和闪锌矿投入足量稀硫酸中,控制反应的温度为80℃,并不断搅拌,酸浸后浸出液中含Mn2+、Zn2+、Al3+、
 ,沉淀中含S、难溶矿渣。浸出过程中发现若加入少量FeSO4晶体,可以加快Zn、Mn浸出速率。
,沉淀中含S、难溶矿渣。浸出过程中发现若加入少量FeSO4晶体,可以加快Zn、Mn浸出速率。①研究表明,FeSO4参与了Zn、Mn的浸出反应,该反应的过程可描述为
②加入少量FeSO4可以加快浸出速率的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】四氧化三锰(Mn3O4)是电子工业的磁性材料,而氯化铅(PbCl2)常用于焊料和助溶剂、制备其他铅盐等。用方铅矿精矿(主要成分为PbS)和软锰矿(主要成分是MnO2,还含有Fe2O3、Al2O3等杂质)制备PbCl2和Mn3O4的工艺流程如下:

已知:PbCl2(s) + 2Cl-(aq)
 ( aq) ΔH > 0
( aq) ΔH > 0
(1)80℃时,为提高方铅矿精矿、软锰矿与盐酸反应的速率,可采取的措施有________ (写出一条即可)。
(2)试剂X是___________ 。(填“化学式”)
(3)用盐酸处理两种矿石粉末,生成MnCl2、PbCl2和S的总反应化学方程式为___________ 。
(4)结合化学用语回答,向酸浸液中加入饱和食盐水的目的是___________ 。
(5)向滤液b中通入NH3和O2发生反应后,总反应的离子方程式为___________ 。
(6)金属锰可以用Mn3O4为原料,通过铝热反应来制备,当生成5.5 kg Mn时,理论上消耗金属铝的质量最少为___________ kg。

已知:PbCl2(s) + 2Cl-(aq)

 ( aq) ΔH > 0
( aq) ΔH > 0(1)80℃时,为提高方铅矿精矿、软锰矿与盐酸反应的速率,可采取的措施有
(2)试剂X是
(3)用盐酸处理两种矿石粉末,生成MnCl2、PbCl2和S的总反应化学方程式为
(4)结合化学用语回答,向酸浸液中加入饱和食盐水的目的是
(5)向滤液b中通入NH3和O2发生反应后,总反应的离子方程式为
(6)金属锰可以用Mn3O4为原料,通过铝热反应来制备,当生成5.5 kg Mn时,理论上消耗金属铝的质量最少为
您最近一年使用:0次
【推荐2】(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1
反应Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2,平衡常数为K2
FeO(s)+H2(g) ΔH2,平衡常数为K2
在不同温度时K1、K2的值如下表:
反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=
CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________ (用ΔH1和ΔH2表示),K=___________ (用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g) CO(g)+H2O(g)是
CO(g)+H2O(g)是________ 反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
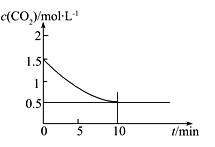
①该条件下反应的平衡常数为___________ ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________ mol·L-1。
②下列措施中能使平衡时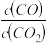 增大的是
增大的是__________ (填序号) 。
A.升高温度 B.增大压强 C.再充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是________ (填字母)。
a. 容器中的压强不变 b.气体的密度不再改变
c. υ正(CO2)=υ逆(CO) d. c(CO2)=c(CO)
e. 容器内气体总物质的量不变
 FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1反应Fe(s)+H2O(g)
 FeO(s)+H2(g) ΔH2,平衡常数为K2
FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
| 700 ℃ | 900 ℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=
CO(g)+H2O(g) ΔH,平衡常数K,则ΔH= CO(g)+H2O(g)是
CO(g)+H2O(g)是(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为
②下列措施中能使平衡时
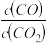 增大的是
增大的是A.升高温度 B.增大压强 C.再充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是
a. 容器中的压强不变 b.气体的密度不再改变
c. υ正(CO2)=υ逆(CO) d. c(CO2)=c(CO)
e. 容器内气体总物质的量不变
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】用下图装置进行SO2转化为SO3的转化率测定实验:2SO2+O2 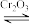 2SO3 △H=-196.6kJ/mol
2SO3 △H=-196.6kJ/mol

(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接1个合适的装置,请从下列A~E中选择适宜的装置,将其序号填入空格内。

Ⅰ_________________ 、Ⅱ_________________ 、Ⅲ____________________ 。
(2)实验前,必须进行的操作是(填操作名称,不必写具体过程)________
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起作用的原理是:___________________________________________________________________________________ 。
(4)从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是________________________________________________________ 。
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,若用大火加热有Cr2O3处的反应管时,SO2的转化率会__________ (填升高、降低或不变)
(6)实验时若用25.2g的Na2SO3,加入的浓硫酸是足量的,反应结束时继续通入O2一段时间,称得Ⅱ处装置的质量增加13.68g,则本实验中SO2的转化率为____________ 。
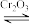 2SO3 △H=-196.6kJ/mol
2SO3 △H=-196.6kJ/mol
(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接1个合适的装置,请从下列A~E中选择适宜的装置,将其序号填入空格内。

Ⅰ
(2)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起作用的原理是:
(4)从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,若用大火加热有Cr2O3处的反应管时,SO2的转化率会
(6)实验时若用25.2g的Na2SO3,加入的浓硫酸是足量的,反应结束时继续通入O2一段时间,称得Ⅱ处装置的质量增加13.68g,则本实验中SO2的转化率为
您最近一年使用:0次
【推荐1】硒(Se)元素位于元素周期表第四周期第VIA族。请回答下列问题:
I.工业上用精炼铜的阳极泥(硒主要以CuSe形式存在,还含有少量Ag、Au)为原料与浓硫酸混合焙烧,将产生的SO2、SeO2混合气体用水吸收即可得Se固体。
(1)写出“混合气体用水吸收”时发生反应的化学方程式_______ 。
(2)下列说法正确的是_______ (填字母)。
A.SeO2可以氧化H2S,但遇到强氧化剂时可能表现还原性
B.热稳定性:H2Se>H2S
C.“焙烧”时的主要反应为:CuSe+4H2SO4(浓) CuSO4+SeO2↑+3SO2↑+4H2O
CuSO4+SeO2↑+3SO2↑+4H2O
II.硒及其氢化物H2Se在新型光伏太阳能电池和金属硒化物方面有重要应用。
(3)已知:①H2Se(g)+1/2O2(g)⇌Se(s)+H2O(l) ΔH1=mKJ•mol−1
②2H2(g)+O2(g)=2H2O(g) ΔH2=nKJ•mol−1
③H2O(g)=H2O(l) ΔH3=pKJ•mol−1
反应H2(g)+Se(s)⇌H2Se(g)的反应热ΔH=_______ kJ•mol−1(用含m、n、p的代数式表示)。
(4)已知常温H2Se的电离平衡常数K1=1.3×10−4,K2=5.0×10−11,则NaHSe溶液的离子浓度由大到小的顺序为_______ 。Ag2SO4在一定条件下可以制备Ag2SeO4已知该条件下Ag2SeO4的Ksp=5.7×10−8,Ag2SO4的的Ksp=1.4×10−5,则反应Ag2SO4(s)+SeO (aq)⇌Ag2SeO4(s)+SO
(aq)⇌Ag2SeO4(s)+SO (aq)的化学平衡常数K=
(aq)的化学平衡常数K=_______ (保留两位有效数字)。
III.研究含硒工业废水的处理工艺,对控制水体中硒超标具有重要意义。
(5)用惰性电极电解弱电解质亚硒酸(H2SeO3)溶液可制得强酸H2SeO4,电解过程中阳极生成2mol产物时,阴极析出标准状态下的气体_______ L。
(6)木炭包覆纳米零价铁除硒法是一种改良的含硒废水处理方法。制备纳米零价铁时,以木炭和FeCl3·6H2O为原料,在N2氛围中迅速升温至600℃,保持2小时,该过程中木炭的作用有吸附和_______ 。木炭包覆纳米零价铁在碱性含硒废水中形成许多微电池,加速SeO 的还原过程。已知SeO
的还原过程。已知SeO 转化为单质Se,写出其对应的电极反应式
转化为单质Se,写出其对应的电极反应式_______ 。
I.工业上用精炼铜的阳极泥(硒主要以CuSe形式存在,还含有少量Ag、Au)为原料与浓硫酸混合焙烧,将产生的SO2、SeO2混合气体用水吸收即可得Se固体。
(1)写出“混合气体用水吸收”时发生反应的化学方程式
(2)下列说法正确的是
A.SeO2可以氧化H2S,但遇到强氧化剂时可能表现还原性
B.热稳定性:H2Se>H2S
C.“焙烧”时的主要反应为:CuSe+4H2SO4(浓)
 CuSO4+SeO2↑+3SO2↑+4H2O
CuSO4+SeO2↑+3SO2↑+4H2OII.硒及其氢化物H2Se在新型光伏太阳能电池和金属硒化物方面有重要应用。
(3)已知:①H2Se(g)+1/2O2(g)⇌Se(s)+H2O(l) ΔH1=mKJ•mol−1
②2H2(g)+O2(g)=2H2O(g) ΔH2=nKJ•mol−1
③H2O(g)=H2O(l) ΔH3=pKJ•mol−1
反应H2(g)+Se(s)⇌H2Se(g)的反应热ΔH=
(4)已知常温H2Se的电离平衡常数K1=1.3×10−4,K2=5.0×10−11,则NaHSe溶液的离子浓度由大到小的顺序为
 (aq)⇌Ag2SeO4(s)+SO
(aq)⇌Ag2SeO4(s)+SO (aq)的化学平衡常数K=
(aq)的化学平衡常数K=III.研究含硒工业废水的处理工艺,对控制水体中硒超标具有重要意义。
(5)用惰性电极电解弱电解质亚硒酸(H2SeO3)溶液可制得强酸H2SeO4,电解过程中阳极生成2mol产物时,阴极析出标准状态下的气体
(6)木炭包覆纳米零价铁除硒法是一种改良的含硒废水处理方法。制备纳米零价铁时,以木炭和FeCl3·6H2O为原料,在N2氛围中迅速升温至600℃,保持2小时,该过程中木炭的作用有吸附和
 的还原过程。已知SeO
的还原过程。已知SeO 转化为单质Se,写出其对应的电极反应式
转化为单质Se,写出其对应的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】Ⅰ.我国力争于2030年前做到碳达峰,2060年前实现碳中和,因此,研发 利用技术,降低空气中二氧化碳含量成为研究重点。以
利用技术,降低空气中二氧化碳含量成为研究重点。以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
①

②
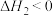
③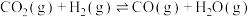
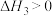
试回答下列问题:
(1)恒温恒容下,向密闭容器按投料比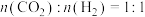 通入原料气,若只发生主反应
通入原料气,若只发生主反应 ,能判断反应处于平衡状态的是___________(填标号)
,能判断反应处于平衡状态的是___________(填标号)
(2)不同压强下,按照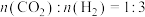 投料,实验测定
投料,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如图所示。
的平衡产率随温度的变化关系如图所示。
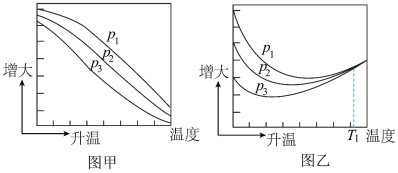
其中纵坐标表示 平衡转化率的是图
平衡转化率的是图___________ (填“甲”或“乙”);压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ 。(已知: 的平衡转化率
的平衡转化率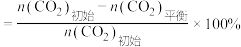 ,
, 的平衡转化率
的平衡转化率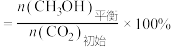 。)
。)
Ⅱ.二氧化碳催化加氢合成乙烯的原理为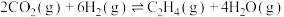 。原料初始组成
。原料初始组成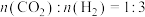 ,体系压强恒定为0.1MPa,不同温度下反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图丙所示:
,体系压强恒定为0.1MPa,不同温度下反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图丙所示:
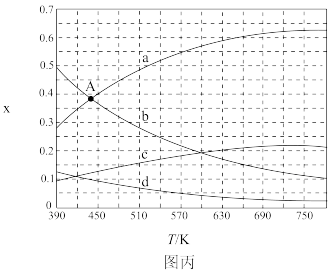
(3)图中表示 、
、 的变化曲线分别是
的变化曲线分别是___________ 、___________ 。
(4) 催化加氢合成
催化加氢合成 反应的
反应的
___________ (填“大于”或“小于”)。
(5)根据图中点A(a、b两线交点),计算该温度时反应的平衡常数
___________  (列出计算式,可不计算出结果,以分压表示,分压=总压×物质的量分数)。
(列出计算式,可不计算出结果,以分压表示,分压=总压×物质的量分数)。
 利用技术,降低空气中二氧化碳含量成为研究重点。以
利用技术,降低空气中二氧化碳含量成为研究重点。以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:①


②

③
试回答下列问题:
(1)恒温恒容下,向密闭容器按投料比
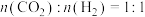 通入原料气,若只发生主反应
通入原料气,若只发生主反应 ,能判断反应处于平衡状态的是___________(填标号)
,能判断反应处于平衡状态的是___________(填标号)A. | B.体系内压强保持不变 |
C. 的体积分数保持不变 的体积分数保持不变 | D.断裂3mol H-H键的同时断裂3mol H-O键 |
(2)不同压强下,按照
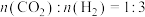 投料,实验测定
投料,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如图所示。
的平衡产率随温度的变化关系如图所示。
其中纵坐标表示
 平衡转化率的是图
平衡转化率的是图 、
、 、
、 由大到小的顺序为
由大到小的顺序为 的平衡转化率
的平衡转化率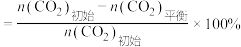 ,
, 的平衡转化率
的平衡转化率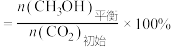 。)
。) Ⅱ.二氧化碳催化加氢合成乙烯的原理为
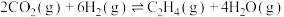 。原料初始组成
。原料初始组成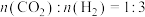 ,体系压强恒定为0.1MPa,不同温度下反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图丙所示:
,体系压强恒定为0.1MPa,不同温度下反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图丙所示:
(3)图中表示
 、
、 的变化曲线分别是
的变化曲线分别是(4)
 催化加氢合成
催化加氢合成 反应的
反应的
(5)根据图中点A(a、b两线交点),计算该温度时反应的平衡常数

 (列出计算式,可不计算出结果,以分压表示,分压=总压×物质的量分数)。
(列出计算式,可不计算出结果,以分压表示,分压=总压×物质的量分数)。
您最近一年使用:0次
【推荐3】Ⅰ.制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为____________________ ;
②下列能提高碳的平衡转化率的措施是____________________ 。
E.将碳研成粉末
Ⅱ.研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量。则石墨与氧气反应生成CO的热化学方程式为:
________________________________________________________________ 。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是:
________________________________________________________________ 。
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图1所示,该电池反应的离子方程式为:_____________________________________________________________ 。
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH__________ (填“>” “<”或“=”)0。
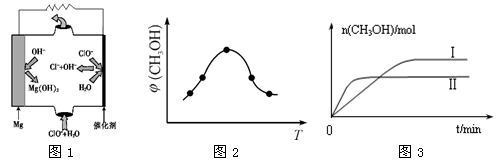
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ 对应的平衡常数大小关系为KⅠ__________________ KⅡ(填“>” “<”或“=”)。
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为____________________ 。
 CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为
②下列能提高碳的平衡转化率的措施是
| A.加入C(s) |
| B.加入H2O(g) |
| C.升高温度 |
| D.增大压强 |
E.将碳研成粉末
Ⅱ.研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量。则石墨与氧气反应生成CO的热化学方程式为:
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是:
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图1所示,该电池反应的离子方程式为:

(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H ①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ 对应的平衡常数大小关系为KⅠ
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】我们要持之以恒,建设天蓝、地绿、水清的中国.水处理技术在生活、生产中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
(1)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行a.杀毒灭菌,b.混凝沉淀,c.过滤等工艺处理,这三项处理的正确顺序是______ (填字母)
②工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH值调到9左右,再加入绿矾,请解释这一做法的原因:______ (用必要的离子方程式和文字描述);
③下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是______ (填字母)
a.福尔马林 b.漂白粉 c.氯气 d.臭氧
④石灰纯碱法是常用的硬水软化方法.已知25℃时Ksp=2.8×10-9,现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为5.6×10-5mol•L-1,则生成沉淀所需Ca(OH)2溶液的最小浓度为______ 。
(2)金属铬污染环境,其主要来源于冶金、水泥等工业产生的废水.某兴趣小组拟定以下流程,对Cr3+、Fe2+等离子的废水进行无公害处理
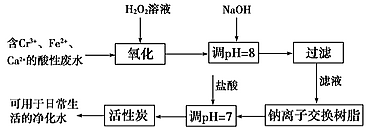
请回答下列问题
①写出加入双氧水后发生反应的离子方程式:______ ;
②过滤操作需要的玻璃仪器是______ ;
③活性炭的作用是______ 。
(1)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行a.杀毒灭菌,b.混凝沉淀,c.过滤等工艺处理,这三项处理的正确顺序是
②工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH值调到9左右,再加入绿矾,请解释这一做法的原因:
③下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是
a.福尔马林 b.漂白粉 c.氯气 d.臭氧
④石灰纯碱法是常用的硬水软化方法.已知25℃时Ksp=2.8×10-9,现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为5.6×10-5mol•L-1,则生成沉淀所需Ca(OH)2溶液的最小浓度为
(2)金属铬污染环境,其主要来源于冶金、水泥等工业产生的废水.某兴趣小组拟定以下流程,对Cr3+、Fe2+等离子的废水进行无公害处理

请回答下列问题
①写出加入双氧水后发生反应的离子方程式:
②过滤操作需要的玻璃仪器是
③活性炭的作用是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】水体中植物营养素过多蓄积会加速藻类和其他浮游生物的大量繁殖,使水质恶化。利用微生物对含氮废水进行处理的流程如下:
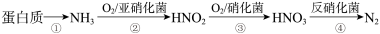
请回答
(1)造成水体富营养化的元素有氮元素和_____ (填字母)。
(2)根据图1和图2,推断使用亚硝化菌的最佳条件为_____ 。
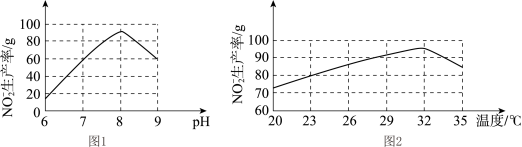
(3)过程③,发生化合反应的化学方程式为_____
(4)利用微生物处理含氮废水的优点为_____
请回答
(1)造成水体富营养化的元素有氮元素和
a.磷元素 b.氧元素
(2)根据图1和图2,推断使用亚硝化菌的最佳条件为

(3)过程③,发生化合反应的化学方程式为
(4)利用微生物处理含氮废水的优点为
您最近一年使用:0次

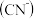 废水处理方案:
废水处理方案: 
 高含氰废水可以通过电解法进行处理,阳极反应分两个阶段,第一阶段电极反应式:
高含氰废水可以通过电解法进行处理,阳极反应分两个阶段,第一阶段电极反应式: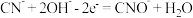 ,请写出第二阶段的电极反应式
,请写出第二阶段的电极反应式 电解后低含氰废水通过化学氧化方法处理:在碱性条件下加入NaClO,将
电解后低含氰废水通过化学氧化方法处理:在碱性条件下加入NaClO,将 氧化为碳酸盐与对环境友好气体。请写出相关离子反应方程式
氧化为碳酸盐与对环境友好气体。请写出相关离子反应方程式

