自上个世纪德国建立了第一套合成氨装置,合成氨工业为解决人类的温饱问题作出了极大贡献。回答下列问题:
(1)已知:①1g H2完全燃烧生成H2O(g)放出121kJ的热量;
②N2(g) +O2(g)==2NO(g)△H =+180.5kJ·mol-1
③4NH3(g) +5O2(g)==4NO(g) +6H2O(g)△H =-906.2kJ·mol-1
工业合成氨的热化学方程式是_________________________________________ 。
(2)应用化石燃料(特别是煤)制备的原料气H2中含有杂质碳(主要成分为CO2)、杂质硫主要成分为H2S)。工业上采用湿法脱硫的方法回收硫,方法是先用纯碱溶液吸收H2S,使之转化为NaHS,然后用偏钒酸钠(NaVO3)溶液氧化硫元素,使之转化为硫单质,并生成焦钒酸钠( Na2V4O9),混法脱硫中发生的氧化还原反应的化学方程式是_________________________ ,反应中转移2×103mol电子时,理论上回收硫_______ kg。
(3)工业上利用NH3为原料合成尿素,其原理是2 NH3(g) +CO2(g) CO(NH2)2(1)+ H2O(g)。①该可逆反应的平衡常数(K)和温度(T)的关系如下:
CO(NH2)2(1)+ H2O(g)。①该可逆反应的平衡常数(K)和温度(T)的关系如下:
合成尿素的反应为_____________ (填“放热反应”或“吸热反应”)。
②合成尿素的原料气中NH3和CO2的物质的量之比称为氨碳比,可用[n(NH3)]/[n(CO2)]表示。在一定温度和压强下,图甲中曲线________ (填“I”或“II”)表示的是氨碳比与CO2的转化率(a)的关系,判断理由是_______________________________ ;当[n(NH3)]/[n(CO2)]=4时,NH3的转化率为_______________ 。

(4)利用特殊的材料,通过电化学法也可以合成氨,如图乙所示原理可利用N2、H2、CO、水蒸气合成氨。阳极反应式是_______________ ,离子交换膜中通过的离子是_____ (填化学符号)。
(1)已知:①1g H2完全燃烧生成H2O(g)放出121kJ的热量;
②N2(g) +O2(g)==2NO(g)△H =+180.5kJ·mol-1
③4NH3(g) +5O2(g)==4NO(g) +6H2O(g)△H =-906.2kJ·mol-1
工业合成氨的热化学方程式是
(2)应用化石燃料(特别是煤)制备的原料气H2中含有杂质碳(主要成分为CO2)、杂质硫主要成分为H2S)。工业上采用湿法脱硫的方法回收硫,方法是先用纯碱溶液吸收H2S,使之转化为NaHS,然后用偏钒酸钠(NaVO3)溶液氧化硫元素,使之转化为硫单质,并生成焦钒酸钠( Na2V4O9),混法脱硫中发生的氧化还原反应的化学方程式是
(3)工业上利用NH3为原料合成尿素,其原理是2 NH3(g) +CO2(g)
 CO(NH2)2(1)+ H2O(g)。①该可逆反应的平衡常数(K)和温度(T)的关系如下:
CO(NH2)2(1)+ H2O(g)。①该可逆反应的平衡常数(K)和温度(T)的关系如下:| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
合成尿素的反应为
②合成尿素的原料气中NH3和CO2的物质的量之比称为氨碳比,可用[n(NH3)]/[n(CO2)]表示。在一定温度和压强下,图甲中曲线

(4)利用特殊的材料,通过电化学法也可以合成氨,如图乙所示原理可利用N2、H2、CO、水蒸气合成氨。阳极反应式是
更新时间:2018-03-22 09:11:24
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】铁及其化合物在生产、生活中有广泛的应用。回答下列问题:
(1)复合氧化物铁酸锰( )可用于热化学循环分解制氢气,原理如下:
)可用于热化学循环分解制氢气,原理如下:
①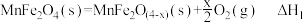 ;
;
②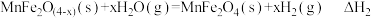 ;
;
③
则
___________ (用 、
、 表示)。
表示)。
(2)用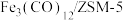 催化
催化 加氢合成低碳烯烃反应,反应过程如图。催化剂中添加助剂Na、K、Cu(也起催化作用)后可改变反应的选择性。
加氢合成低碳烯烃反应,反应过程如图。催化剂中添加助剂Na、K、Cu(也起催化作用)后可改变反应的选择性。
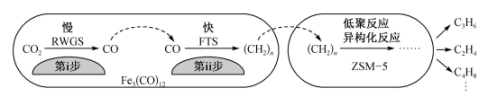
①第i步所发生反应的化学方程式为___________ 。
②下列说法错误的是___________ (填字母)。
A.第i步反应的活化能高于第ii步反应的活化能
B.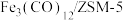 使
使 加氢合成低碳烯烃的
加氢合成低碳烯烃的 减小
减小
C.添加不同助剂后,各反应的平衡常数不变
(3)纳米铁是重要的储氢材料,可用反应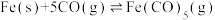 制得。在1 L恒容密闭容器中加入足量铁粉和0.48 mol CO,在
制得。在1 L恒容密闭容器中加入足量铁粉和0.48 mol CO,在 、
、 不同温度下进行反应,测得
不同温度下进行反应,测得 与温度、时间的关系如图所示。
与温度、时间的关系如图所示。
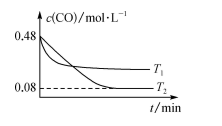
①
___________ (填“>”或“<”,下同) ,
,
___________ 0。
② 温度下,平衡时体系的压强为p,反应的标准平衡常数
温度下,平衡时体系的压强为p,反应的标准平衡常数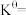
___________ {已知:标准平衡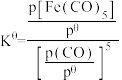 ,其中
,其中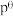 为标准压强(
为标准压强(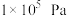 ),
),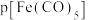 、
、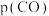 为各组分的平衡分压}。
为各组分的平衡分压}。
(1)复合氧化物铁酸锰(
 )可用于热化学循环分解制氢气,原理如下:
)可用于热化学循环分解制氢气,原理如下:①
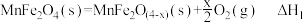 ;
;②
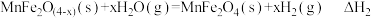 ;
;③

则

 、
、 表示)。
表示)。(2)用
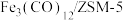 催化
催化 加氢合成低碳烯烃反应,反应过程如图。催化剂中添加助剂Na、K、Cu(也起催化作用)后可改变反应的选择性。
加氢合成低碳烯烃反应,反应过程如图。催化剂中添加助剂Na、K、Cu(也起催化作用)后可改变反应的选择性。
①第i步所发生反应的化学方程式为
②下列说法错误的是
A.第i步反应的活化能高于第ii步反应的活化能
B.
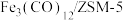 使
使 加氢合成低碳烯烃的
加氢合成低碳烯烃的 减小
减小C.添加不同助剂后,各反应的平衡常数不变
(3)纳米铁是重要的储氢材料,可用反应
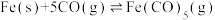 制得。在1 L恒容密闭容器中加入足量铁粉和0.48 mol CO,在
制得。在1 L恒容密闭容器中加入足量铁粉和0.48 mol CO,在 、
、 不同温度下进行反应,测得
不同温度下进行反应,测得 与温度、时间的关系如图所示。
与温度、时间的关系如图所示。
①

 ,
,
②
 温度下,平衡时体系的压强为p,反应的标准平衡常数
温度下,平衡时体系的压强为p,反应的标准平衡常数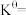
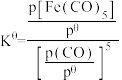 ,其中
,其中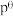 为标准压强(
为标准压强(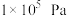 ),
),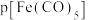 、
、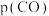 为各组分的平衡分压}。
为各组分的平衡分压}。
您最近一年使用:0次
【推荐2】氯化亚砜(SOCl2)具有很强的氯化能力和脱水能力,在有机合成中具有重要的应用。工业上用硫酸厂尾气中的 SO2与 SCl2、Cl2为原料合成 SOCl2,反应如下:
①SO2(g)+Cl2(g) SO2Cl2(g) ΔH=-471.7 kJ·mol-1
SO2Cl2(g) ΔH=-471.7 kJ·mol-1
②SCl2(g)+SO2Cl2g) 2SOCl2(g) ΔH=-5.6 kJ·mol-1
2SOCl2(g) ΔH=-5.6 kJ·mol-1
回答下列问题:
(1)该条件下,由 SO2(g)、Cl2(g)和 SCl2(g),制备 1 mol SOCl2(g)放出的热量为___ kJ。
(2)一定条件下,在 5 L 的恒容密闭容器中通入一定量的 SO2、SCl2与 Cl2,反应 4min 后达到平衡。若初始压强为 p0,反应过程中容器内总压强(p)随时间(t)变化如下图所示(平衡时温度与初始温度相同)。
容器内各组分物质的量如下表。

I.0-1 min 容器内压强增大的原因为___ 。
II.反应①、②达平衡时,SCl2的平衡转化率为___ 。
III.K 为平衡常数,pK=-lgK,该温度下,反应Ⅱ的 pK =___ (保留两位有效数字,lg2 = 0.30)。
(3)常温下,将 SO2通入到 NaOH溶液中,充分反应后得到 a mol·L-1的 NaHSO3溶液,该溶液的 pH=5的电离常数约为___ (用含 a 的式子表示)。
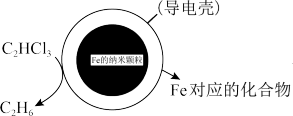
(4)Fe 的纳米颗粒具备优于零价单质的一些新性能,可有效降解多种环境污染物。下图是利用原电池原理除去酸性废水中三氯乙烯的过程,请写出该装置的正极反应式___________ 。
①SO2(g)+Cl2(g)
 SO2Cl2(g) ΔH=-471.7 kJ·mol-1
SO2Cl2(g) ΔH=-471.7 kJ·mol-1②SCl2(g)+SO2Cl2g)
 2SOCl2(g) ΔH=-5.6 kJ·mol-1
2SOCl2(g) ΔH=-5.6 kJ·mol-1回答下列问题:
(1)该条件下,由 SO2(g)、Cl2(g)和 SCl2(g),制备 1 mol SOCl2(g)放出的热量为
(2)一定条件下,在 5 L 的恒容密闭容器中通入一定量的 SO2、SCl2与 Cl2,反应 4min 后达到平衡。若初始压强为 p0,反应过程中容器内总压强(p)随时间(t)变化如下图所示(平衡时温度与初始温度相同)。
容器内各组分物质的量如下表。

| 组分 | SO2 | Cl2 | SCl2 | SO2Cl2 | SOCl2 |
| 起始/mol | 0.25 | 0.25 | 0.25 | 0 | 0 |
| 平衡/mol | 0.1 |
I.0-1 min 容器内压强增大的原因为
II.反应①、②达平衡时,SCl2的平衡转化率为
III.K 为平衡常数,pK=-lgK,该温度下,反应Ⅱ的 pK =
(3)常温下,将 SO2通入到 NaOH溶液中,充分反应后得到 a mol·L-1的 NaHSO3溶液,该溶液的 pH=5的电离常数约为
(4)Fe 的纳米颗粒具备优于零价单质的一些新性能,可有效降解多种环境污染物。下图是利用原电池原理除去酸性废水中三氯乙烯的过程,请写出该装置的正极反应式

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】写出或完成下列热化学方程式。
(1)下列变化过程,属于放热反应的是_______ 。
①浓 稀释;②酸碱中和反应:③
稀释;②酸碱中和反应:③ 在
在 中燃烧;④
中燃烧;④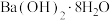 与
与 ;⑤铝热反应:⑧碳高温条件下还原
;⑤铝热反应:⑧碳高温条件下还原 ;⑦碳酸钙分解
;⑦碳酸钙分解
(2)已知:①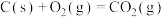
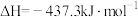
②
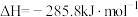
③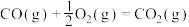
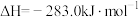
则固态碳和水蒸气反应生成CO和 的热化学方程式为
的热化学方程式为_______ 。
(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
根据键能数据估算下列反应: 的反应热
的反应热 为
为_______ 。
(4)已知稀溶液中,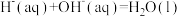
 。
。
①则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出的热量比57.3kJ_______ (填“大”“小”)。若选用硫酸和氢氧化钡的稀溶液做中和热测定实验(操作无误),测定结果
_______ 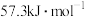 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②某化学兴趣小组用50mL 盐酸、50mL
盐酸、50mL  NaOH溶液进行中和热测定,计算结果
NaOH溶液进行中和热测定,计算结果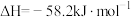 ,其原因可能是:
,其原因可能是:_______ 。
A.盐酸与NaOH溶液混合后立即记录温度
B.分三次将盐酸溶液缓慢倒入NaOH溶液中
C.用量筒量取NaOH溶液时仰视读数
D.使用环形玻璃棒搅拌
③标准状况下,3.36L 仅由C、H两种元素组成的某气体质量为4.5g,在25℃和101kPa下完全燃烧生成 和
和 时,放出233.97kJ的热量。该气体的分子式为
时,放出233.97kJ的热量。该气体的分子式为_______ ,表示该气体摩尔燃烧焓的热化学方程式为_______ 。
④2022年北京冬奥会将用绿氢( )作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
)作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
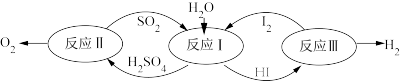
反应Ⅰ: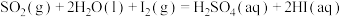

反应Ⅱ: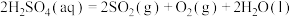
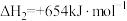
反应Ⅲ: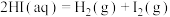
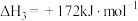
则反应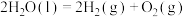

_______ 。
(1)下列变化过程,属于放热反应的是
①浓
 稀释;②酸碱中和反应:③
稀释;②酸碱中和反应:③ 在
在 中燃烧;④
中燃烧;④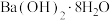 与
与 ;⑤铝热反应:⑧碳高温条件下还原
;⑤铝热反应:⑧碳高温条件下还原 ;⑦碳酸钙分解
;⑦碳酸钙分解(2)已知:①
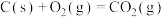
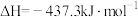
②

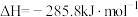
③
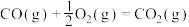
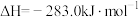
则固态碳和水蒸气反应生成CO和
 的热化学方程式为
的热化学方程式为(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
| 化学键 | C-H | C-F | H-F | F-F |
| 键能kJ/mol | 414 | 489 | 565 | 155 |
 的反应热
的反应热 为
为(4)已知稀溶液中,
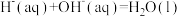
 。
。①则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出的热量比57.3kJ

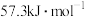 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②某化学兴趣小组用50mL
 盐酸、50mL
盐酸、50mL  NaOH溶液进行中和热测定,计算结果
NaOH溶液进行中和热测定,计算结果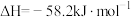 ,其原因可能是:
,其原因可能是:A.盐酸与NaOH溶液混合后立即记录温度
B.分三次将盐酸溶液缓慢倒入NaOH溶液中
C.用量筒量取NaOH溶液时仰视读数
D.使用环形玻璃棒搅拌
③标准状况下,3.36L 仅由C、H两种元素组成的某气体质量为4.5g,在25℃和101kPa下完全燃烧生成
 和
和 时,放出233.97kJ的热量。该气体的分子式为
时,放出233.97kJ的热量。该气体的分子式为④2022年北京冬奥会将用绿氢(
 )作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
)作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
反应Ⅰ:
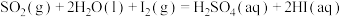

反应Ⅱ:
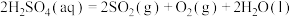
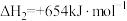
反应Ⅲ:
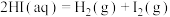
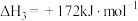
则反应
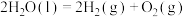

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】CH4-CO2催化重整可以得到合成气(CO和H2),有利于减少温室效应。催化重整时还存在以下反应:
积碳反应:CH4(g)=C(s)+2H2(g) ΔH=+75kJ·mol-1
消碳反应:CO2(g)+C(s)=2CO(g) ΔH=+172kJ·mol-1
(1)写出 CH4-CO2催化重整反应的热化学方程式_________ 。
(2)在刚性容器中,当投料比 时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
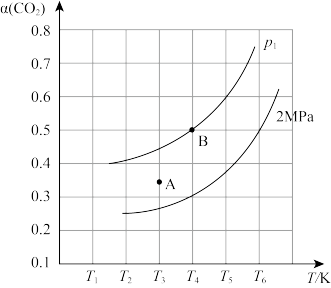
①由图可知,压强p1_________ 2MPa(填“大于”,“小于”或“等于”),理由是_________ 。
②当温度为T3、压强为2MPa时,A点的v正_________ v逆(填“大于”、“小于”或“等于”)。
③起始时向容器中加入1mol CH4和1mol CO2,根据图中点B(T4,0.5),计算该温度时反应的平衡常数Kp=_________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数) (k为速率常数)。
①在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2),pb(CO2),pc(CO2)从大到小的顺序为_________ 。
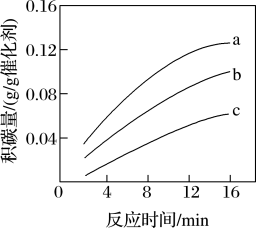
②_________ (填“增大”或“减小”)投料比 ,有助于减少积碳。
,有助于减少积碳。
积碳反应:CH4(g)=C(s)+2H2(g) ΔH=+75kJ·mol-1
消碳反应:CO2(g)+C(s)=2CO(g) ΔH=+172kJ·mol-1
(1)写出 CH4-CO2催化重整反应的热化学方程式
(2)在刚性容器中,当投料比
 时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
①由图可知,压强p1
②当温度为T3、压强为2MPa时,A点的v正
③起始时向容器中加入1mol CH4和1mol CO2,根据图中点B(T4,0.5),计算该温度时反应的平衡常数Kp=
(3)一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数) (k为速率常数)。
①在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2),pb(CO2),pc(CO2)从大到小的顺序为

②
 ,有助于减少积碳。
,有助于减少积碳。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】锇酸钾晶体(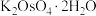 )微溶于冷水,常用作催化剂。由含锇约
)微溶于冷水,常用作催化剂。由含锇约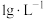 的锇吸收液(主要成分为
的锇吸收液(主要成分为 ,含少量
,含少量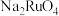 及
及 、
、 杂质)精制提纯锇酸钾的工业流程如下:
杂质)精制提纯锇酸钾的工业流程如下: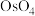 )的熔点为41℃,沸点为130℃,易挥发。回答下列问题:
)的熔点为41℃,沸点为130℃,易挥发。回答下列问题:
(1)“沉锇”得到难溶物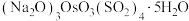 ,该化合物中锇元素的化合价为
,该化合物中锇元素的化合价为_______ 。
(2)检验滤液1和滤液2中金属阳离子的实验方法是_______ 。
(3)“溶解、蒸馏”步骤中,先加入50%硫酸得到 溶液,再加入
溶液,再加入 反应后蒸馏出
反应后蒸馏出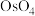 ,生成
,生成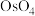 的离子反应方程式为
的离子反应方程式为_______ 。
(4)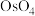 用
用 溶液吸收后又得到
溶液吸收后又得到 溶液,吸收液中仍然存在少量
溶液,吸收液中仍然存在少量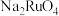 杂质,“吸收、分离”操作加入甲醇的目的是
杂质,“吸收、分离”操作加入甲醇的目的是___________________________________ 。
(5)“转化”时须加入过量 溶液,用平衡原理解释其原因
溶液,用平衡原理解释其原因____________________________ 。
(6)已知: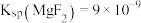 、
、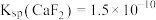 。
。
锇吸收液中 、
、 浓度分别为
浓度分别为 和
和 ,若取1.0L废液,则至少需加入
,若取1.0L废液,则至少需加入_______ g 才能使废液中
才能使废液中 、
、 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。
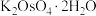 )微溶于冷水,常用作催化剂。由含锇约
)微溶于冷水,常用作催化剂。由含锇约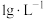 的锇吸收液(主要成分为
的锇吸收液(主要成分为 ,含少量
,含少量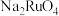 及
及 、
、 杂质)精制提纯锇酸钾的工业流程如下:
杂质)精制提纯锇酸钾的工业流程如下: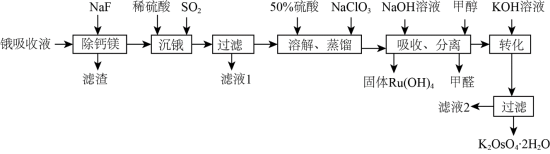
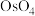 )的熔点为41℃,沸点为130℃,易挥发。回答下列问题:
)的熔点为41℃,沸点为130℃,易挥发。回答下列问题:(1)“沉锇”得到难溶物
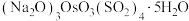 ,该化合物中锇元素的化合价为
,该化合物中锇元素的化合价为(2)检验滤液1和滤液2中金属阳离子的实验方法是
(3)“溶解、蒸馏”步骤中,先加入50%硫酸得到
 溶液,再加入
溶液,再加入 反应后蒸馏出
反应后蒸馏出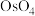 ,生成
,生成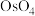 的离子反应方程式为
的离子反应方程式为(4)
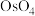 用
用 溶液吸收后又得到
溶液吸收后又得到 溶液,吸收液中仍然存在少量
溶液,吸收液中仍然存在少量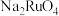 杂质,“吸收、分离”操作加入甲醇的目的是
杂质,“吸收、分离”操作加入甲醇的目的是(5)“转化”时须加入过量
 溶液,用平衡原理解释其原因
溶液,用平衡原理解释其原因(6)已知:
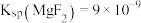 、
、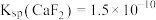 。
。锇吸收液中
 、
、 浓度分别为
浓度分别为 和
和 ,若取1.0L废液,则至少需加入
,若取1.0L废液,则至少需加入 才能使废液中
才能使废液中 、
、 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】亚硝酰氯(NOCl)是有机合成中的重要试剂。实验室中可用如下反应合成。
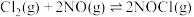

(1)已知 (忽略
(忽略 、
、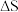 随温度的变化,T为开尔文温度)。上述反应的
随温度的变化,T为开尔文温度)。上述反应的 与温度的关系如下图(该反应的
与温度的关系如下图(该反应的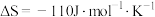 )。
)。

该反应在常温下________ (填“能”或“不能”)自发进行;该反应的
_______  。
。
(2)T°C下,向某真空恒容密闭容器中加入足量的 并充入一定量的NO(g),发生下列反应:
并充入一定量的NO(g),发生下列反应:
反应Ⅰ: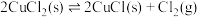

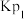
反应Ⅱ:

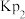
已知:反应Ⅰ、Ⅱ的平衡常数1gKp~T关系如下图:
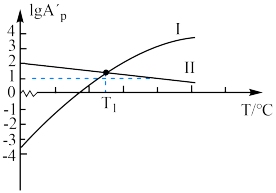
①由图可知,反应Ⅰ反应热
___________ (填“>”或“<”)0。
② °C下,测得起始压强为20kPa,平衡时压强为21kPa,则该温度下NO的平衡转化率为
°C下,测得起始压强为20kPa,平衡时压强为21kPa,则该温度下NO的平衡转化率为_____ %;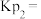
________ 。
(3)向体积均为1L的两恒容容器中分别充入2molNO和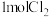 ,发生反应:
,发生反应: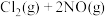
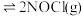 ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。
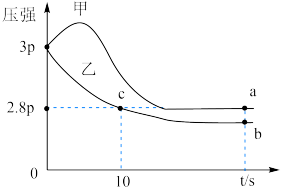
①甲容器中,开始压强变大的原因___________ 。
②乙容器中0~10s内平均反应速率v(NO)=___________  。
。
③a、b、c三点的正反应速率最小的是___________ 点。
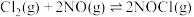

(1)已知
 (忽略
(忽略 、
、 随温度的变化,T为开尔文温度)。上述反应的
随温度的变化,T为开尔文温度)。上述反应的 与温度的关系如下图(该反应的
与温度的关系如下图(该反应的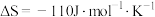 )。
)。
该反应在常温下

 。
。(2)T°C下,向某真空恒容密闭容器中加入足量的
 并充入一定量的NO(g),发生下列反应:
并充入一定量的NO(g),发生下列反应:反应Ⅰ:
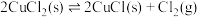

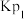
反应Ⅱ:


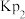
已知:反应Ⅰ、Ⅱ的平衡常数1gKp~T关系如下图:

①由图可知,反应Ⅰ反应热

②
 °C下,测得起始压强为20kPa,平衡时压强为21kPa,则该温度下NO的平衡转化率为
°C下,测得起始压强为20kPa,平衡时压强为21kPa,则该温度下NO的平衡转化率为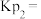
(3)向体积均为1L的两恒容容器中分别充入2molNO和
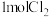 ,发生反应:
,发生反应: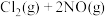
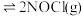 ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。
①甲容器中,开始压强变大的原因
②乙容器中0~10s内平均反应速率v(NO)=
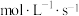 。
。③a、b、c三点的正反应速率最小的是
您最近一年使用:0次
【推荐1】我国在西昌卫星发射“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
I.有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大。
(1)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH1=-543 kJ·mol-1
H2(g)+F2(g)=2HF(g) ΔH2=-538 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH3=-484 kJ·mol-1
则:N2H4(g)+2F2(g)=N2(g)+4HF(g) ΔH4=______ 。
II.氧化剂二氧化氮可由NO和O2生成。800°C时,在2 L密闭容器内,0.200 mol NO与0.100 mol O2反应:2NO(g)+O2(g) 2NO2(g) ΔH的体系中,已知n(NO)随时间的变化如图所示:
2NO2(g) ΔH的体系中,已知n(NO)随时间的变化如图所示:
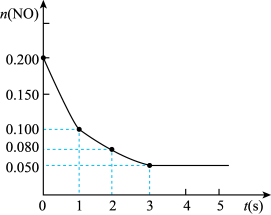
(2)已知:K(800℃)>K(1000℃),则该反应的ΔH______ 0(填“>”或“<”),用NO2表示从0~2 s内该反应的平均速率v(NO2)=______ 。
(3)能说明该反应已达到平衡状态的是______ 。
a.容器内颜色保持不变 b.2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(4)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有______ (任写一条)。
I.有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大。
(1)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH1=-543 kJ·mol-1
H2(g)+F2(g)=2HF(g) ΔH2=-538 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH3=-484 kJ·mol-1
则:N2H4(g)+2F2(g)=N2(g)+4HF(g) ΔH4=
II.氧化剂二氧化氮可由NO和O2生成。800°C时,在2 L密闭容器内,0.200 mol NO与0.100 mol O2反应:2NO(g)+O2(g)
 2NO2(g) ΔH的体系中,已知n(NO)随时间的变化如图所示:
2NO2(g) ΔH的体系中,已知n(NO)随时间的变化如图所示:
(2)已知:K(800℃)>K(1000℃),则该反应的ΔH
(3)能说明该反应已达到平衡状态的是
a.容器内颜色保持不变 b.2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(4)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】亚硝酸氯(ClNO)可由NO与Cl2在通常条件下反应得列,化学方程式为:2NO(g)+Cl2(g) 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率_____ (填增大、减少、不变)。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):
2NO(g) + Cl2(g) 2ClNO(g) △H=-111kJ/mol,则a=
2ClNO(g) △H=-111kJ/mol,则a=_______ 。
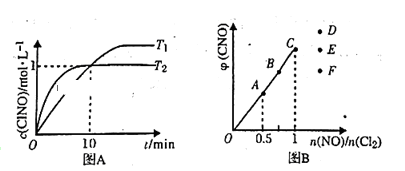
(3)在1L的恒容密闭容器中充入2molNO(g)和1mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
①该反应的△H_____ 0(填“>”“<”或“=”)。
②反应开始到10min 时NO 的平均反应速率v( NO) =________ mol/(L.min).
③T2时该反应的平衡常数K=________ 。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2) 的变化图象如图B,则A、B、C 三状态中,NO 的转化率最大的是___ 点,当n(NO)/n(Cl2) =1.5时,达到平街状态ClNO 的体积分数可能是D、E、F三点中的______ 点。
 2ClNO(g)。
2ClNO(g)。(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ·mol-1 | 630 | 243 | a | 607 |
2NO(g) + Cl2(g)
 2ClNO(g) △H=-111kJ/mol,则a=
2ClNO(g) △H=-111kJ/mol,则a=(3)在1L的恒容密闭容器中充入2molNO(g)和1mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
①该反应的△H
②反应开始到10min 时NO 的平均反应速率v( NO) =
③T2时该反应的平衡常数K=
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2) 的变化图象如图B,则A、B、C 三状态中,NO 的转化率最大的是
您最近一年使用:0次
【推荐3】绿水青山就是金山银山,保护生态环境、建设生态文明是历史发展的需要。氮氧化物易导致酸雨、光化学烟雾等环境问题,消除氮污染已成为人类共识,消除氮氧化物有多种方法:
(1)活性炭还原法。某研究小组向容积均为 2L 的甲(温度为 T1),乙(温度为 T2)两个 恒容密闭容器中充入足量的活性炭和 4mol 的 NO,发生反应C(s)+2NO(g)⇌N2(g)+CO2(g),反应过程中两容器内 CO2的物质的量随时 间的变化关系如图所示。

①ΔH______ 0 (填“>”或“<”),判断的依据___________
②乙容器中反应达到平衡后,再充入 2molNO 和 2mol 的 CO2,此时 v(正)____________ v(逆)(填“>”或“<” 或“=”)。
(2)NH3催化还原法。NH3催化还原法的原理如图所示:

①若烟气中 c(NO2):c(NO)=1:1,发生如图 中所示的脱氮反应,反应过程中转移 2mol 电子时放出的热量为 151.7kJ,则该脱氮反应的热化学方程式为:_________
②如图所示是一定时间内,在不同温度下分别使用催化剂 Mn 和 Cr 时的脱氮率,由此可知工业上使用的最佳催化剂和相应最佳温度分别为________ ;使用 Mn 作催化剂时,脱氮率 a-b 段呈现如图 所示变化的原因可能是_________

(3)电化学法。用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图所示(质子膜允许 H+和 H2O 通过)

①图中电极 I 应该接电源的_________ (填“正极”或“负极”),该电极反应方程式为__________
②吸收塔中每产生 0.5mol HSO ,理论上处理 NO 在标准状况下的体积为
,理论上处理 NO 在标准状况下的体积为______ L
(1)活性炭还原法。某研究小组向容积均为 2L 的甲(温度为 T1),乙(温度为 T2)两个 恒容密闭容器中充入足量的活性炭和 4mol 的 NO,发生反应C(s)+2NO(g)⇌N2(g)+CO2(g),反应过程中两容器内 CO2的物质的量随时 间的变化关系如图所示。

①ΔH
②乙容器中反应达到平衡后,再充入 2molNO 和 2mol 的 CO2,此时 v(正)
(2)NH3催化还原法。NH3催化还原法的原理如图所示:

①若烟气中 c(NO2):c(NO)=1:1,发生如图 中所示的脱氮反应,反应过程中转移 2mol 电子时放出的热量为 151.7kJ,则该脱氮反应的热化学方程式为:
②如图所示是一定时间内,在不同温度下分别使用催化剂 Mn 和 Cr 时的脱氮率,由此可知工业上使用的最佳催化剂和相应最佳温度分别为

(3)电化学法。用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图所示(质子膜允许 H+和 H2O 通过)

①图中电极 I 应该接电源的
②吸收塔中每产生 0.5mol HSO
 ,理论上处理 NO 在标准状况下的体积为
,理论上处理 NO 在标准状况下的体积为
您最近一年使用:0次
【推荐1】氮元素的氢化物和氧化物在工业生产广泛应用,回答下列问题:
(1)肼 N2H4(l)可作为火箭发动机的燃料,与氧化剂 N2O4(g)反应生成N2和水蒸气。
已知:① N2(g) + 2O2(g) = N2O4(g) ΔH1= -19.5 kJ/mol
② N2H4(l) + O2(g) = N2(g) + 2H2O(g) ΔH2= -534.2 kJ/mol
写出N2H4(l)和 N2O4(g)反应的热化学方程式_____ ;
(2)肼—N2O4燃料电池是一种碱性电池, 如图是一种新型燃料电池装置,其总反应方程式为N2H4+O2=N2+2H2O,通入N2H4(肼)的一极是电池的____ (填“正极”或“负极”),该电极的电极反应式为______ 。

(3)在上述燃料电池中,若完全消耗16 g N2H4,则理论上外电路中转移电子的物质的量为_________ mol,电池工作一段时间后电解质溶液的pH________ (填“增大”“减小”或“不变”)
(4)在电化学中,离子交换膜扮演了非常重要的角色,其中阴(阳)离子交换膜只允许阴(阳)离子通过的特性,往往有很多新奇的应用。用如图装置电解Na2SO4溶液, 和
和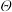 为外电源的正负极。m为
为外电源的正负极。m为_______ 子交换膜(填“阳”或“阴”)。D口产品的化学式是_______ (H2O和气体除外),整个装置中的总反应方程式为________ 。

(1)肼 N2H4(l)可作为火箭发动机的燃料,与氧化剂 N2O4(g)反应生成N2和水蒸气。
已知:① N2(g) + 2O2(g) = N2O4(g) ΔH1= -19.5 kJ/mol
② N2H4(l) + O2(g) = N2(g) + 2H2O(g) ΔH2= -534.2 kJ/mol
写出N2H4(l)和 N2O4(g)反应的热化学方程式
(2)肼—N2O4燃料电池是一种碱性电池, 如图是一种新型燃料电池装置,其总反应方程式为N2H4+O2=N2+2H2O,通入N2H4(肼)的一极是电池的

(3)在上述燃料电池中,若完全消耗16 g N2H4,则理论上外电路中转移电子的物质的量为
(4)在电化学中,离子交换膜扮演了非常重要的角色,其中阴(阳)离子交换膜只允许阴(阳)离子通过的特性,往往有很多新奇的应用。用如图装置电解Na2SO4溶液,
 和
和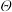 为外电源的正负极。m为
为外电源的正负极。m为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件下可发生如下反应:C2H6(g)=C2H4(g)+H2(g) △H,相关物质的燃烧热数据如表所示:
①△H=______ kJ•mol-1。
②提高该反应平衡转化率的方法有______ 、______ 。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=______ (用含α、p的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH4 C2H6+H2。反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=
C2H6+H2。反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=______ r1。(用含α的代数式表示)。
(3)如图所示装置
①负极的电极反应式_______ 。
②乙装置电镀银,______ (M或N)电极材料选择银,电镀过程中电解质溶液浓度_____ (填变大、变小或不变)。
(1)乙烷在一定条件下可发生如下反应:C2H6(g)=C2H4(g)+H2(g) △H,相关物质的燃烧热数据如表所示:
| 物质 | C2H6(g) | C2H4(g) | H2(g) |
| 燃烧热△H/(kJ•mol-1) | -1560 | -1411 | -286 |
①△H=
②提高该反应平衡转化率的方法有
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=
(2)高温下,甲烷生成乙烷的反应如下:2CH4
 C2H6+H2。反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=
C2H6+H2。反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=(3)如图所示装置

①负极的电极反应式
②乙装置电镀银,
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色,D极石墨棒上有红色的固体生成。请回答:
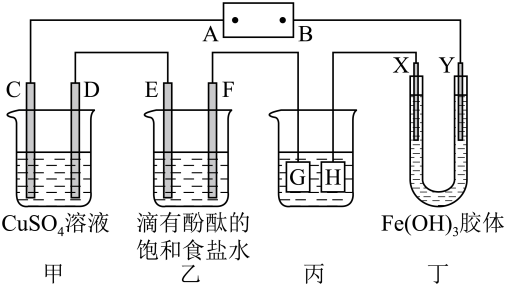
(1)B极是电源的___ 极;
(2)C电极反应式为___ ;
(3)一段时间后,丁装置中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明氢氧化铁胶体粒子带___ 电荷(填“正”或“负”)。
(4)若甲烧杯中D极石墨棒上析出红色的固体质量为6.4g时,则乙烧杯中E电极生成的气体在标况下的体积为___ ;
(5)乙烧杯中电解总反应化学方程式为___ 。

(1)B极是电源的
(2)C电极反应式为
(3)一段时间后,丁装置中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明氢氧化铁胶体粒子带
(4)若甲烧杯中D极石墨棒上析出红色的固体质量为6.4g时,则乙烧杯中E电极生成的气体在标况下的体积为
(5)乙烧杯中电解总反应化学方程式为
您最近一年使用:0次



