常温下,0.1 mol·L−1 H2R溶液中H2R、HR−、R2−三者中所占物质的量分数(分布系数δ)随pH变化的关系如图所示。下列表述正确的是
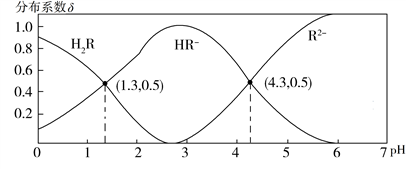

| A.Na2R溶液中:c(Na+)=c(HR−)+2c(R2−) |
B.H2R H++HR−,Ka1=1.0×10−1.3 H++HR−,Ka1=1.0×10−1.3 |
| C.等物质的量的NaHR和Na2R溶于水,使得溶液pH恰好为4.3 |
D.HF的Ka=1.0×10−3.4,在足量NaF溶液中加入少量H2R,发生反应:H2R+2F− 2HF+R2− 2HF+R2− |
2018高三·全国·专题练习 查看更多[3]
夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——弱电解质的电离及影响因素 (强化练习)备考突破2020高三化学专题强化集训——溶液中微粒浓度大小的关系分析(已下线)2018届高三第三次全国大联考(新课标Ⅲ卷)
更新时间:2018-05-18 15:07:33
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】常温下,向VmL0.1mol·L−1的MOH溶液中加入等浓度的盐酸溶液,溶液中由水电离产生的氢离子的−lgc(H+)水随加入盐酸体积的变化如图所示。下列说法正确的是(已知lg2=0.3)
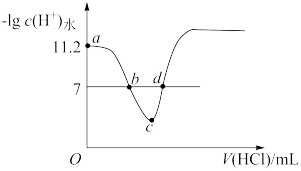

| A.常温下,0.1mol·L−1的MOH溶液溶液的电离平衡常数数量级为10-6 |
B.b点加入盐酸的体积大于 mL mL |
| C.c点溶质为MCl和HCl |
| D.d点溶液中c(M+)=c(Cl−) |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】已知电离常数如下表,则常温下,下列说法正确的是
| 弱酸 | HF | HCN | H2CO3 | NH3·H2O |
| 电离常数(25℃) | 3.53×10-4 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 | 1.8×10-5 |
| A.2CN-+ H2O + CO2 =2HCN + CO32— |
| B.中和等体积等pH的HF溶液和HCN溶液消耗NaOH的量:前者大于后者 |
| C.等浓度的HF溶液和HCN溶液稀释相同倍数后c(H+):前者小于后者 |
| D.等浓度的NaCN和NH4Cl溶液中所含阳离子的物质的量浓度之和:前者小于后者 |
您最近半年使用:0次
单选题
|
较难
(0.4)
【推荐3】常温下,用 盐酸滴定
盐酸滴定 溶液,所得溶液pH、
溶液,所得溶液pH、 和
和 的分布分数
的分布分数 [平衡时某含氮微粒的浓度占含氮微粒总浓度的分数,如
[平衡时某含氮微粒的浓度占含氮微粒总浓度的分数,如 的分布分数
的分布分数 ]与滴加盐酸体积的关系如图所示。下列叙述正确的是
]与滴加盐酸体积的关系如图所示。下列叙述正确的是
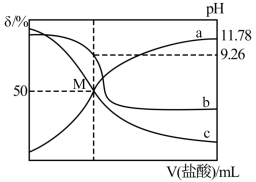
 盐酸滴定
盐酸滴定 溶液,所得溶液pH、
溶液,所得溶液pH、 和
和 的分布分数
的分布分数 [平衡时某含氮微粒的浓度占含氮微粒总浓度的分数,如
[平衡时某含氮微粒的浓度占含氮微粒总浓度的分数,如 的分布分数
的分布分数 ]与滴加盐酸体积的关系如图所示。下列叙述正确的是
]与滴加盐酸体积的关系如图所示。下列叙述正确的是
A.曲线a代表 ,曲线b代表 ,曲线b代表 |
B.M点溶液中存在 |
C. 的电离常数的数量级为 的电离常数的数量级为 |
D.若将 改为等浓度的 改为等浓度的 ,则M点随 ,则M点随 溶液体积的变化上移 溶液体积的变化上移 |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】下列说法正确的是
A.25℃时,水电离出的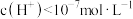 溶液,其pH>7 溶液,其pH>7 |
| B.25℃时,pH=3的HCl与pH=11的MOH溶液混合,测得pH>7,则MOH为弱碱 |
| C.25℃时,若测得HR溶液pH=a,取该溶液10.0mL,滴入10.0mLNaR浓溶液,测得pH=b,b>a,则HR是弱酸 |
D.25℃时,物质的量浓度相等的盐溶液NaX与NaY,若 ,则HX为强酸 ,则HX为强酸 |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下,用 氨水滴定
氨水滴定 浓度均为
浓度均为 的
的 和
和 的混合液,下列说法
的混合液,下列说法不正确 的是
 氨水滴定
氨水滴定 浓度均为
浓度均为 的
的 和
和 的混合液,下列说法
的混合液,下列说法A.在氨水滴定前, 和 和 的混合液中 的混合液中 |
B.当滴入氨水10 mL时,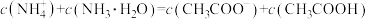 |
C.当滴入氨水20 mL时, |
| D.当溶液呈中性时,氨水滴入量大于20mL |
您最近半年使用:0次

 属于难溶于水、可溶于酸的盐。常温下,用
属于难溶于水、可溶于酸的盐。常温下,用 ,测得在不同
,测得在不同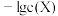 (
( 为
为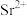 或
或 )与
)与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是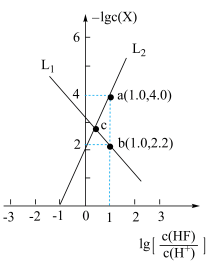
 代表
代表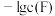 与
与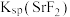 的数量级为
的数量级为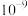

 点的溶液中存在
点的溶液中存在


