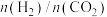(1)已知:①Fe(s)+l/2O2(g)===FeO(s) △H1=—272.0 kJ/mol
②2Al(s)+3/2O2(g)==Al2O3(s) △H2=-1675.7 kJ/mol
A1和FeO发生铝热反应的热化学方程式是________________ 。
(2)如图所示的装置中发生反应2A2(g)+B2(g) 2C(g) △H=-akJ·mol-1(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2molA2和1molB2两容器分别在500℃时达平衡,A中C的浓度为w1mol·L-1,放出热量 bkJ,B中C的浓度为w2mol·L-1,放出热量 ckJ。请回答下列问题:
2C(g) △H=-akJ·mol-1(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2molA2和1molB2两容器分别在500℃时达平衡,A中C的浓度为w1mol·L-1,放出热量 bkJ,B中C的浓度为w2mol·L-1,放出热量 ckJ。请回答下列问题:

①此反应的平衡常数表达式为__________ ;若将温度升高到700℃,反应的平衡常数将____________ (填“增大”、“减小”或“不变”)。
②比较大小:w1________ w2(填“>”、“=”、“<”),a、b、c由大到小的关系___________ 。
③若打开K,一段时间后重新达平衡,容器B的体积将___________ (填“增大”、“减小”或“不变”)。
④若让A,B体积相等且固定P,在B中改充入4mol A2和2mol B2,在500℃时达平衡后C 的浓度为w3mol·L-1,则 w1,w3的关系___________ 。
⑤能说明A中已达到平衡状态的是________ (填序号,有一个或多个选项符合题意)。
A.υ(C)=2υ(B2)
b.容器内气体压强保持不变
c.容器中气体的平均相对分子质量不随时间而变化
d.容器内的气体密度保持不变
②2Al(s)+3/2O2(g)==Al2O3(s) △H2=-1675.7 kJ/mol
A1和FeO发生铝热反应的热化学方程式是
(2)如图所示的装置中发生反应2A2(g)+B2(g)
 2C(g) △H=-akJ·mol-1(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2molA2和1molB2两容器分别在500℃时达平衡,A中C的浓度为w1mol·L-1,放出热量 bkJ,B中C的浓度为w2mol·L-1,放出热量 ckJ。请回答下列问题:
2C(g) △H=-akJ·mol-1(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2molA2和1molB2两容器分别在500℃时达平衡,A中C的浓度为w1mol·L-1,放出热量 bkJ,B中C的浓度为w2mol·L-1,放出热量 ckJ。请回答下列问题:
①此反应的平衡常数表达式为
②比较大小:w1
③若打开K,一段时间后重新达平衡,容器B的体积将
④若让A,B体积相等且固定P,在B中改充入4mol A2和2mol B2,在500℃时达平衡后C 的浓度为w3mol·L-1,则 w1,w3的关系
⑤能说明A中已达到平衡状态的是
A.υ(C)=2υ(B2)
b.容器内气体压强保持不变
c.容器中气体的平均相对分子质量不随时间而变化
d.容器内的气体密度保持不变
更新时间:2019-05-09 18:36:27
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】二氧化碳的资源化利用有利于实现我国提出的2030年“碳达峰”与2060年“碳中和”目标。CCUS(碳捕获、利用与封存)是应对全球气候变化的关键技术之一,可利用捕获的CO、 等原料催化合成甲醇等。涉及的主要反应如下:
等原料催化合成甲醇等。涉及的主要反应如下:
Ⅰ:
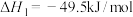
Ⅱ:
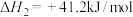
Ⅲ:

回答下列问题:
(1)对于反应Ⅲ,
_____ 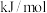 ,活化能
,活化能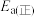
_____ 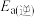 (填“小于”或“大于”)。
(填“小于”或“大于”)。
(2)按反应Ⅰ生产甲醇时,通常会向反应体系中加入适量炭粉,可能的理由是_____ 。
(3)下列有关说法正确的是_____。
(4)一定条件下,在 密闭容器中加入
密闭容器中加入 和
和 只发生反应Ⅱ:
只发生反应Ⅱ: ,如图是随着反应的进行,
,如图是随着反应的进行, 的浓度随时间改变的变化图。若在
的浓度随时间改变的变化图。若在 时刻再加入
时刻再加入 ,
, 时刻到达新的平衡。请你画出
时刻到达新的平衡。请你画出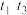 时刻
时刻 的物质的量浓度随时间改变的变化图
的物质的量浓度随时间改变的变化图_____ 。 可在酸性介质中通过电解生成
可在酸性介质中通过电解生成 ,则生成
,则生成 的电极反应式是
的电极反应式是_____ 。
 等原料催化合成甲醇等。涉及的主要反应如下:
等原料催化合成甲醇等。涉及的主要反应如下:Ⅰ:

Ⅱ:

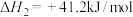
Ⅲ:


回答下列问题:
(1)对于反应Ⅲ,

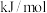 ,活化能
,活化能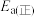
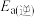 (填“小于”或“大于”)。
(填“小于”或“大于”)。(2)按反应Ⅰ生产甲醇时,通常会向反应体系中加入适量炭粉,可能的理由是
(3)下列有关说法正确的是_____。
| A.升高温度,反应Ⅰ逆反应速率增加,平衡常数减小 |
B.反应Ⅰ分别在恒温恒容的密闭容器与恒温恒压的密闭容器中进行,前者 的平衡转化率高 的平衡转化率高 |
C.恒温恒容的密闭容器中反应Ⅰ已达平衡,再加入一定量的 和 和 , , 和 和 的转化率可能同时都增大 的转化率可能同时都增大 |
| D.加入对反应Ⅱ催化效果更佳的催化剂,可以提高CO的平衡产率 |
(4)一定条件下,在
 密闭容器中加入
密闭容器中加入 和
和 只发生反应Ⅱ:
只发生反应Ⅱ: ,如图是随着反应的进行,
,如图是随着反应的进行, 的浓度随时间改变的变化图。若在
的浓度随时间改变的变化图。若在 时刻再加入
时刻再加入 ,
, 时刻到达新的平衡。请你画出
时刻到达新的平衡。请你画出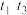 时刻
时刻 的物质的量浓度随时间改变的变化图
的物质的量浓度随时间改变的变化图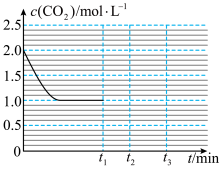
 可在酸性介质中通过电解生成
可在酸性介质中通过电解生成 ,则生成
,则生成 的电极反应式是
的电极反应式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。

活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是_____________________ 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择_________________ (填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是_______________ 。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2=Fe+2Li2S,正极反应式是___________ 。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s)∆H=-1648kJ/mol
C(s)+O2(g)=CO2(g)∆H =-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)∆H =-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______________ 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3___________ kg。

活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2=Fe+2Li2S,正极反应式是
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s)∆H=-1648kJ/mol
C(s)+O2(g)=CO2(g)∆H =-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)∆H =-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】甲醇是一种清洁能源。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g),△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+ H2O(g),△H2
(1)在一定条件下将1molCO和4molH2充入2L的密闭容器中发生反应I,5min后测得c(H2)=1.2 mol/L,计算此段时间的反应速率(用H2表示)______ mol/(L·min)。
(2)反应CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3=______ (用△H1和△H2表示)。
(3)若容器容积不变,下列措施可提高反应Ⅱ的反应速率的是(选字母)______ 。
a.充入CO2,使体系总压强增大 b.将CH3OH(g)从体系中分离出来
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡向______ (填“正向”、“逆向”或“不”)移动,平衡常数K______ (填“变大”、“变小”或“不变”)。
(5)这两种合成甲醇的方法比较,原子利用率较高的是 (填“Ⅰ”或“Ⅱ”)______ 。
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g),△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+ H2O(g),△H2
(1)在一定条件下将1molCO和4molH2充入2L的密闭容器中发生反应I,5min后测得c(H2)=1.2 mol/L,计算此段时间的反应速率(用H2表示)
(2)反应CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3=
(3)若容器容积不变,下列措施可提高反应Ⅱ的反应速率的是(选字母)
a.充入CO2,使体系总压强增大 b.将CH3OH(g)从体系中分离出来
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡向
(5)这两种合成甲醇的方法比较,原子利用率较高的是 (填“Ⅰ”或“Ⅱ”)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】工业上可利用CO2来制备清洁液体燃料甲醇,有关化学反应如下:
反应①: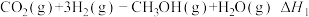
反应②:
反应③:
请回答:
I.
(1)
___________  。
。
(2)反应①可通过反应②、反应③两个步骤实现,若反应②为慢反应、反应③为快反应,下列示意图能体现上述反应能量变化的是___________填标号。
(3)向恒温恒压0.1 MPa的密闭容器中充入1 mol CO2、1 mol H2、6 mol He选择合适催化剂按反应②进行,平衡时测得CO2的转化率为20%,则该反应的
___________ 用分压代替平衡浓度计算,分压=总压×物质的量分数。
Ⅱ.在CFBR催化下反应①受到反应限度的限制、存在竞争性逆水煤气变换反应反应②和水诱导催化剂失活等影响,导致CO2转化率和甲醇选择性都比较低。某科学团队研发一种具有反应、分离气态水的双功能的分子筛膜催化 反应器CMR,提高CO2加氢制备甲醇的效率。
保持一定压强,向密闭容器中投入一定量CO2和H2,只发生反应①②,不同反应模式下CO2的平衡转化率和甲醇选择性的实验数据如下表所示。甲醇的选择性
(4)下列说法正确的是___________。
(5)由表中数据可知,CMR模式下CO2的平衡转化率显著提高,结合反应分析原因___________ 。
反应①:
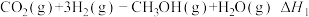
反应②:

反应③:

请回答:
I.
(1)

 。
。(2)反应①可通过反应②、反应③两个步骤实现,若反应②为慢反应、反应③为快反应,下列示意图能体现上述反应能量变化的是___________填标号。
A.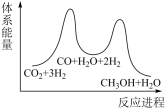 | B.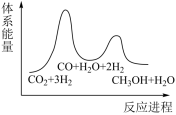 |
C.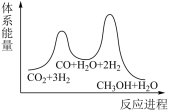 | D. |

Ⅱ.在CFBR催化下反应①受到反应限度的限制、存在竞争性逆水煤气变换反应反应②和水诱导催化剂失活等影响,导致CO2转化率和甲醇选择性都比较低。某科学团队研发一种具有
保持一定压强,向密闭容器中投入一定量CO2和H2,只发生反应①②,不同反应模式下CO2的平衡转化率和甲醇选择性的实验数据如下表所示。甲醇的选择性
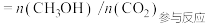
实验组 | 反应模式 |
| 压强/MPa | 温度/℃ | CO2转化率/% | CH3OH选择性/% |
① | CFBR | 3 | 5 | 250 | 25.6 | 61.3 |
② | CFBR | 3 | 5 | 230 | 20.0 | 70.0 |
③ | CFBR | 3 | 3 | 260 | 21.9 | 67.3 |
④ | CMR | 3 | 3 | 260 | 36.1 | 100 |
| A.CFBR模式下,温度低有利于工业生产CH3OH |
| B.CFBR模式下,在原料气中掺入适量CO,可以提高CH3OH的选择性 |
| C.CMR模式下,适当增加压强,可以提高CO2的平衡转化率 |
| D.CMR模式下,温度越高则反应速率越快 |
您最近一年使用:0次
【推荐2】铅的冶炼有很多种方法。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
① PbS(s)+3/2 O2(g)= PbO(s)+ SO2(g) ΔH1=a kJ·mol-1
② PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2=b kJ·mol-1
③ PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH3=c kJ·mol-1
反应PbS(s)+2O2(g)=PbSO4(s) ΔH=______ kJ·mol-1(用含a、b、c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)⇌Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如表:
①该反应的ΔH_______ 0(选填“>”、“<”或“=”)。
②当lgK=0,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为________ ;若向容器中充入一定量的CO气体后,平衡_________ (填“正向”、“逆向”或“不”)移动,再次达到平衡时,CO的转化率_________ (填“增大”、“减小”或“不变”);若向容器中添加一定量的PbO,平衡_________ (填“正向”、“逆向”或“不”)移动。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
① PbS(s)+3/2 O2(g)= PbO(s)+ SO2(g) ΔH1=a kJ·mol-1
② PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2=b kJ·mol-1
③ PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH3=c kJ·mol-1
反应PbS(s)+2O2(g)=PbSO4(s) ΔH=
(2)还原法炼铅,包含反应PbO(s)+CO(g)⇌Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如表:
| 温度/℃ | 300 | 727 | 1227 |
| lgK | 6.17 | 2.87 | 1.24 |
①该反应的ΔH
②当lgK=0,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】“温室效应”是哥本哈根气候变化大会研究的环境问题之一,CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有________ (填字母编号)。
a.采用节能技术,减少化石燃料的用量
b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
(2)另一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)=C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇的热化学方程式是________ 。
(3)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
根据上表中数据分析:
①温度一定时,提高氢碳比[ ],CO2的转化率
],CO2的转化率____ (填“增大”、“减小”或“不变”)。
②该反应的正反应为_______ (填“吸热”或“放热”)反应。
③在答卷的坐标系中作图,说明压强由p1增大到p2时,压强对该反应化学平衡的影响(图中纵坐标所表示的物理量需自己定义)___________。
(1)下列措施中,有利于降低大气中CO2浓度的有
a.采用节能技术,减少化石燃料的用量
b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
(2)另一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)=C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇的热化学方程式是
(3)在一定条件下,6H2(g)+2CO2(g)
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。CO2转化率(%) n(H2)/n(CO2) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
根据上表中数据分析:
①温度一定时,提高氢碳比[
 ],CO2的转化率
],CO2的转化率②该反应的正反应为
③在答卷的坐标系中作图,说明压强由p1增大到p2时,压强对该反应化学平衡的影响(图中纵坐标所表示的物理量需自己定义)___________。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】I.汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。汽车内燃机工作时发生反应:N2(g)+O2(g) 2NO(g),该反应是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5 mol N2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
2NO(g),该反应是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5 mol N2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
(1)5 min内该反应的平均速率v(NO)=___________ ;在T℃时,该反应的平衡常数值为_________ 。
(2)反应开始至达到平衡的过程中,容器中下列各项发生变化的是(填序号)___________ 。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(3)已知:ⅰ.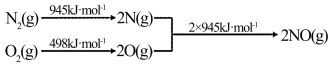
ⅱ. N2(g) + 2O2(g) === 2NO2(g) ΔH= + 68 kJ·mol-1
结合热化学方程式,说明温度对于NO生成NO2平衡转化率的影响:_____________________ 。
II. 含pm2.5的雾霾主要成分有SO2、NOx、CxHy及可吸入颗粒等。
(4)雾霾中能形成酸雨的物质是_____________
(5)NaClO2溶液可以吸收SO2、NO。在NaClO2溶液中通入含有SO2和NO的气体,反应温度为323 K,NaClO2溶液浓度为5×10−3mol·L−1。反应一段时间后溶液中离子浓度的分析结果如下表
①写出NaClO2溶液脱硝 过程中主要 反应的离子方程式________________________
增大压强,NO的转化率______ (填“提高”“不变”或“降低”)。
②由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”)。原因除了SO2溶解性大于NO,还可能是___________________
(6)如图电解装置可将SO2、NO转化为(NH4)2SO4,
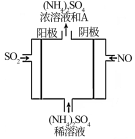
① 阴极的电极反应式是______________________________
②SO2、NO通入电解装置中的体积比为___________________
 2NO(g),该反应是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5 mol N2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
2NO(g),该反应是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5 mol N2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5mol。(1)5 min内该反应的平均速率v(NO)=
(2)反应开始至达到平衡的过程中,容器中下列各项发生变化的是(填序号)
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(3)已知:ⅰ.

ⅱ. N2(g) + 2O2(g) === 2NO2(g) ΔH= + 68 kJ·mol-1
结合热化学方程式,说明温度对于NO生成NO2平衡转化率的影响:
II. 含pm2.5的雾霾主要成分有SO2、NOx、CxHy及可吸入颗粒等。
(4)雾霾中能形成酸雨的物质是
(5)NaClO2溶液可以吸收SO2、NO。在NaClO2溶液中通入含有SO2和NO的气体,反应温度为323 K,NaClO2溶液浓度为5×10−3mol·L−1。反应一段时间后溶液中离子浓度的分析结果如下表
| 离子 | SO42− | SO32− | NO3− | NO2− | Cl− |
| c/(mol·L−1) | 8.35×10−4 | 6.87×10−6 | 1.5×10−4 | 1.2×10−5 | 3.4×10−3 |
①写出NaClO2溶液
增大压强,NO的转化率
②由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”)。原因除了SO2溶解性大于NO,还可能是
(6)如图电解装置可将SO2、NO转化为(NH4)2SO4,

① 阴极的电极反应式是
②SO2、NO通入电解装置中的体积比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】 随意排放会造成雾霾、光化学烟雾等污染。可以用不同方法处理
随意排放会造成雾霾、光化学烟雾等污染。可以用不同方法处理 ,防止汽车尾气中的
,防止汽车尾气中的 、
、 污染空气。请回答:
污染空气。请回答:
(1)已知:反应Ⅰ: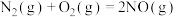
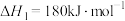
反应Ⅱ:

反应Ⅲ:室温下, 将
将 转化成无毒物质的热化学方程式:
转化成无毒物质的热化学方程式:_______ ,该反应在_______ (填“高温”、“低温”或“任意温度”)下可以自发进行,反应Ⅲ的速率可表示为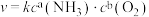 ,
,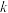 为常数。当氧气浓度为
为常数。当氧气浓度为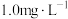 时,
时, 与速率的关系如表所示,则
与速率的关系如表所示,则
_______ 。
(2)汽车的催化转化器中发生的主要反应为: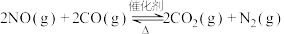
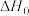 。
。
①恒温恒容密闭容器内充入一定量的NO和CO,发生上述反应。下列能说明反应达到平衡状态的是_______ (填字母序号)。
A.容器内气体的密度不再改变 B.容器内气体的平均摩尔质量不再改变
C.容器内气体的压强不再改变 D.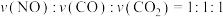
②容积均为 的三个恒容密闭容器中分别通入
的三个恒容密闭容器中分别通入 和
和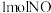 ,发生上述反应,a、b、c三组实验的反应温度分别记为
,发生上述反应,a、b、c三组实验的反应温度分别记为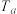 、
、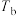 、
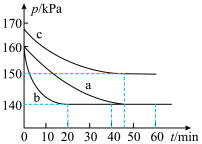
、 。恒温恒容条件下反应各体系压强的变化如图所示。三组实验对应温度的大小关系是
。恒温恒容条件下反应各体系压强的变化如图所示。三组实验对应温度的大小关系是_______ (用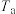 、
、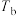 、
、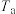 表示),实验
表示),实验 条件下,反应的平衡常数
条件下,反应的平衡常数
_______ 。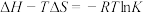 (其中,
(其中, 为焓变,
为焓变, 为熵变,
为熵变, 为温度,
为温度, 为平衡常数,
为平衡常数, 为常数),请在答题卡图中画出该反应的
为常数),请在答题卡图中画出该反应的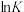 随
随 变化的图像
变化的图像_______ 。
 随意排放会造成雾霾、光化学烟雾等污染。可以用不同方法处理
随意排放会造成雾霾、光化学烟雾等污染。可以用不同方法处理 ,防止汽车尾气中的
,防止汽车尾气中的 、
、 污染空气。请回答:
污染空气。请回答:(1)已知:反应Ⅰ:
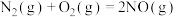
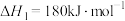
反应Ⅱ:


反应Ⅲ:室温下,
 将
将 转化成无毒物质的热化学方程式:
转化成无毒物质的热化学方程式: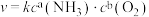 ,
,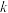 为常数。当氧气浓度为
为常数。当氧气浓度为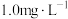 时,
时, 与速率的关系如表所示,则
与速率的关系如表所示,则
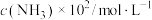 | 0.8 | 1.6 | 3.2 | 6.4 |
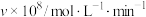 | 10.2 | 81.6 | 652.8 | 5222.4 |
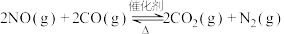
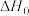 。
。①恒温恒容密闭容器内充入一定量的NO和CO,发生上述反应。下列能说明反应达到平衡状态的是
A.容器内气体的密度不再改变 B.容器内气体的平均摩尔质量不再改变
C.容器内气体的压强不再改变 D.
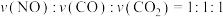
②容积均为
 的三个恒容密闭容器中分别通入
的三个恒容密闭容器中分别通入 和
和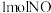 ,发生上述反应,a、b、c三组实验的反应温度分别记为
,发生上述反应,a、b、c三组实验的反应温度分别记为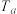 、
、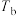 、
、 。恒温恒容条件下反应各体系压强的变化如图所示。三组实验对应温度的大小关系是
。恒温恒容条件下反应各体系压强的变化如图所示。三组实验对应温度的大小关系是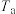 、
、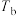 、
、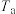 表示),实验
表示),实验 条件下,反应的平衡常数
条件下,反应的平衡常数
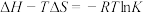 (其中,
(其中, 为焓变,
为焓变, 为熵变,
为熵变, 为温度,
为温度, 为平衡常数,
为平衡常数, 为常数),请在答题卡图中画出该反应的
为常数),请在答题卡图中画出该反应的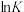 随
随 变化的图像
变化的图像
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g)  a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为____________________ ;此反应的逆反应△S__________ 0 (填﹤,﹥,﹦)。
(2)下列说法中能说明该反应达到了化学平衡状态的是___________________________ 。
A、容器内压强一定 B、v(X)正=2 v (Y)逆
C、容器内Z分子数一定 D、容器内气体的质量一定
E、容器内气体的密度一定 F:X、Y、Z、W的浓度之比为2∶1∶a∶1
(3)维持温度不变,若起始时向该容器中加入的物质的量如下列各项,则反应达到平衡后(稀有气体不参与反应),与之是等效平衡的是______________ 。
A.2 mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1 molX、0.5mol Y、0.5a mol Z、0.5 mol W D.2 mol X、1mol Y、1mol Z
(4)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了15%,则反应中放出的热量为___________________ kJ。
(5)已知:该反应的平衡常数随温度的变化如下表:
试回答下列问题:
若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为__________________ ℃。
 a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则(1)化学计量数a的值为
(2)下列说法中能说明该反应达到了化学平衡状态的是
A、容器内压强一定 B、v(X)正=2 v (Y)逆
C、容器内Z分子数一定 D、容器内气体的质量一定
E、容器内气体的密度一定 F:X、Y、Z、W的浓度之比为2∶1∶a∶1
(3)维持温度不变,若起始时向该容器中加入的物质的量如下列各项,则反应达到平衡后(稀有气体不参与反应),与之是等效平衡的是
A.2 mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1 molX、0.5mol Y、0.5a mol Z、0.5 mol W D.2 mol X、1mol Y、1mol Z
(4)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了15%,则反应中放出的热量为
(5)已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 150 | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 | 0.21 |
若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
I.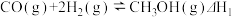
II.
(1)则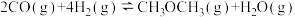 的△H=
的△H= ________ (用△H1、△H2表示)
(2)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为______ 反应(填”吸热”’或”放热”)。
(3)在恒容密闭容器中发生反应I:

①如图能正确反映体系中甲醇体积分数随温度变化情况的曲线是____ (填“a”或“b”)。
②下列说法能表明反应已达平衡状态的是____ (填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(4)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则:
① 0~4min,反应I的v(H2)=________ ,反应I的平衡常数K=________ 。
②反应II中CH3OH的转化率α=_________ 。
I.
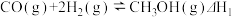
II.

(1)则
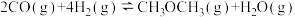 的△H=
的△H= (2)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为
(3)在恒容密闭容器中发生反应I:

①如图能正确反映体系中甲醇体积分数随温度变化情况的曲线是
②下列说法能表明反应已达平衡状态的是
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(4)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则:
① 0~4min,反应I的v(H2)=
②反应II中CH3OH的转化率α=
您最近一年使用:0次
【推荐2】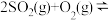
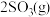 ,反应过程的能量变化如图所示。
,反应过程的能量变化如图所示。
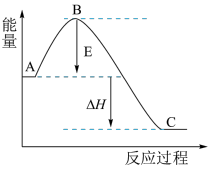
已知1mol 氧化为1mol
氧化为1mol 的ΔH= -99
的ΔH= -99 。请回答下列问题:
。请回答下列问题:
(1)图中E的大小对该反应的反应热________ (填“有”或“无”)影响。该反应通常用 作催化剂,加
作催化剂,加 会使图中B点
会使图中B点___________ (填“升高”还是“降低”)。
(2) 氧化为
氧化为 的热化学方程式
的热化学方程式______________________________________ 。
(3)该反应的平衡常数表达式为______________________________ 。
(4)以下说法能证明恒温恒容条件下该反应已经达到平衡状态的是_________ 。
A.容器内压强保持不变 B.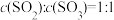
C.各气体百分含量保持不变 D.生成1mol 的同时消耗0.5mol
的同时消耗0.5mol
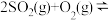
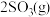 ,反应过程的能量变化如图所示。
,反应过程的能量变化如图所示。
已知1mol
 氧化为1mol
氧化为1mol 的ΔH= -99
的ΔH= -99 。请回答下列问题:
。请回答下列问题:(1)图中E的大小对该反应的反应热
 作催化剂,加
作催化剂,加 会使图中B点
会使图中B点(2)
 氧化为
氧化为 的热化学方程式
的热化学方程式(3)该反应的平衡常数表达式为
(4)以下说法能证明恒温恒容条件下该反应已经达到平衡状态的是
A.容器内压强保持不变 B.
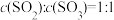
C.各气体百分含量保持不变 D.生成1mol
 的同时消耗0.5mol
的同时消耗0.5mol
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】Ⅰ.在10L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
请回答:
(1)该反应为____________ (填“吸热”或“放热”)反应。
(2)该反应的化学平衡常数表达式为K =_________________________________ 。
(3)能说明该反应达到化学平衡状态的是________________ (填字母)。
A 一定温度下容器中压强不变 B 混合气体中 c(CO)不变
C v正(H2)=v逆(H2O) D c(CO2)=c(CO)
(4)某温度下,将CO2和H2各0.10mol充入该容器中,反应进行2min达到平衡后,测得c(CO)= 0.0080mol/L,则CO2的转化率为___________ 用H2浓度变化表示的反应速率为_____
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___________ ℃。
Ⅱ.一定温度下,在容积固定的V L密闭容器里加入1 mol A、2 mol B,发生反应:
A(g)+2B(g) 2C(g)ΔH<0达到平衡状态。
2C(g)ΔH<0达到平衡状态。
(1)在保证A浓度不变的情况下,增大容器的体积,平衡_____ (填字母)
A 向正反应方向移动 B 向逆反应方向移动 C 不移动
(2)若该反应的逆反应速率与时间的关系如图所示:
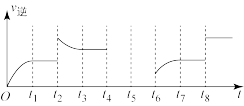
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:
t2时_____________________ ;
t8时_____________________ ;
②t2时平衡向________ (填“正反应”或“逆反应”)方向移动.
 CO(g)+H2O(g)
CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
(1)该反应为
(2)该反应的化学平衡常数表达式为K =
(3)能说明该反应达到化学平衡状态的是
A 一定温度下容器中压强不变 B 混合气体中 c(CO)不变
C v正(H2)=v逆(H2O) D c(CO2)=c(CO)
(4)某温度下,将CO2和H2各0.10mol充入该容器中,反应进行2min达到平衡后,测得c(CO)= 0.0080mol/L,则CO2的转化率为
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
Ⅱ.一定温度下,在容积固定的V L密闭容器里加入1 mol A、2 mol B,发生反应:
A(g)+2B(g)
 2C(g)ΔH<0达到平衡状态。
2C(g)ΔH<0达到平衡状态。(1)在保证A浓度不变的情况下,增大容器的体积,平衡
A 向正反应方向移动 B 向逆反应方向移动 C 不移动
(2)若该反应的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:
t2时
t8时
②t2时平衡向
您最近一年使用:0次