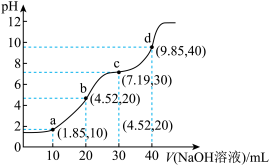
电解质的电导率越大,导电能力越强。用0.100mol·L-1的KOH溶液分别滴定体积均为20.00mL、浓度均为0.100mol•L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
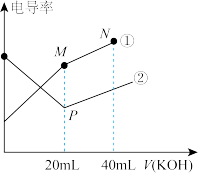

| A.曲线②代表滴定CH3COOH溶液的曲线 |
| B.在相同温度下,P点水电离程度大于M点 |
| C.M点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol·L-1 |
| D.N点溶液中:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
17-18高二上·广东·期中 查看更多[11]
湖南省名校联盟2023届高三下学期3月调研考试化学试题四川省遂宁市高2023届高三零诊考试化学试题江西省临川一中暨临川一中实验学校2021-2022学年高二上学期期末考试化学试题内蒙古赤峰二中2021-2022学年高三上学期第一次月考化学试题广东省佛山市石门中学2021届高三模拟化学试题解题达人.化学选择题(2021全国卷)精编特训04新疆维吾尔自治区新源县第二中学2020届高三下学期第一次测试化学试题(已下线)考点12 盐类水解及其应用-2020年高考化学命题预测与模拟试题分类精编天津市第二十五中学2020届高三下学期3月网络测试化学试题河北省衡水中学2020届高三下学期一调理综化学试题【全国百强校】广东省深圳外国语学校2017-2018学年高二上学期期中化学试题
更新时间:2019-06-21 20:55:47
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】三元弱酸亚砷酸(H3AsO3)在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示。向1mol•L-1H3AsO3溶液中滴加NaOH溶液,关于该过程的说法错误的是


| A.H3AsO3的一级电离平衡常数Ka1=10-a |
B.H2AsO 的电离平衡常数小于水解平衡常数 的电离平衡常数小于水解平衡常数 |
C.pH=12,存在的含砷微粒有H3AsO3、H2AsO 、HAsO 、HAsO 、AsO 、AsO |
D.pH=b时c(Na+)>c(H2AsO )>c(H3AsO3)=c(HAsO )>c(H3AsO3)=c(HAsO ) ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】分析化学中“滴定分数”的定义:所加滴定剂与被滴定组分的物质的量之比。常温下以 的HCl溶液滴定同浓度某一元碱MOH溶液并绘制滴定曲线如图所示。下列说法中正确的是
的HCl溶液滴定同浓度某一元碱MOH溶液并绘制滴定曲线如图所示。下列说法中正确的是

 的HCl溶液滴定同浓度某一元碱MOH溶液并绘制滴定曲线如图所示。下列说法中正确的是
的HCl溶液滴定同浓度某一元碱MOH溶液并绘制滴定曲线如图所示。下列说法中正确的是
| A.在滴定过程中溶液的导电能力先减小后增大 |
B.x点溶液中水电离出的 一定大于 一定大于 |
C.根据y点坐标可以算得 |
D.对z点溶液加热时, 一定增大 一定增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】常温常压下,某同学向20.00mLc0mol•L-1氨水中逐滴加入0.1000mol•L-1的盐酸,实验测得溶液的pH随加入盐酸体积的变化如图所示,其中N点为反应终点(此时盐酸与氨水恰好完全反应),此时消耗盐酸的体积为17.20mL。下列说法中正确的是
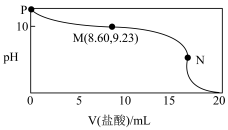

| A.选择甲基橙作指示剂,比选用酚酞作指示剂的误差大 |
B.M点的溶液中存在:c(NH3•H2O)>c(Cl-)>c(NH ) ) |
| C.N点溶液中:c(H+)-c(OH-)<c(Cl-)-c(NH3•H2O) |
| D.P、M、N三点对应溶液中水的电离程度最大的为M点 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】在一定条件下,对于某浓度的Na2S溶液的叙述正确的是
| A.c(Na+)=2c(S2-) | B.c(Na+)=2c(HS-)+2c(H2S)+2c(S2-) |
| C.c(Na+)+ c(H+)=c(S2-)+ c(OH-) | D.c(Na+)>c(S2-)>c(HS-)>c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列有关电解质溶液的说法正确的是
A.将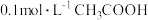 溶液从20℃升温至30℃,溶液中 溶液从20℃升温至30℃,溶液中 减小 减小 |
B.若 溶液与 溶液与 溶液的pH相等,则 溶液的pH相等,则 也相等 也相等 |
C.向盐酸中加入氨水至中性,溶液中 |
D.常温下将 的 的 溶液与 溶液与 的NaOH溶液等体积混合,所得溶液呈酸性 的NaOH溶液等体积混合,所得溶液呈酸性 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下,下列说法正确的是
A.pH均为3的醋酸和硫酸溶液,加水稀释相同倍数后,c(CH3COO-)=2c( ) ) |
B.0.1 mol·L-1NaHSO3溶液中,c( )+c( )+c( )+c(H2SO3)=0.1 mol/L )+c(H2SO3)=0.1 mol/L |
| C.含有AgBr和AgI固体的悬浊液:c(Ag+)>c(Br-)=c(I-) |
D.浓度均为0.1 mol/L的(NH4)2SO4与(NH4)2CO3溶液中, 前者小于后者 前者小于后者 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】25℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,错误 的是


| A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B.在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-) |
| C.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| D.在A、B、C点:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
您最近一年使用:0次