下列说法正确的是( )
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH>4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
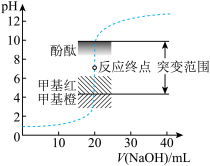
| C.用0.2000mol/LNaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和 |
D.室温下,将CH3COONa溶液加水稀释,溶液中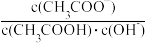 增大 增大 |
更新时间:2020-02-08 11:21:46
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】常温下,用0.1000 mol/L NaOH溶液滴定20.00 mL 0.1000 mol/L HCl溶液,滴定曲线,如图所示,下列说法不正确的是
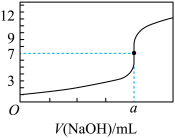

| A.a=20.00 |
B.滴定过程中,可能存在: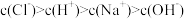 |
| C.若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 |
| D.若将盐酸换成同浓度的醋酸,则滴定到pH=7时,a>20.00 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】如图所示为常温下用0.1000mol·L-1NaOH溶液滴定10.00mL未知浓度的硫酸(用酚酞作指示剂)的滴定曲线。下列说法正确的是
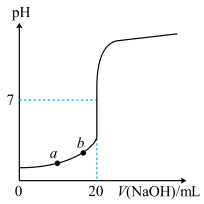
| A.水电离出的氢氧根离子浓度:a>b |
| B.硫酸的物质的量浓度为0.2000mol·L-1 |
| C.指示剂变色时,说明硫酸与NaOH恰好完全反应 |
D.当滴加NaOH溶液的体积为10.00mL时,该混合液的 =0.05mol·L-1 =0.05mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】室温下,向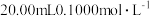 盐酸中滴加
盐酸中滴加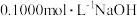 溶液,溶液的
溶液,溶液的 随
随 溶液体积的变化如图。已知
溶液体积的变化如图。已知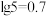 下列说法
下列说法不正确 的是( )
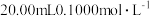 盐酸中滴加
盐酸中滴加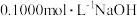 溶液,溶液的
溶液,溶液的 随
随 溶液体积的变化如图。已知
溶液体积的变化如图。已知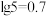 下列说法
下列说法
A. 与盐酸恰好完全反应时,溶液 与盐酸恰好完全反应时,溶液 |
B.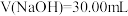 时,溶液 时,溶液 |
C. 标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钾标定 标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钾标定 溶液的浓度,标定时可采用甲基橙为指示剂 溶液的浓度,标定时可采用甲基橙为指示剂 |
| D.选择甲基红指示反应终点,误差比甲基橙的小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】中和滴定中,用浓度为c mol·L-1的某二元酸溶液中和摩尔质量为M g·mol-1的一元碱Wg,消耗这种二元酸溶液的体积是
A.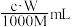 | B.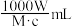 | C. | D. |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】室温下,下列实验操作和现象及实验结论均正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 测得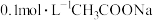 溶液 溶液 小于 小于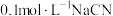 溶液的 溶液的 |  电离出 电离出 的能力比 的能力比 弱 弱 |
| B | 向浓度均为 的 的 和 和 混合溶液中滴加 混合溶液中滴加 溶液,出现白色沉淀 溶液,出现白色沉淀 | 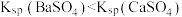 |
| C | 用广泛 试纸测定相同浓度的 试纸测定相同浓度的 与 与 溶液的 溶液的 , , 溶液 溶液 大 大 |  酸性强于 酸性强于 |
| D | 向 溶液中加入 溶液中加入 溶液,有白色沉淀生成 溶液,有白色沉淀生成 |  与 与 发生了双水解反应 发生了双水解反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
| A.0.1mol/L该酸溶液的pH约为3 |
| B.HCN水溶液中,c(H+)>c(OH-) |
| C.10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应 |
| D.HCN易溶于水 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】醋酸铅因有甜味而被称为“铅糖”,它有毒但能入药,又知(CH3COO)2Pb可溶于水,硝酸铅与醋酸钠溶液反应的离子方程式为Pb2++2CH3COO-=(CH3COO)2Pb。下列有关说法正确的是
| A.0.1mol·L-1的醋酸铅溶液与0.1mol·L-1的醋酸钠溶液相比,c(Pb2+)=c(Na+) |
| B.0.1mol·L-1的醋酸铅溶液与0.1mol·L-1的醋酸钠溶液相比,c(CH3COO-)之比等于2∶1 |
| C.将0.1mol·L-1的醋酸铅溶液加水稀释10倍,c(Pb2+)∶c(CH3COO-)=2∶1 |
| D.醋酸铅是共价化合物,溶液可能导电性很弱 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】弱电解质在水溶液中的电离过程是一个可逆过程。常温下,下列说法正确的是
A.0.1mol/L醋酸溶液加水稀释,溶液中 减小 减小 |
| B.水是极弱的电解质,将金属Na加入水中,水的电离程度减小 |
C. 的醋酸溶液加一定量 的醋酸溶液加一定量 的盐酸,醋酸的电离平衡不发生移动 的盐酸,醋酸的电离平衡不发生移动 |
| D.若电离平衡向正向移动,则弱电解质的电离度一定增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】室温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
B.溶液中 的值减小 的值减小 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10mLpH=11的NaOH溶液,混合液pH=7 |
您最近一年使用:0次

 为
为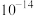
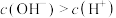 溶液显酸性
溶液显酸性 为
为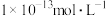 时,此溶液的pH可能为1或13
时,此溶液的pH可能为1或13 与
与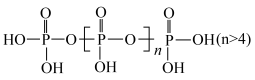
 的NaOH溶液滴定。在消耗NaOH溶液
的NaOH溶液滴定。在消耗NaOH溶液 和
和 时各有一个滴定终点。则下列判断正确的是
时各有一个滴定终点。则下列判断正确的是 上的氢难电离
上的氢难电离 H不同
H不同

