关于下列各图的叙述不正确的是
化学方程式 | 平衡常数K |
F2 + H2 = 2HF | 6.5×1095 |
Cl2 + H2 = 2HCl | 2.6×1033 |
Br2 + H2 = 2HBr | 1.9×1019 |
I2 + H2 = 2HI | 8.7×102 |

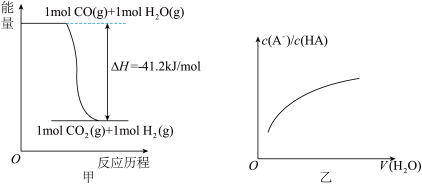
| A.已知CO的燃烧热283kJ·mol-1,O2(g) +2 H2(g) = 2H2O(g) ΔH = -483.6 kJ·mol-1,则图甲表示CO和H2O(g)生成CO2和H2的能量变化 |
| B.某温度下,pH =11的NH3∙H2O和pH =1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3∙H2O与NH3三种微粒的平衡浓度之和为0.05mol∙L-1 |
| C.在常温下,X2(g) 和 H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱 |
D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,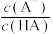 的变化情况 的变化情况 |
更新时间:2020-02-09 11:16:21
|
相似题推荐
【推荐1】肼( )在不同条件下分解产物不同,200℃时在
)在不同条件下分解产物不同,200℃时在 表面分解的机理如图1。已知200℃时:
表面分解的机理如图1。已知200℃时:
反应Ⅰ: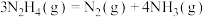
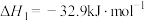
反应Ⅱ: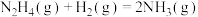

下列说法不正确的是
 )在不同条件下分解产物不同,200℃时在
)在不同条件下分解产物不同,200℃时在 表面分解的机理如图1。已知200℃时:
表面分解的机理如图1。已知200℃时:反应Ⅰ:
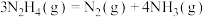
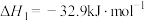
反应Ⅱ:
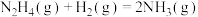

下列说法不正确的是

| A.图1所示过程①是放热反应、过程②是吸热反应 |
| B.反应Ⅱ的能量过程示意图如图2所示 |
C.断开3 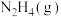 中的化学键吸收的能量大于形成1 中的化学键吸收的能量大于形成1  和4 和4  中的化学键释放的能量 中的化学键释放的能量 |
D.200℃时,肼分解生成氮气和氢气的热化学方程式为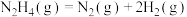  |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】反应
 分两步进行:
分两步进行:
①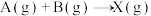

②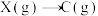

反应过程中能量变化如图所示, 表示
表示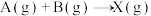 的活化能,下列说法正确的是
的活化能,下列说法正确的是

 分两步进行:
分两步进行:①

②

反应过程中能量变化如图所示,
 表示
表示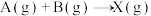 的活化能,下列说法正确的是
的活化能,下列说法正确的是
A.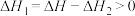 |
B.X是反应 的催化剂 的催化剂 |
C. 是反应②的活化能 是反应②的活化能 |
D.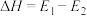 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】废气中的H2S通过高温热分解可制取氢气:2H2S(g) 2H2(g)+S2(g)某温度时,下列不能够说明H2S的转化率达到最大值的依据是
2H2(g)+S2(g)某温度时,下列不能够说明H2S的转化率达到最大值的依据是
 2H2(g)+S2(g)某温度时,下列不能够说明H2S的转化率达到最大值的依据是
2H2(g)+S2(g)某温度时,下列不能够说明H2S的转化率达到最大值的依据是| A.气体的压强不发生变化 | B.气体的平均相对分子质量不发生变化 |
C.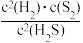 不发生变化 不发生变化 | D.单位时间分解的H2S和生成的H2一样多 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】工业上用 与
与 、
、 重整生产
重整生产 ,
,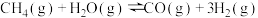 ;
;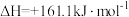 。下列说法正确的是
。下列说法正确的是
 与
与 、
、 重整生产
重整生产 ,
,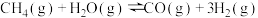 ;
;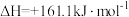 。下列说法正确的是
。下列说法正确的是A.反应的平衡常数可表示为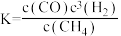 |
B.1molCO和3mol 充分反应时放出的热量为161.1kJ 充分反应时放出的热量为161.1kJ |
| C.达平衡时缩小容器体积,正反应速率增大,逆反应速率减小 |
D.其他条件相同,增大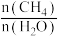 , , 的转化率下降 的转化率下降 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】将 0.1mol/LCH3COOH 溶液加水稀释或者加入少量 CH3COONa 晶体时,都会引起
| A.溶液的 pH 变大 |
| B.CH3COOH 的电离程度增大 |
| C.溶液的导电能力增强 |
| D.溶液中c(OH-)减小 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】某浓度的HF溶液中存在平衡:HF H++F-,若要增大F-的浓度,同时减小H+的浓度,可以采取的方法是( )
H++F-,若要增大F-的浓度,同时减小H+的浓度,可以采取的方法是( )
 H++F-,若要增大F-的浓度,同时减小H+的浓度,可以采取的方法是( )
H++F-,若要增大F-的浓度,同时减小H+的浓度,可以采取的方法是( )| A.加入少量NaOH固体 | B.适当降低温度 |
| C.加入少量的浓盐酸 | D.加水稀释 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
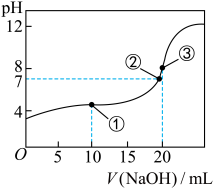
【推荐1】常温下,用 溶液滴定
溶液滴定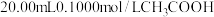 溶液所得滴定曲线如图所示。下列说法正确的是
溶液所得滴定曲线如图所示。下列说法正确的是
 溶液滴定
溶液滴定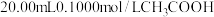 溶液所得滴定曲线如图所示。下列说法正确的是
溶液所得滴定曲线如图所示。下列说法正确的是
| A.滴定时应选甲基橙作指示剂 |
| B.水的电离程度:②>③>① |
C.点②所示溶液中: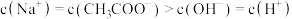 |
D.点③所示溶液中: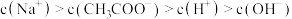 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.1.8g  含有的中子数为 含有的中子数为 |
B.标准状况下,5.6L甲烷和乙烯的混合气体中含有的σ键数目大于 |
C.1  溶液中 溶液中 和 和 微粒总数为 微粒总数为 |
D.室温下,35.5g氯气溶于水并充分反应,转移的电子总数为 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐3】NA为阿伏加德罗常数的值。下列说法正确的是
| A.将1molCl2通入足量水中,所得溶液中HClO、Cl-、ClO-三种微粒数目之和为2NA |
| B.12g石墨中含有2NA个共价键 |
| C.1mol水一定含2mol氢键 |
| D.1LpH=2的HF溶液中含有的H+数目为0.01NA |
您最近一年使用:0次

 N2(g)+2CO2(g)
N2(g)+2CO2(g)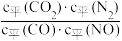
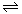 H+ +OH-。下列叙述正确的是(
H+ +OH-。下列叙述正确的是(

