1 . 25℃时,草酸和碳酸的电离平衡常数见下表。
1.等温等浓度时,pH:H2C2O4溶液_______ H2CO3溶液。
A.> B.< C.=
2.等浓度Na2C2O4和Na2CO3混合溶液中,含碳元素的负离子浓度从大到小的顺序为_______ 。
3.向饱和Na2CO3溶液中滴加少量草酸溶液,观察到生成沉淀。写出反应的离子方程式_______ 。
| 化学式 | H2C2O4 | H2CO3 |
| 电离平衡常数 | Ka1=5.9×10-2 Ka2=6.4×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
A.> B.< C.=
2.等浓度Na2C2O4和Na2CO3混合溶液中,含碳元素的负离子浓度从大到小的顺序为
3.向饱和Na2CO3溶液中滴加少量草酸溶液,观察到生成沉淀。写出反应的离子方程式
您最近一年使用:0次
2 . 常温下,5种0.1 的盐溶液pH如图所示。
的盐溶液pH如图所示。
 的盐溶液pH如图所示。
的盐溶液pH如图所示。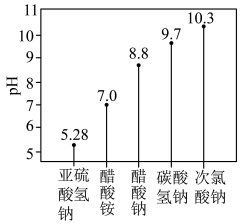
A.常温下,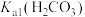 的数量级为 的数量级为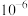 |
B.等体积的 溶液和NaClO溶液, 溶液和NaClO溶液, 溶液中的总离子数目更多 溶液中的总离子数目更多 |
C. 溶液中 溶液中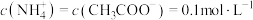 |
D. 溶液中存在: 溶液中存在: |
您最近一年使用:0次
2024-07-24更新
|
193次组卷
|
2卷引用:江西省多所学校2025届高三上学期第一次大联考化学试题
3 . 常温下,向20mL浓度均为 的HY溶液和HZ溶液中,逐滴加入
的HY溶液和HZ溶液中,逐滴加入 的NaOH溶液,曲线I、曲线Ⅱ分别代表反应后HY溶液和HZ溶液中水电离出
的NaOH溶液,曲线I、曲线Ⅱ分别代表反应后HY溶液和HZ溶液中水电离出 浓度的负对数
浓度的负对数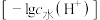 与所加NaOH溶液体积的关系。下列说法错误的是
与所加NaOH溶液体积的关系。下列说法错误的是
 的HY溶液和HZ溶液中,逐滴加入
的HY溶液和HZ溶液中,逐滴加入 的NaOH溶液,曲线I、曲线Ⅱ分别代表反应后HY溶液和HZ溶液中水电离出
的NaOH溶液,曲线I、曲线Ⅱ分别代表反应后HY溶液和HZ溶液中水电离出 浓度的负对数
浓度的负对数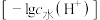 与所加NaOH溶液体积的关系。下列说法错误的是
与所加NaOH溶液体积的关系。下列说法错误的是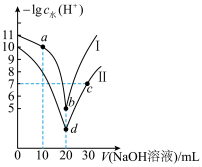
| A.c点溶液显中性 |
B.在a点,存在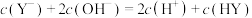 |
C.b、d两点存在: |
D. 的HY和NaZ溶液等体积混合,溶液呈酸性 的HY和NaZ溶液等体积混合,溶液呈酸性 |
您最近一年使用:0次
解题方法
4 . 利用铝锂钴废料(主要成分为 ,还含有少量铝箔、
,还含有少量铝箔、 等杂质)制备
等杂质)制备 的工艺流程如图所示。
的工艺流程如图所示。 具有较强氧化性,
具有较强氧化性, 、
、 均难溶于水。
均难溶于水。
回答下列问题:
(1)写出增大“碱溶”速率的一种方法:___________ 。
(2)“酸溶”时, 发生反应的离子方程式为
发生反应的离子方程式为___________ ;从环保角度考虑,“酸溶”时的试剂___________ (填“能”或“不能”)用浓盐酸代替,简要说明理由:___________ 。
(3)已知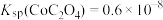 ,要使溶液中的
,要使溶液中的 完全沉淀(即
完全沉淀(即 浓度小于
浓度小于  ),则溶液中
),则溶液中 浓度最小为
浓度最小为___________  ;简述洗涤
;简述洗涤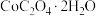 的操作:
的操作:___________ 。
(4)已知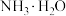 的电离常数
的电离常数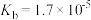 ,
, 的电离常数
的电离常数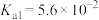 、
、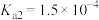 。则
。则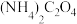 溶液中各离子浓度由大到小的顺序为
溶液中各离子浓度由大到小的顺序为___________ 。
 ,还含有少量铝箔、
,还含有少量铝箔、 等杂质)制备
等杂质)制备 的工艺流程如图所示。
的工艺流程如图所示。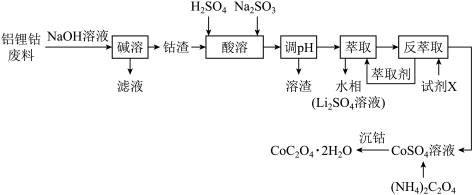
 具有较强氧化性,
具有较强氧化性, 、
、 均难溶于水。
均难溶于水。回答下列问题:
(1)写出增大“碱溶”速率的一种方法:
(2)“酸溶”时,
 发生反应的离子方程式为
发生反应的离子方程式为(3)已知
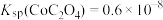 ,要使溶液中的
,要使溶液中的 完全沉淀(即
完全沉淀(即 浓度小于
浓度小于  ),则溶液中
),则溶液中 浓度最小为
浓度最小为 ;简述洗涤
;简述洗涤 的操作:
的操作:(4)已知
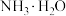 的电离常数
的电离常数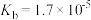 ,
, 的电离常数
的电离常数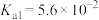 、
、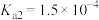 。则
。则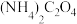 溶液中各离子浓度由大到小的顺序为
溶液中各离子浓度由大到小的顺序为
您最近一年使用:0次
解题方法
5 .  为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.12 g金刚石中的共价键数目为 |
B.2.0 L 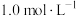 AlCl3溶液中, AlCl3溶液中, 的数目为 的数目为 |
C.用惰性电极电解饱和食盐水,若阴极产生11.2 L气体,则线路中通过 个电子 个电子 |
D.室温下,1 L pH=12的Na2CO3溶液中, 的数目为 的数目为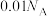 |
您最近一年使用:0次
解题方法
6 . 常温下,向二元弱酸H2A溶液中,滴加NaOH溶液,混合溶液中lgX[ 或
或 ]与pH的变化关系如下图所示,下列说法不正确的是
]与pH的变化关系如下图所示,下列说法不正确的是
 或
或 ]与pH的变化关系如下图所示,下列说法不正确的是
]与pH的变化关系如下图所示,下列说法不正确的是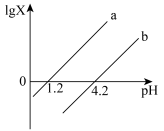
A.直线a表示 与pH的变化关系 与pH的变化关系 |
| B.室温下NaHA溶液呈碱性 |
C.加入NaOH溶液的过程中,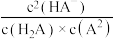 不变 不变 |
D.当溶液中 时, 时, |
您最近一年使用:0次
昨日更新
|
76次组卷
|
2卷引用:河北省唐山市2024-2025学年高三上学期摸底演练化学试题
7 . 下表是 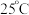 时三种弱酸的电离平衡常数
时三种弱酸的电离平衡常数
(1)下列事实不能证明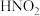 是弱电解质的是
是弱电解质的是_______ 。
①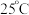 时,
时,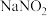 溶液
溶液 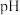 大于7
大于7
②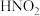 不稳定,受热易分解
不稳定,受热易分解
③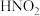 和
和  不能发生反应
不能发生反应
④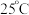 时
时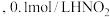 溶液的
溶液的 
⑤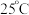 时
时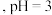 的
的 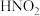 溶液和
溶液和  的
的  溶液等体积混合,所得溶液
溶液等体积混合,所得溶液  小于 7
小于 7
⑥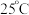 时,
时, 的
的 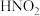 溶液稀释至100倍
溶液稀释至100倍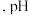 约为
约为 
(2)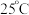 时,物质的量浓度相同的四种溶液:①
时,物质的量浓度相同的四种溶液:① 溶液;②
溶液;② 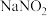 溶液;③
溶液;③  溶液;④
溶液;④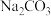 溶液,其
溶液,其  由大到小的顺序是
由大到小的顺序是____ (填序号)。水是生活中常用的溶剂,与其状态密不可分,请从结构角度分析水通常状况下呈液态的原因 _______ 。
(3)已知常温下 的
的 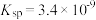 ,现将浓度为
,现将浓度为 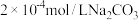 溶液与
溶液与 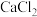 溶液等体积混合,则生成
溶液等体积混合,则生成  沉淀所需
沉淀所需 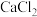 溶液的最小浓度为
溶液的最小浓度为_____  ;向
;向 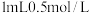 的
的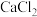 溶液中滴入
溶液中滴入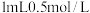 的
的  溶液,观察到有白色沉淀和无色气体产生,则发生反应的离子方程式为
溶液,观察到有白色沉淀和无色气体产生,则发生反应的离子方程式为________ 。
(4)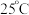 时,用
时,用  溶液吸收
溶液吸收  得到
得到  的混合溶液,试计算所得溶液中
的混合溶液,试计算所得溶液中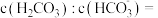
_______ (用比例式表示)。
(5)如下图为某实验测得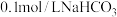 溶液在升温过程中(不考虑水挥发)的
溶液在升温过程中(不考虑水挥发)的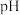 变化曲线。下列说法正确的是_______(填标号)。
变化曲线。下列说法正确的是_______(填标号)。
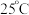 时三种弱酸的电离平衡常数
时三种弱酸的电离平衡常数| 化学式 | 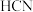 | 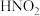 |  |
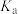 | 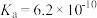 | 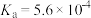 | 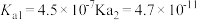 |
(1)下列事实不能证明
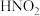 是弱电解质的是
是弱电解质的是①
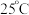 时,
时,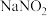 溶液
溶液 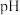 大于7
大于7②
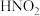 不稳定,受热易分解
不稳定,受热易分解③
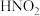 和
和  不能发生反应
不能发生反应④
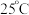 时
时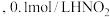 溶液的
溶液的 
⑤
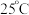 时
时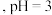 的
的 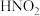 溶液和
溶液和  的
的  溶液等体积混合,所得溶液
溶液等体积混合,所得溶液  小于 7
小于 7⑥
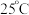 时,
时, 的
的 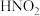 溶液稀释至100倍
溶液稀释至100倍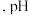 约为
约为 
(2)
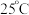 时,物质的量浓度相同的四种溶液:①
时,物质的量浓度相同的四种溶液:① 溶液;②
溶液;②  溶液;③
溶液;③  溶液;④
溶液;④ 溶液,其
溶液,其  由大到小的顺序是
由大到小的顺序是(3)已知常温下
 的
的 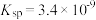 ,现将浓度为
,现将浓度为 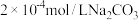 溶液与
溶液与 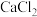 溶液等体积混合,则生成
溶液等体积混合,则生成  沉淀所需
沉淀所需 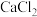 溶液的最小浓度为
溶液的最小浓度为 ;向
;向 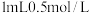 的
的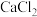 溶液中滴入
溶液中滴入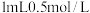 的
的  溶液,观察到有白色沉淀和无色气体产生,则发生反应的离子方程式为
溶液,观察到有白色沉淀和无色气体产生,则发生反应的离子方程式为(4)
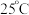 时,用
时,用  溶液吸收
溶液吸收  得到
得到  的混合溶液,试计算所得溶液中
的混合溶液,试计算所得溶液中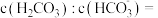
(5)如下图为某实验测得
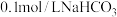 溶液在升温过程中(不考虑水挥发)的
溶液在升温过程中(不考虑水挥发)的 变化曲线。下列说法正确的是_______(填标号)。
变化曲线。下列说法正确的是_______(填标号)。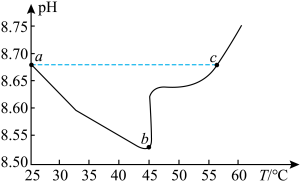
A. 点时,溶液 点时,溶液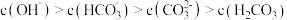 |
B. 点溶液的 点溶液的  比 比  点溶液的 点溶液的 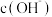 小 小 |
C.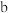 点溶液中 点溶液中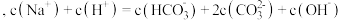 |
D.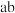 段 段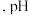 减小说明升温促进了 减小说明升温促进了 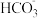 的电离,同时抑制了 的电离,同时抑制了 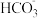 的水解 的水解 |
您最近一年使用:0次
解题方法
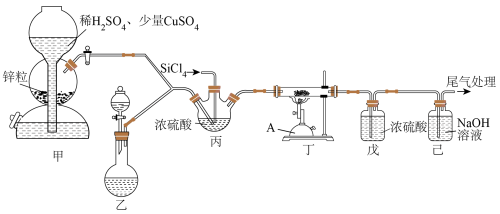
8 . 氮化硅陶瓷是一种烧结时不收缩的无机材料陶瓷。以N2、H2、SiCl4气体(沸点57.6℃,极易水解,具有腐蚀性)为原料在高温下制备氮化硅的实验装置如图。
(1)仪器“A”的名称为______ 。甲中少量CuSO4的作用为______ 。
(2)乙中为NH4Cl和NaNO2的浓溶液,85℃发生反应,离子方程式为______ ,该反应的加热方式为______ 。
(3)丁装置中反应的化学方程式为______ 。戊装置的作用为______ 。
(4)实验结束时,停止加热丁装置,再通入一段时间的氮气,目的是______ 。
(5)实验结束后丁装置硬质玻璃管增重2.8g,己装置增重15.56g,该实验氮化硅的产率为______ (不考虑SiCl4在丙和戊中的损耗)。
(1)仪器“A”的名称为
(2)乙中为NH4Cl和NaNO2的浓溶液,85℃发生反应,离子方程式为
(3)丁装置中反应的化学方程式为
(4)实验结束时,停止加热丁装置,再通入一段时间的氮气,目的是
(5)实验结束后丁装置硬质玻璃管增重2.8g,己装置增重15.56g,该实验氮化硅的产率为
您最近一年使用:0次
解题方法
9 . 人体血液的 通常维持在7.35~7.45之间的原因是血液中存在
通常维持在7.35~7.45之间的原因是血液中存在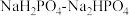 等缓冲体系。常温下:
等缓冲体系。常温下: 、
、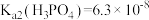 ;
;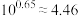 。下列指定溶液中微粒物质的量浓度关系正确的是
。下列指定溶液中微粒物质的量浓度关系正确的是
 通常维持在7.35~7.45之间的原因是血液中存在
通常维持在7.35~7.45之间的原因是血液中存在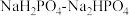 等缓冲体系。常温下:
等缓冲体系。常温下: 、
、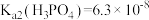 ;
;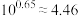 。下列指定溶液中微粒物质的量浓度关系正确的是
。下列指定溶液中微粒物质的量浓度关系正确的是A. 的 的 溶液: 溶液: |
B.常温下,血液中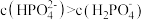 |
C.向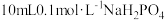 溶液中加入 溶液中加入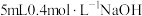 溶液后充分混合: 溶液后充分混合: |
D.物质的量浓度相等的 和 和 溶液等体积混合: 溶液等体积混合: |
您最近一年使用:0次
10 . 中学化学常见的滴定法包括中和滴定法、氧化还原滴定法等。
Ⅰ.草酸晶体的组成可表示为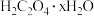 ,通过下列实验测定
,通过下列实验测定 值,步骤如下:
值,步骤如下:
①称取 草酸晶体配成
草酸晶体配成 水溶液。
水溶液。
②取 所配草酸溶液置于锥形瓶中,加入适量稀硫酸,用
所配草酸溶液置于锥形瓶中,加入适量稀硫酸,用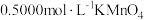 溶液进行滴定,到达滴定终点时,消耗
溶液进行滴定,到达滴定终点时,消耗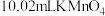 溶液。
溶液。
③重复②步骤2次,消耗 溶液的体积分别为
溶液的体积分别为 和
和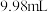 。已知:
。已知: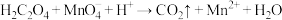 (方程式未配平)
(方程式未配平)
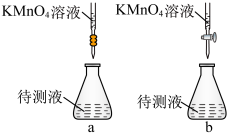
(1)下列滴定装置中(夹持部分略去),最合理的是:___________ (填字母序号)。___________ 。
(3)其它操作正确的情况下,以下操作会使测定的 值偏小的是
值偏小的是___________ 。
A.装待测液前,锥形瓶中有少量水
B.滴定时,不慎将锥形瓶内溶液溅出
C.开始滴定时滴定管尖嘴处有气泡,滴定结束气泡消失
D.滴定终点读数时,俯视滴定管的刻度
E.滴定管使用前,水洗后未用 标准溶液润洗
标准溶液润洗
(4)根据以上实验数据计算 值
值___________ 。
Ⅱ.常温下,向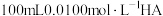 的溶液中逐滴加入
的溶液中逐滴加入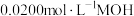 溶液,所得溶液的
溶液,所得溶液的 随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。
随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。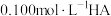 溶液中由水电离出的
溶液中由水电离出的
___________  。
。
(6)常温下一定浓度的MA稀溶液的 ,则
,则
___________ 7(填“>”、“<”或“=”。)
(7) 点时,溶液中
点时,溶液中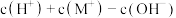 =
=___________  。
。
Ⅰ.草酸晶体的组成可表示为
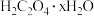 ,通过下列实验测定
,通过下列实验测定 值,步骤如下:
值,步骤如下:①称取
 草酸晶体配成
草酸晶体配成 水溶液。
水溶液。②取
 所配草酸溶液置于锥形瓶中,加入适量稀硫酸,用
所配草酸溶液置于锥形瓶中,加入适量稀硫酸,用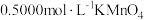 溶液进行滴定,到达滴定终点时,消耗
溶液进行滴定,到达滴定终点时,消耗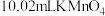 溶液。
溶液。③重复②步骤2次,消耗
 溶液的体积分别为
溶液的体积分别为 和
和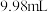 。已知:
。已知: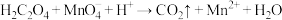 (方程式未配平)
(方程式未配平)(1)下列滴定装置中(夹持部分略去),最合理的是:
(3)其它操作正确的情况下,以下操作会使测定的
 值偏小的是
值偏小的是A.装待测液前,锥形瓶中有少量水
B.滴定时,不慎将锥形瓶内溶液溅出
C.开始滴定时滴定管尖嘴处有气泡,滴定结束气泡消失
D.滴定终点读数时,俯视滴定管的刻度
E.滴定管使用前,水洗后未用
 标准溶液润洗
标准溶液润洗(4)根据以上实验数据计算
 值
值Ⅱ.常温下,向
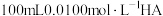 的溶液中逐滴加入
的溶液中逐滴加入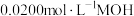 溶液,所得溶液的
溶液,所得溶液的 随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。
随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。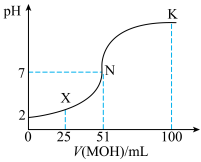
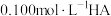 溶液中由水电离出的
溶液中由水电离出的
 。
。(6)常温下一定浓度的MA稀溶液的
 ,则
,则
(7)
 点时,溶液中
点时,溶液中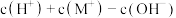 =
= 。
。
您最近一年使用:0次



