名校
1 . 设计物质间的转化途径,是认识和研究物质及其变化的一种常用的科学方法。物质 能发生连续氧化,
能发生连续氧化,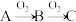 (其他反应条件未标出)
(其他反应条件未标出)
(1)若 为单质,
为单质, 与水反应生成二元强酸,写出
与水反应生成二元强酸,写出 反应的化学方程式
反应的化学方程式___________ ,B与一种黄绿色气体等体积通入到水中发生反应也可生成该二元强酸。写出该反应的离子方程式_________ 。
(2)若 为单质,
为单质, 与水反应生成一元强碱,
与水反应生成一元强碱, 中阴阳离子的个数比是
中阴阳离子的个数比是___________ ,C的电子式____________ , 反应消耗标准状况下
反应消耗标准状况下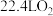 ,转移的电子数是
,转移的电子数是_________ 。
(3)若 氢化物,
氢化物, 与水反应生成一元强酸,
与水反应生成一元强酸, 的浓溶液可用于检查氯气管道是否发生泄露,如泄露看到的现象是
的浓溶液可用于检查氯气管道是否发生泄露,如泄露看到的现象是_____________ ,吸收 的装置合理的是
的装置合理的是_____________ (填序号)。
 能发生连续氧化,
能发生连续氧化,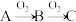 (其他反应条件未标出)
(其他反应条件未标出)(1)若
 为单质,
为单质, 与水反应生成二元强酸,写出
与水反应生成二元强酸,写出 反应的化学方程式
反应的化学方程式(2)若
 为单质,
为单质, 与水反应生成一元强碱,
与水反应生成一元强碱, 中阴阳离子的个数比是
中阴阳离子的个数比是 反应消耗标准状况下
反应消耗标准状况下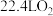 ,转移的电子数是
,转移的电子数是(3)若
 氢化物,
氢化物, 与水反应生成一元强酸,
与水反应生成一元强酸, 的浓溶液可用于检查氯气管道是否发生泄露,如泄露看到的现象是
的浓溶液可用于检查氯气管道是否发生泄露,如泄露看到的现象是 的装置合理的是
的装置合理的是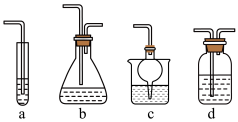
您最近半年使用:0次
2 . 在化工生产中,硫资源应用广泛,利用含硫物质之间的转化有利于实现硫资源的综合利用。下图为硫及其化合物的“价—类”二维图。
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的物质有______ ,______ (填化学式,任写两种)。
(2)写出Cu和Z的浓溶液发生反应的化学方程式__________________ 。
(3)将Y通入品红溶液中,可观察到的现象是______________________________ 。
(4)工业上处理废气时,通过步骤IⅡ和步骤w将Y转化为CaSO4再利用。
①实现步骤I的转化所加试剂是______ (写出一种即可)。
②实现步骤Ⅱ的转化可选择______ 试剂(填序号)。
A.O2 B.KI C.H2O2 D.Na2S
(5)欲制备Na2S2O3,从氧化还原角度分析,合理的是______(填序号)。
(6)将H2S与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为______ 。
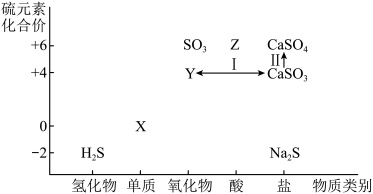
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的物质有
(2)写出Cu和Z的浓溶液发生反应的化学方程式
(3)将Y通入品红溶液中,可观察到的现象是
(4)工业上处理废气时,通过步骤IⅡ和步骤w将Y转化为CaSO4再利用。
①实现步骤I的转化所加试剂是
②实现步骤Ⅱ的转化可选择
A.O2 B.KI C.H2O2 D.Na2S
(5)欲制备Na2S2O3,从氧化还原角度分析,合理的是______(填序号)。
| A.Na2S+S | B.Na2SO3+S | C.Na2SO3+Na2SO4 | D.SO2+Na2SO4 |
(6)将H2S与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为
您最近半年使用:0次
名校
3 . 工业及汽车尾气已成为城市空气的主要污染源,研究其反应机理对于环境治理有重要意义。
(1)硝酸厂尾气可以回收制备硝酸。已知:
①2NO(g)+O2(g)=2NO2(g) △H1=-113.0 kJ/mol
②3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ/mol
4NO2(g)+O2(g)+2H2O(g)=4HNO3(g) △H=___________ kJ/mol。
(2)液氨催化还原NO是重要的烟气脱硝技术。使用Fe2O3为催化剂,可能的反应过程如图所示。___________ 。
②反应过程图中,虚线方框里的过程可描述为___________ 。
③氨氮比会直接影响该方法的脱硝率。350℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系如图所示。当 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是___________ 。
NO2被Na2CO3溶液吸收生成的三种盐分别是NaNO2、NaNO3和___________ 。(填化学式)
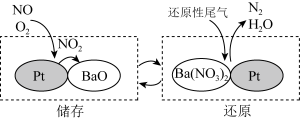
(4)NSR (NOX储存还原)可有效减少氮氧化物排放。工作原理:通过BaO和Ba(NO3)2的相互转化实现NOX的储存和还原,如图所示。___________ 。
(1)硝酸厂尾气可以回收制备硝酸。已知:
①2NO(g)+O2(g)=2NO2(g) △H1=-113.0 kJ/mol
②3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ/mol
4NO2(g)+O2(g)+2H2O(g)=4HNO3(g) △H=
(2)液氨催化还原NO是重要的烟气脱硝技术。使用Fe2O3为催化剂,可能的反应过程如图所示。
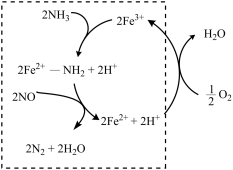
②反应过程图中,虚线方框里的过程可描述为
③氨氮比会直接影响该方法的脱硝率。350℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系如图所示。当
 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是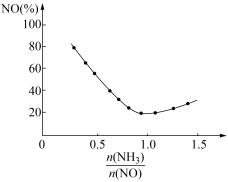
NO2被Na2CO3溶液吸收生成的三种盐分别是NaNO2、NaNO3和
(4)NSR (NOX储存还原)可有效减少氮氧化物排放。工作原理:通过BaO和Ba(NO3)2的相互转化实现NOX的储存和还原,如图所示。
您最近半年使用:0次
名校
解题方法
4 . 硅单质及其化合物应用广泛。请回答下列问题:
(1)硅元素在元素周期表的位置是___________ 。
(2)沙子可用作建筑材料和制玻璃的原料,下列说法正确的是___________ (填字母)。
A.SiO2可用于制造光导纤维而不能直接作芯片
B.SiO2既能溶于氢氟酸、也能溶于氢氧化钠,是两性氧化物
C.普通玻璃是由SiO2、石灰石和纯碱制成的,其熔点很高
(3)硅单质可作为硅半导体材料。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程如图:___________ 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和一种气体单质,写出发生反应的化学方程式___________ 。
(4)新型陶瓷材料氮化硅(Si3N4)可应用于原子反应堆,一种制备氮化硅的反应如下:
3SiO2+6C+2N2 Si3N4+6CO。若生成标准状况下33.6 L CO时,反应过程中转移的电子为
Si3N4+6CO。若生成标准状况下33.6 L CO时,反应过程中转移的电子为___________ mol。
(5)某同学设计的如图实验装置证明非金属性:N>C>Si。
你认为该同学实验能否说明N、C、Si的非金属性强弱,
若能或者不能,请用必要的文字及化学方程式说明___________ 。
(1)硅元素在元素周期表的位置是
(2)沙子可用作建筑材料和制玻璃的原料,下列说法正确的是
A.SiO2可用于制造光导纤维而不能直接作芯片
B.SiO2既能溶于氢氟酸、也能溶于氢氧化钠,是两性氧化物
C.普通玻璃是由SiO2、石灰石和纯碱制成的,其熔点很高
(3)硅单质可作为硅半导体材料。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程如图:
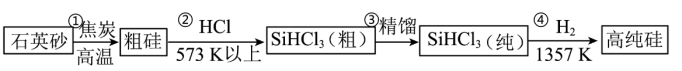
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和一种气体单质,写出发生反应的化学方程式
(4)新型陶瓷材料氮化硅(Si3N4)可应用于原子反应堆,一种制备氮化硅的反应如下:
3SiO2+6C+2N2
 Si3N4+6CO。若生成标准状况下33.6 L CO时,反应过程中转移的电子为
Si3N4+6CO。若生成标准状况下33.6 L CO时,反应过程中转移的电子为(5)某同学设计的如图实验装置证明非金属性:N>C>Si。
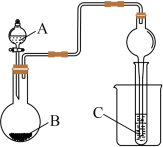
你认为该同学实验能否说明N、C、Si的非金属性强弱,
若能或者不能,请用必要的文字及化学方程式说明
您最近半年使用:0次
2024-04-16更新
|
412次组卷
|
2卷引用:江苏省南京市六校联合体考试2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
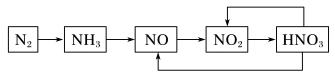
5 . 下图是氮气及几种氮的化合物间的转换关系。请回答下列问题:___________ 。
(2)工业上常用 制取
制取 ,请写出反应的化学方程式
,请写出反应的化学方程式___________ 。
(3)实验室里常用Cu与稀硝酸反应制取 ,当生成标准状况下3.36L
,当生成标准状况下3.36L 时,转移的电子数目为
时,转移的电子数目为___________ 。
(4)生产硝酸时排放的 会污染环境,一种治理方案是用氨气在催化剂作用下将
会污染环境,一种治理方案是用氨气在催化剂作用下将 还原成
还原成 ,请配平化学方程式:
,请配平化学方程式:___________ 。
___________ ___________
___________
 ___________
___________ ___________
___________
(5)有一瓶稀硫酸和稀硝酸的混合溶液,其中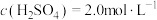 ,
,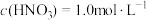 。取
。取 该混合溶液与12.8g铜粉反应,标准状况下生成
该混合溶液与12.8g铜粉反应,标准状况下生成 的体积为
的体积为___________ L。
(2)工业上常用
 制取
制取 ,请写出反应的化学方程式
,请写出反应的化学方程式(3)实验室里常用Cu与稀硝酸反应制取
 ,当生成标准状况下3.36L
,当生成标准状况下3.36L 时,转移的电子数目为
时,转移的电子数目为(4)生产硝酸时排放的
 会污染环境,一种治理方案是用氨气在催化剂作用下将
会污染环境,一种治理方案是用氨气在催化剂作用下将 还原成
还原成 ,请配平化学方程式:
,请配平化学方程式:___________
 ___________
___________
 ___________
___________ ___________
___________
(5)有一瓶稀硫酸和稀硝酸的混合溶液,其中
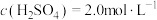 ,
,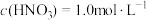 。取
。取 该混合溶液与12.8g铜粉反应,标准状况下生成
该混合溶液与12.8g铜粉反应,标准状况下生成 的体积为
的体积为
您最近半年使用:0次
名校
解题方法
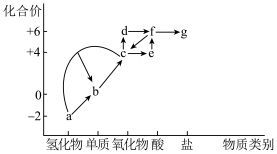
6 . “价-类”二维图是研究物质性质的重要工具,如图是硫元素的“价-类”二维图。回答下列问题:_______ 。(任写两种)
(2)反应a+c→b中,氧化产物与还原产物的物质的量之比为_______ 。
(3)溶液e久置于空气中会生成f,该过程溶液的酸性_____ (填“增强”或“减弱”)。
(4)Cl2和c都有漂白作用,先将二者以等物质的量混合后再通入到品红溶液中,品红溶液______ (填褪色或不褪色),反应的化学方程式为________ 。
(5)将c通入到酸性KMnO4溶液中,溶液颜色逐渐变浅,该反应中c表现出______ (填“还原”或“漂白”)性。
(6)为避免硝酸工业尾气中氮的氧化物(以NO2为例)污染环境,可在“尾气处理装置”中盛装NaOH溶液(生成产物之一为NaNO2),相关反应的化学方程式为_____ 。
(2)反应a+c→b中,氧化产物与还原产物的物质的量之比为
(3)溶液e久置于空气中会生成f,该过程溶液的酸性
(4)Cl2和c都有漂白作用,先将二者以等物质的量混合后再通入到品红溶液中,品红溶液
(5)将c通入到酸性KMnO4溶液中,溶液颜色逐渐变浅,该反应中c表现出
(6)为避免硝酸工业尾气中氮的氧化物(以NO2为例)污染环境,可在“尾气处理装置”中盛装NaOH溶液(生成产物之一为NaNO2),相关反应的化学方程式为
您最近半年使用:0次
名校
7 . 氮及其化合物在农业、医药、国防等领域应用广泛。请回答下列问题。
(1)实验室加热 和
和 固体混合物制取
固体混合物制取 ,反应的化学方程式是
,反应的化学方程式是___________ 。
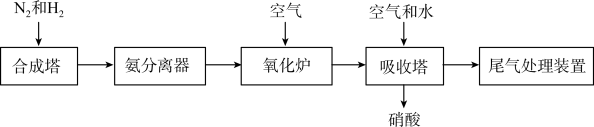
(2)工业合成氨及氨氧化制取硝酸的流程示意图如下。 ,说明
,说明 具有
具有___________ (填“氧化性”或“还原性”)。
②氧化炉中 转化为NO,发生反应的化学方程式是
转化为NO,发生反应的化学方程式是___________ 。
③吸收塔中NO最终可转化为 。通入空气是为了提供
。通入空气是为了提供___________ (填化学式)。
(3)氮元素含量过高会造成水体污染,添加铁粉能够提高氮的脱除率,工艺如下图所示。试从价态角度分析原因___________ 。
(1)实验室加热
 和
和 固体混合物制取
固体混合物制取 ,反应的化学方程式是
,反应的化学方程式是(2)工业合成氨及氨氧化制取硝酸的流程示意图如下。
 ,说明
,说明 具有
具有②氧化炉中
 转化为NO,发生反应的化学方程式是
转化为NO,发生反应的化学方程式是③吸收塔中NO最终可转化为
 。通入空气是为了提供
。通入空气是为了提供(3)氮元素含量过高会造成水体污染,添加铁粉能够提高氮的脱除率,工艺如下图所示。试从价态角度分析原因
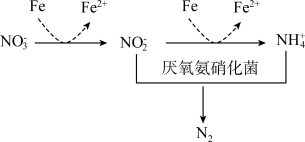
您最近半年使用:0次
名校
8 . 我国考古学家对“南澳一号”沉船进行了考古探索,从沉船中发现了大量宋代精美瓷器,体现了灿烂的中华文明。青花瓷胎体的原料——高岭土[AlSiO5(OH)x],可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石(KAlSi3O8),在1300℃左右一次烧成的釉可形成精美的青花瓷。
(1)下列说法正确的是___________(填字母)。
(2)在“南澳一号”考古直播过程中,需用高纯度SiO2制造的光纤。下图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程。___________ 。
②二氧化硅与氢氧化钠溶液反应的离子方程式是___________ 。
③在以上流程中,要将洗净的石英砂研磨成粉末,目的是___________ 。
④工业上常用纯净石英砂与C在高温下发生反应制造粗硅,粗硅中含有SiC,其中Si和SiC的物质的量之比为1∶1,下列说法正确的是___________ (填字母)。
A.制造粗硅时的反应为2SiO2+5C Si+SiC+4CO↑
Si+SiC+4CO↑
B.在以上流程中,将盐酸改为NaOH溶液,也可达到目的
C.晶体硅主要用途是制造光导纤维
(1)下列说法正确的是___________(填字母)。
| A.高岭土分子中x=2 |
| B.钾长石能完全溶解在盐酸中形成澄清的溶液 |
| C.烧制青花瓷过程中发生了复杂的物理变化和化学变化 |
| D.青花瓷、玻璃、水泥都属于硅酸盐产品 |
(2)在“南澳一号”考古直播过程中,需用高纯度SiO2制造的光纤。下图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程。
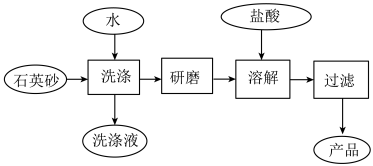
②二氧化硅与氢氧化钠溶液反应的离子方程式是
③在以上流程中,要将洗净的石英砂研磨成粉末,目的是
④工业上常用纯净石英砂与C在高温下发生反应制造粗硅,粗硅中含有SiC,其中Si和SiC的物质的量之比为1∶1,下列说法正确的是
A.制造粗硅时的反应为2SiO2+5C
 Si+SiC+4CO↑
Si+SiC+4CO↑B.在以上流程中,将盐酸改为NaOH溶液,也可达到目的
C.晶体硅主要用途是制造光导纤维
您最近半年使用:0次
名校
9 . 按要求完成问题。
(1)已知浓硫酸具有以下性质:a强氧化性b吸水性c酸性d脱水性,在下列现象中,分别体现了浓硫酸的什么性质,请把选项填在相应的横线上:
①浓硫酸与铜加热反应_______ ;
②浓硫酸与氧化亚铁反应_______ ;
③浓硫酸使蔗糖碳化_______ ;
④浓硫酸与碳单质反应_______ 。
(2)请写出热的强碱NaOH除去试管内壁附着的硫的化学方程式:_______ 。
(3)实验室用固固加热制取氨气的化学方程式:_______ 。
(4)用氢氟酸雕刻玻璃的化学方程式:_______ 。
(5)用氢氧化钠溶液吸收NO2的化学方程式:_______ 。
(1)已知浓硫酸具有以下性质:a强氧化性b吸水性c酸性d脱水性,在下列现象中,分别体现了浓硫酸的什么性质,请把选项填在相应的横线上:
①浓硫酸与铜加热反应
②浓硫酸与氧化亚铁反应
③浓硫酸使蔗糖碳化
④浓硫酸与碳单质反应
(2)请写出热的强碱NaOH除去试管内壁附着的硫的化学方程式:
(3)实验室用固固加热制取氨气的化学方程式:
(4)用氢氟酸雕刻玻璃的化学方程式:
(5)用氢氧化钠溶液吸收NO2的化学方程式:
您最近半年使用:0次
名校
解题方法
10 . 数形结合思想是化学学科的重要思维模式。如图为硫元素的“价—类”二维图,涉及H2S、S、X、Y、Z、M、N七种物质,请结合所学知识和图像使用正确的化学用语来作答:_____ 周期第_____ 族。
(2)从硫元素的化合价角度分析,图中所示物质既有氧化性又有还原性的氧化物是______ (填化学式),写出其与酸性高锰酸钾溶液反应的离子方程式________ 。
(3)常温下,以上不能被Z的浓溶液干燥的气体是______ (填化学式),原因是(写化学方程式)_____ 。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______ (填代号)。
a.Na2SO3+Na2SO4 b.Na2S+S c.Na2SO3+S d.SO2+Na2SO4
(5)X和H2S发生化学反应,氧化产物和还原产物的物质的量之比为____ 。
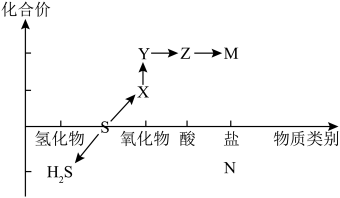
(2)从硫元素的化合价角度分析,图中所示物质既有氧化性又有还原性的氧化物是
(3)常温下,以上不能被Z的浓溶液干燥的气体是
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2SO3+Na2SO4 b.Na2S+S c.Na2SO3+S d.SO2+Na2SO4
(5)X和H2S发生化学反应,氧化产物和还原产物的物质的量之比为
您最近半年使用:0次



