解题方法
1 . 碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。
I.配制KI溶液
(1)配制500mL 的KI溶液,需要称取KI的质量为
的KI溶液,需要称取KI的质量为___________ g。
(2)下列关于配制KI溶液的操作错误的是___________(填序号)。
II.探究不同条件下空气中氧气氧化KI的速率。
(3)酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为___________ 。
(4)通过实验组别1和组别2探究温度对氧化速率的影响。其中a=___________ ,b=___________ 。
(5)设计实验组别3的目的是___________ 。
III.探究反应“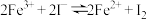 ”为可逆反应。
”为可逆反应。
试剂: KI溶液,
KI溶液,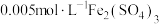 溶液,淀粉溶液,
溶液,淀粉溶液,
 溶液,KSCN溶液。实验如下:
溶液,KSCN溶液。实验如下:
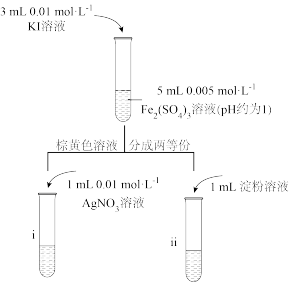
(6)甲同学通过试管i和试管ii中现象结合可证明该反应为可逆反应,则试管i中现象为___________ ;乙同学认为该现象无法证明该反应为可逆反应,原因为___________ 。
(7)请选择上述试剂重新设计实验,证明该反应为可逆反应:___________ 。
I.配制KI溶液
(1)配制500mL
 的KI溶液,需要称取KI的质量为
的KI溶液,需要称取KI的质量为(2)下列关于配制KI溶液的操作错误的是___________(填序号)。
A. | B.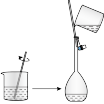 | C.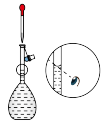 | D.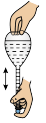 |
II.探究不同条件下空气中氧气氧化KI的速率。
| 组别 | 温度 | KI溶液 |  溶液 溶液 | 蒸馏水 | 淀粉溶液 | ||
| c(KI) | V | 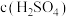 | V | ||||
| 1 | 298K |  | 5mL |  | 5mL | 10mL | 3滴 |
| 2 | 313K |  |  mL mL | 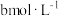 | 5mL | 10mL | 3滴 |
| 3 | 298K |  | 10mL |  | 5mL | 5mL | 3滴 |
(4)通过实验组别1和组别2探究温度对氧化速率的影响。其中a=
(5)设计实验组别3的目的是
III.探究反应“
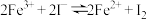 ”为可逆反应。
”为可逆反应。试剂:
 KI溶液,
KI溶液,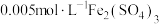 溶液,淀粉溶液,
溶液,淀粉溶液,
 溶液,KSCN溶液。实验如下:
溶液,KSCN溶液。实验如下:
(6)甲同学通过试管i和试管ii中现象结合可证明该反应为可逆反应,则试管i中现象为
(7)请选择上述试剂重新设计实验,证明该反应为可逆反应:
您最近一年使用:0次
2022-08-28更新
|
1032次组卷
|
3卷引用:广东省深圳市光明区2023届高三上学期第一次模拟考试化学试题
广东省深圳市光明区2023届高三上学期第一次模拟考试化学试题(已下线)回归教材重难点11 熟记“五气体”制备实验、“两定量”测定实验-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题
名校
2 . 铝土矿是生产金属铝的最佳原料,也是最主要的应用领域,其用量占世界铝土矿总产量的90%以上。以铝土矿(主要成分为Al2O3,含有Fe2O3和SiO2)等杂质)为原料,制备有机合成中的重要还原剂铝氢化钠(NaAlH4) 的一种工业流程如图:

已知: AlCl3、 NaH、NaAlH4遇水都能迅速发生反应。
(1)写出碱溶时发生反应的离子方程式:_______ 、_______ 。
(2)滤渣I中的主要成分为_______ (写物质名称)。
(3)写出反应I中主要反应的化学方程式:_______ 。
(4)甲同学设计了如图实验装置在实验室模拟制备无水氯化铝,应用该装置制备无水氯化铝,B、C中的试剂分别为_______ 和_______ 。

(5)A中发生反应的化学方程式为_______ ;该反应中氧化剂和还原剂的物质的量之比为_______ 。
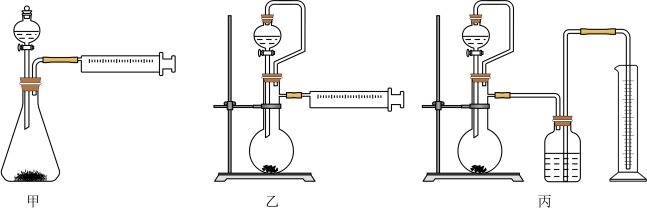
(6)乙同学设计了以下三种装置测定工业制取的铝氢化钠样品的纯度,从易操作、准确性角度考虑宜选择的装置是_______ (填“甲”“乙”或“丙”)

已知: AlCl3、 NaH、NaAlH4遇水都能迅速发生反应。
(1)写出碱溶时发生反应的离子方程式:
(2)滤渣I中的主要成分为
(3)写出反应I中主要反应的化学方程式:
(4)甲同学设计了如图实验装置在实验室模拟制备无水氯化铝,应用该装置制备无水氯化铝,B、C中的试剂分别为

(5)A中发生反应的化学方程式为
(6)乙同学设计了以下三种装置测定工业制取的铝氢化钠样品的纯度,从易操作、准确性角度考虑宜选择的装置是

您最近一年使用:0次
解题方法
3 . 完成下列填空:硼氧化钠(NaBH4)是合成中常用的还原剂。采用NaBO2为主要原料制备NaBH4(B元素化合价为+3)的反应为:NaBO2+SiO2+Na+H2 NaBH4+Na2SiO3(未配平);硅酸钠俗称泡花碱,又名水玻璃,在工业生产中也有广泛应用(已知硅酸为难溶性弱酸)
NaBH4+Na2SiO3(未配平);硅酸钠俗称泡花碱,又名水玻璃,在工业生产中也有广泛应用(已知硅酸为难溶性弱酸)
完成下列填空:
(1)上述反应中,原子最外层有两个未成对电子的元素是_____ (填元素符号)。SiO2熔点高的原因是_____ 。
(2)上述反应中H2与Na的物质的量之比为_____ 。
(3)硅酸钠水溶液产生硅酸(H2SiO3),硬化粘结,且有碱性,其原因是_____ (用离子方程式表示)。铸造工艺中可用氯化铵作为水玻璃的硬化剂。试用平衡原理加以解释_____ 。
(4)NaBH4可使许多金属离子还原成金属单质。例如它从含金离子(Au3+)的废液中提取Au.配平该反应的离子方程式:_____ Au3++_____ BH4﹣+_____ OH-→_____ Au+_____ BO2﹣+_____ H2O。
(5)最新研究发现以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,则每消耗1L6mol/L H2O2溶液,理论上流过电路中的电子数为_____ 。
 NaBH4+Na2SiO3(未配平);硅酸钠俗称泡花碱,又名水玻璃,在工业生产中也有广泛应用(已知硅酸为难溶性弱酸)
NaBH4+Na2SiO3(未配平);硅酸钠俗称泡花碱,又名水玻璃,在工业生产中也有广泛应用(已知硅酸为难溶性弱酸)完成下列填空:
(1)上述反应中,原子最外层有两个未成对电子的元素是
(2)上述反应中H2与Na的物质的量之比为
(3)硅酸钠水溶液产生硅酸(H2SiO3),硬化粘结,且有碱性,其原因是
(4)NaBH4可使许多金属离子还原成金属单质。例如它从含金离子(Au3+)的废液中提取Au.配平该反应的离子方程式:
(5)最新研究发现以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,则每消耗1L6mol/L H2O2溶液,理论上流过电路中的电子数为
您最近一年使用:0次
2010·江苏盐城·一模
解题方法
4 . 以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:

(1)生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是___ 。
(2)下列有关说法正确的是___________ 。
(3)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是___________________________________ 。
(4)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式___________ 。

(1)生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是
(2)下列有关说法正确的是
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
(3)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是
(4)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式
您最近一年使用:0次
真题
名校
5 . 下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
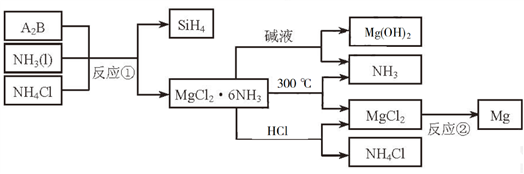
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________ ,Mg在元素周期表中的位置:_____________________ ,Mg(OH)2的电子式:____________________ 。
(2)A2B的化学式为_______________ 。反应②的必备条件是_______________ 。上图中可以循环使用的物质有_______________ 。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________ (写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________ 。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备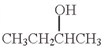 所需醛的可能结构简式:
所需醛的可能结构简式:_______________ 。

(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):
(2)A2B的化学式为
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备
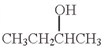 所需醛的可能结构简式:
所需醛的可能结构简式:
您最近一年使用:0次
2018-06-09更新
|
2994次组卷
|
13卷引用:2018年全国普通高等学校招生统一考试化学(天津卷)
2018年全国普通高等学校招生统一考试化学(天津卷)(已下线)2018年高考题及模拟题汇编 专题13 元素及其化合物知识的综合应用(已下线)高考母题题源15 物质结构与推断(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第2讲 铝及其化合物云南省玉溪元江民中2020届高三开学考试化学试题云南省石屏县第二中学2020届高三上学期开学考试化学试题云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题贵州省镇远县二中2019-2020学年高三上学期期末考试化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高一下学期期末考试化学试题云南省弥勒市第四中学2019-2020学年高二上学期开学考试化学试题云南省绿春县二中2019-2020学年高一上学期期中考试化学试题
6 . 铁的化合物在生产生活中应用广泛。工业上用废铁屑或炼铁废渣(主要成分Fe、 和少量CuO)制备硫酸亚铁,以硫酸亚铁为原料制备水处理剂——聚合硫酸铁
和少量CuO)制备硫酸亚铁,以硫酸亚铁为原料制备水处理剂——聚合硫酸铁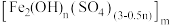 。
。
(1)利用废铁屑(含少量FeS)制备聚合硫酸铁的装置如下(支撑装置略):

①溶解:先用10%的碳酸钠溶液煮沸废铁屑,再用清水洗净,将处理好的铁屑放入装置中,组装仪器,加入适量稀硫酸溶解;硫酸用量不能过多,原因是___________ ;
②合成:待铁屑反应完全后,分批注入氯酸钾溶液并搅拌,放置一段时间;写出 、
、 、
、 搅拌生成
搅拌生成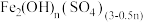 的化学反应方程式
的化学反应方程式___________ 。
③检验:检验甲装置中亚铁离子减少到规定浓度即可结束反应,制得产品。
(2)为了确定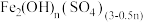 的组成,设计如下实验。
的组成,设计如下实验。
步骤一:取聚合硫酸铁样品25.00mL,加入足量的 溶液,产生白色沉淀,过滤、洗涤、干燥,称重,沉淀质量为2.9125g。
溶液,产生白色沉淀,过滤、洗涤、干燥,称重,沉淀质量为2.9125g。
步骤二:另取25.00mL聚合硫酸铁样品,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00mL溶液,取该溶液25.00mL,用酸性 溶液滴定,到达终点时用去
溶液滴定,到达终点时用去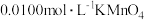 标准溶液20.00mL,求:
标准溶液20.00mL,求: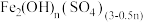 组成。(写出计算过程)
组成。(写出计算过程) ___________
(3)用炼铁废渣制备硫酸亚铁晶体,请补充完整实验方案:
已知:溶液中各离子开始沉淀和沉淀完全的PH值
取一定量的炼铁废渣,加入适量的1.0mol/L硫酸充分溶解,___________ 将滤液蒸发浓缩,冷却结晶,过滤,洗涤,干燥得硫酸亚铁晶体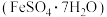 。(必选的试剂
。(必选的试剂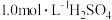 溶液、
溶液、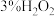 溶液、
溶液、 溶液、还原铁粉)
溶液、还原铁粉)
 和少量CuO)制备硫酸亚铁,以硫酸亚铁为原料制备水处理剂——聚合硫酸铁
和少量CuO)制备硫酸亚铁,以硫酸亚铁为原料制备水处理剂——聚合硫酸铁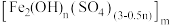 。
。(1)利用废铁屑(含少量FeS)制备聚合硫酸铁的装置如下(支撑装置略):

①溶解:先用10%的碳酸钠溶液煮沸废铁屑,再用清水洗净,将处理好的铁屑放入装置中,组装仪器,加入适量稀硫酸溶解;硫酸用量不能过多,原因是
②合成:待铁屑反应完全后,分批注入氯酸钾溶液并搅拌,放置一段时间;写出
 、
、 、
、 搅拌生成
搅拌生成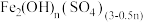 的化学反应方程式
的化学反应方程式③检验:检验甲装置中亚铁离子减少到规定浓度即可结束反应,制得产品。
(2)为了确定
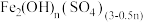 的组成,设计如下实验。
的组成,设计如下实验。步骤一:取聚合硫酸铁样品25.00mL,加入足量的
 溶液,产生白色沉淀,过滤、洗涤、干燥,称重,沉淀质量为2.9125g。
溶液,产生白色沉淀,过滤、洗涤、干燥,称重,沉淀质量为2.9125g。步骤二:另取25.00mL聚合硫酸铁样品,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00mL溶液,取该溶液25.00mL,用酸性
 溶液滴定,到达终点时用去
溶液滴定,到达终点时用去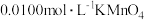 标准溶液20.00mL,求:
标准溶液20.00mL,求: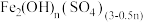 组成。(写出计算过程)
组成。(写出计算过程) (3)用炼铁废渣制备硫酸亚铁晶体,请补充完整实验方案:
已知:溶液中各离子开始沉淀和沉淀完全的PH值
 |  |  |  | |
| 开始沉淀pH | 7.6 | 2.3 | 4.5 | 4.4 |
| 沉淀完全pH | 9.1 | 3.3 | 5.6 | 6.4 |
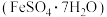 。(必选的试剂
。(必选的试剂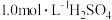 溶液、
溶液、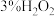 溶液、
溶液、 溶液、还原铁粉)
溶液、还原铁粉)
您最近一年使用:0次
7 . 有以下合成路线(部分反应条件已省略),下列有关说法错误的是


A.物质A的名称为乙炔,其电子式为 |
| B.物质B中所有原子可能共平面 |
| C.物质C的同分异构体中含有苯环且苯环上有两个取代基的有3种 |
| D.反应③的反应条件为O2、Cu加热,反应类型为氧化反应 |
您最近一年使用:0次
解题方法
8 . 吊白块(NaHSO2·HCHO·2H2O)可用作印染工业的还原剂、橡胶合成及制糖工业中的漂白剂。以SO2、纯碱、Zn及甲醛为原料生产吊白块及氧化锌的工艺流程如图:

已知:吊白块呈白色块状固体成结晶性粉状,易溶于水,微溶于乙醇,常温时较为稳定,高温下下具有强还原性:120℃以上会分解产生甲醛、二氧化硫和硫化氢等有毒气体。
回答下列问题:
(1)“反应Ⅰ”发生后溶液的pH=4.1,则反应I的产物是__ 。
(2)设计反应Ⅱ后向反应Ⅲ中继续通入SO2的目的是得到NaHSO3过饱和溶液,从而生成Na2S2O5,则反应Ⅲ中发生反应的化学方程式为__ 。
(3)“反应Ⅳ”加热的方式最好选用__ (填“直接加热”或“水浴加热”);其反应的化学方程式为__ 。
(4)“过滤”得到的滤液蒸发浓缩时不能在敞口容器中进行,原因是__ ;洗涤时中的洗涤剂最好选择__ (填字母序号)。
A.水 B.无水乙醇 C.稀氢氧化钠溶液
(5)由“滤渣”制备氧化锌的方法是__ 。
(6)一种测定吊白块中硫的质量分数的方法如下:称取ag产品溶于适量水中,加入稍过量的碘水(反应生成NaHSO4和HCOOH),充分反应后加入足量BaCl2溶液,过滤,滤渣经干燥后称得质量为bg。则产品中硫的质量分数为__ (用含a、b的式子表示)。

已知:吊白块呈白色块状固体成结晶性粉状,易溶于水,微溶于乙醇,常温时较为稳定,高温下下具有强还原性:120℃以上会分解产生甲醛、二氧化硫和硫化氢等有毒气体。
回答下列问题:
(1)“反应Ⅰ”发生后溶液的pH=4.1,则反应I的产物是
(2)设计反应Ⅱ后向反应Ⅲ中继续通入SO2的目的是得到NaHSO3过饱和溶液,从而生成Na2S2O5,则反应Ⅲ中发生反应的化学方程式为
(3)“反应Ⅳ”加热的方式最好选用
(4)“过滤”得到的滤液蒸发浓缩时不能在敞口容器中进行,原因是
A.水 B.无水乙醇 C.稀氢氧化钠溶液
(5)由“滤渣”制备氧化锌的方法是
(6)一种测定吊白块中硫的质量分数的方法如下:称取ag产品溶于适量水中,加入稍过量的碘水(反应生成NaHSO4和HCOOH),充分反应后加入足量BaCl2溶液,过滤,滤渣经干燥后称得质量为bg。则产品中硫的质量分数为
您最近一年使用:0次
解题方法
9 . 氢气、氯气是中学实验室常见气体,在实验室可以利用该反应2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O,制备Cl2,并在实验室模拟工业制备盐酸,请回答下列问题:
(1)甲组同学用下列装置制取H2和Cl2。

①实验室常用NaCl+H2SO4(浓)→NaHSO4+HCl↑反应制备HCl气体,该反应利用了浓硫酸的___ 性。
②用工业级锌粒(主要成分 Zn,含少量 FeS、Pb、Cu 等杂质)作原料,装置 I、Ⅱ均可以制取 H2,但装置 I 比装置Ⅱ更好,理由__________________________ ;检验氯气所用的试纸是_______________ 。
(2)乙组同学拟用甲组的装置 I、Ⅲ及下列装置(可以重复选用)模拟工业上制取盐酸。

①乙组中氢气的部分实验装置连接是a-f-g-d……,其中装置Ⅴ的作用是_______ ,制取氯气并模拟合成盐酸的实验装置的合理连接顺序(用玻璃接口表示)为 c-__________ 。
②装置VII中仪器 X 的名称是_________ ,合成 HCl时需控制H2的体积略大于Cl2的体积,其目的是 ________ ;装置VII末端接抽气水泵的目的是___________ 。
(3)设计实验证明HCl极易溶于水且水溶液呈酸性:_____________________ 。
(1)甲组同学用下列装置制取H2和Cl2。

①实验室常用NaCl+H2SO4(浓)→NaHSO4+HCl↑反应制备HCl气体,该反应利用了浓硫酸的
②用工业级锌粒(主要成分 Zn,含少量 FeS、Pb、Cu 等杂质)作原料,装置 I、Ⅱ均可以制取 H2,但装置 I 比装置Ⅱ更好,理由
(2)乙组同学拟用甲组的装置 I、Ⅲ及下列装置(可以重复选用)模拟工业上制取盐酸。

①乙组中氢气的部分实验装置连接是a-f-g-d……,其中装置Ⅴ的作用是
②装置VII中仪器 X 的名称是
(3)设计实验证明HCl极易溶于水且水溶液呈酸性:
您最近一年使用:0次
10 . 氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,(已知SCl2的沸点为50℃),回答以下问题:
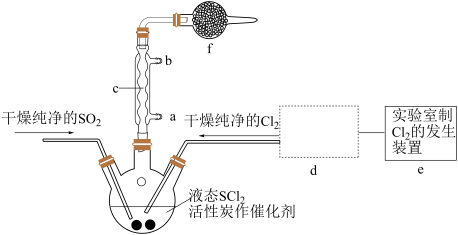
(1)下列四种制备SO2的方案中最佳选择是__ 。
(2)以MnO2和浓盐酸为原料制备Cl2的离子方程式为__ 。
(3)仪器f的作用是__ 。
(4)d的虚线框内隐含两个装置,按气流方向顺序这两个装置的药品分别是__ 。
(5)实验结束后,将三颈烧瓶混合物中产品分离出来的方法是__ 。
(6)若用SOCl2作FeCl3·6H2O的脱水剂,设计实验证明脱水时发生了氧化还原反应。取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡,往试管中加水溶解,滴加__ 或__ 溶液,证明脱水过程发生了氧化还原反应。

(1)下列四种制备SO2的方案中最佳选择是
| 方案 | A | B | C | D |
| 发生装置 | 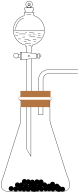 |  | 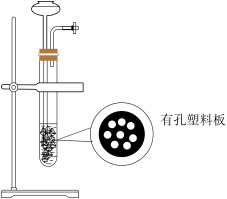 |  |
| 所选试剂 | 70%H2SO4+K2SO3 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | NaHSO3固体 |
(3)仪器f的作用是
(4)d的虚线框内隐含两个装置,按气流方向顺序这两个装置的药品分别是
(5)实验结束后,将三颈烧瓶混合物中产品分离出来的方法是
(6)若用SOCl2作FeCl3·6H2O的脱水剂,设计实验证明脱水时发生了氧化还原反应。取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡,往试管中加水溶解,滴加
您最近一年使用:0次



