1 . 某校化学兴趣小组为研究 的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
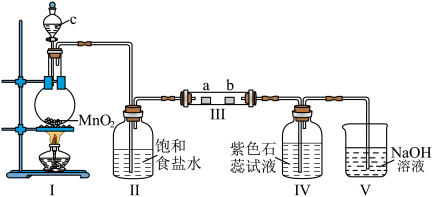
(1)装置Ⅰ中仪器c的名称是___________ ,实验室以二氧化锰和浓盐酸制备氯气的离子方程式为___________ 。
(2)装置Ⅱ中的试剂为___________ ,作用是___________ 。
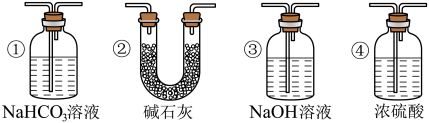
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加下图中的___________ (填序号)。
(4)若产生 足量,实验过程中装置Ⅳ中的实验现象为
足量,实验过程中装置Ⅳ中的实验现象为___________ 。
(5)写出装置Ⅴ中发生的离子方程式___________ 。
 的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
(1)装置Ⅰ中仪器c的名称是
(2)装置Ⅱ中的试剂为
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加下图中的

(4)若产生
 足量,实验过程中装置Ⅳ中的实验现象为
足量,实验过程中装置Ⅳ中的实验现象为(5)写出装置Ⅴ中发生的离子方程式
您最近一年使用:0次
解题方法
2 .  是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得
是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得 :
: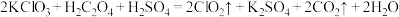 。下列说法正确的是
。下列说法正确的是
 是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得
是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得 :
: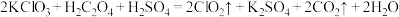 。下列说法正确的是
。下列说法正确的是A. 作还原剂 作还原剂 | B. 是氧化产物 是氧化产物 |
C. 在反应中被还原 在反应中被还原 | D.每产生135g  有2 NA个电子转移 有2 NA个电子转移 |
您最近一年使用:0次
3 . 钠和氯的化合物与生活密切相关,下列物质与其用途不符合的是
| A.小苏打用作制作馒头和面包的膨松剂 |
| B.漂白粉用作洪水过后环境的消毒剂 |
| C.次氯酸用作棉、麻和纸张的漂白剂 |
| D.纯碱用于治疗胃酸过多 |
您最近一年使用:0次
2023-10-05更新
|
34次组卷
|
2卷引用:江西省南昌市第一中学2022-2023学年高一上学期11月期中考试化学试题
4 . 数字化实验将传感器、数据采集器和计算机相连,可利用信息技术对化学实验进行数据的采集和分析。如图是数字化实验得到的光照过程中氯水的pH变化情况。对此,下列有关说法正确的是


| A.光照过程中,氯水pH减小的同时,溶液中Cl-的浓度也不断减小 |
| B.光照使氯水中的次氯酸分解为盐酸,溶液的酸性增强 |
| C.随着对氯水光照时间的延长,氯水的漂白性将增强 |
| D.pH减小的主要原因是光照引起Cl2溶解度减小,氯气逸出,溶液中H+浓度增大 |
您最近一年使用:0次
2023-10-05更新
|
42次组卷
|
17卷引用:江西省南昌市第一中学2022-2023学年高一上学期11月期中考试化学试题
江西省南昌市第一中学2022-2023学年高一上学期11月期中考试化学试题安徽省蚌埠市2021-2022学年高一上学期期末学业水平测试化学试题(已下线)2.2.1 氯气与水、碱的反应-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)广东省广州市育才中学2022-2023学年高一上学期期中考试化学试题广东深圳市第二高级中学2022-2023学年高一上学期10月测试化学试题山东省聊城第一中学2022-2023学年高一上学期11月期中考试化学试题 安徽省滁州市定远县育才学校2021-2022学年高一下学期开学摸底考试化学试题山东省青岛市即墨区2022-2023学年高一上学期期中考试化学试题(已下线)【2022】【高一上】【期中考】【杭九】【高中化学】【赵优萍收集】广东省广州市育才中学2022-2023学年高一上学期期中考试化学试题内蒙古包钢第一中学2022-2023学年高一上学期期中考试化学试题贵州省贵阳市清镇市第一中学2022-2023学年高一上学期期中考试化学试题辽宁省沈阳市第一二〇中学2021-2022学年高一上学期期中考试化学试题安徽省合肥市庐江县安徽师大附属庐江三中等3校2022-2023学年高一上学期期末考试化学试题广东省广州市禺山高级中学2023-2024学年高一上学期期中考试化学试题内蒙古科尔沁右翼前旗第二中学2023-2024学年高一上学期12月月考化学试题山东省临沂第十八中学2023-2024学年高一上学期1月份阶段性测试化学试题
名校
5 . 回答下列问题。
Ⅰ.新型冠状病毒肺炎疫情在全球多地爆发,“84消毒液”是大规模环境消毒剂。已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为___________  。(保留一位小数)
。(保留一位小数)
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。回答下列问题。
①配制一定物质的量浓度的上述消毒液需要选用如图所示的部分仪器,还需要的玻璃仪器是___________ (填仪器名称)

②若需配置质量分数为20%的NaClO消毒液,除需要托盘天平、药匙、玻璃棒、烧杯、胶头滴管外,还缺少的仪器是___________ 。
(3)请将下列各操作按正确的顺序将字母代号填写在横线上___________ 。
A.用托盘天平称取NaClO固体
B.塞好瓶塞,反复颠倒摇匀,装瓶,贴标签
C.加蒸馏水至离容量瓶瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至刻度线
D.用适量蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液一并转入容量瓶,并轻摇容量瓶使其混匀
E.待溶液冷却至室温,再将溶液转入容量瓶
F.将已称量的NaClO固体置于烧杯中,加适量蒸馏水溶解完全
(4)若所配制的次氯酸钠溶液的物质的量浓度偏小,则下列可能的原因分析中正确的是___________。
(5)某工厂将氯气通入到40%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为___________ kg(保留整数)。
Ⅰ.新型冠状病毒肺炎疫情在全球多地爆发,“84消毒液”是大规模环境消毒剂。已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
| 84消毒液 (有效成分)NaClO (规格)1000mL (质量分数)25% (密度) 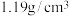 |
 。(保留一位小数)
。(保留一位小数)(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。回答下列问题。
①配制一定物质的量浓度的上述消毒液需要选用如图所示的部分仪器,还需要的玻璃仪器是

②若需配置质量分数为20%的NaClO消毒液,除需要托盘天平、药匙、玻璃棒、烧杯、胶头滴管外,还缺少的仪器是
(3)请将下列各操作按正确的顺序将字母代号填写在横线上
A.用托盘天平称取NaClO固体
B.塞好瓶塞,反复颠倒摇匀,装瓶,贴标签
C.加蒸馏水至离容量瓶瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至刻度线
D.用适量蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液一并转入容量瓶,并轻摇容量瓶使其混匀
E.待溶液冷却至室温,再将溶液转入容量瓶
F.将已称量的NaClO固体置于烧杯中,加适量蒸馏水溶解完全
(4)若所配制的次氯酸钠溶液的物质的量浓度偏小,则下列可能的原因分析中正确的是___________。
| A.配制前,容量瓶中有少量蒸馏水 | B.洗涤液未转移到容量瓶中 |
| C.未经冷却立即转液 | D.定容时,仰视溶液的凹液面 |
您最近一年使用:0次
名校
解题方法
6 . 氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2(难溶于稀硫酸)、Al2O3等,用硫酸渣制备铁红(Fe2O3)的过程如图,回答下列问题:

(1)“酸溶”过程中,加入过量的稀硫酸充分反应,反应后溶液中含有的金属阳离子除了Fe3+还有___________ (填离子符号),写出Fe2O3与稀硫酸反应的离子方程式:___________ 。
(2)“还原”过程中加入FeS2粉的目的是将溶液中的Fe3+还原为Fe2+,而FeS2自身被氧化为H2SO4,该反应中氧化剂和还原剂的物质的量之比为___________ 。
(3)“滤渣A”是SiO2,SiO2是一种常见的酸性氧化物,与CO2类似,都可与强碱反应,写出SiO2与NaOH溶液反应的化学方程式:___________ 。

(1)“酸溶”过程中,加入过量的稀硫酸充分反应,反应后溶液中含有的金属阳离子除了Fe3+还有
(2)“还原”过程中加入FeS2粉的目的是将溶液中的Fe3+还原为Fe2+,而FeS2自身被氧化为H2SO4,该反应中氧化剂和还原剂的物质的量之比为
(3)“滤渣A”是SiO2,SiO2是一种常见的酸性氧化物,与CO2类似,都可与强碱反应,写出SiO2与NaOH溶液反应的化学方程式:
您最近一年使用:0次
2023-10-05更新
|
158次组卷
|
2卷引用:江西省南昌市东湖区八一中学2022-2023学年高一上学期12月月考化学试题
名校
解题方法
7 . 2021年10月16日,载有三名航天员的神舟十三号载人飞船顺利进入太空。运载火箭和载人飞船使用了大量铝材,实现了多项科技创新。
(1)运载火箭和载人飞船上使用的铝材属于___________ (填“纯铝”或“铝合金”),其优点是___________ (写一条)。
(2)生产铝材时,可用NaOH溶液除去铝材表面的天然氧化膜,反应的离子方程式是___________ 。
(3)除去单质铁中含有的少量铝涉及到的离子方程式是___________ 。
(4)为了探究铁及其化合物的氧化性和还原性,某同学进行如下实验。补全下表。
(1)运载火箭和载人飞船上使用的铝材属于
(2)生产铝材时,可用NaOH溶液除去铝材表面的天然氧化膜,反应的离子方程式是
(3)除去单质铁中含有的少量铝涉及到的离子方程式是
(4)为了探究铁及其化合物的氧化性和还原性,某同学进行如下实验。补全下表。
| 序号 | 实验操作 | 实验现象 | 离子方程式 | 实验结论 |
| Ⅰ | 将一段打磨过的铁丝放入CuSO4溶液中,充分反应 | 溶液蓝色变浅,铁丝表面析出红色固体 | Fe具有还原性 | |
| Ⅱ | 向FeCl3溶液中加入过量铁粉 | Fe3+具有氧化性 | ||
| 向盛有FeCl3溶液的试管中滴加3滴KI溶液,然后滴加2滴淀粉溶液 | 溶液棕黄色加深,滴加淀粉溶液后变蓝色 | |||
| Ⅲ | 向FeCl2溶液中加入过量光亮的锌片,充分反应 | 浅绿色溶液变无色,锌片表面变暗 | Fe2+ + Zn= Fe + Zn2+ | |
| Ⅳ | 向FeCl2溶液中滴加新制的氯水 | 浅绿色溶液变棕黄色 | Fe2+具有还原性 |
您最近一年使用:0次
名校
8 . 根据所学知识填写下列空白。
(1)在标准状况下,6.72 L CO2质量为___________ g,其中含有氧原子数目为___________ 。
(2)在标准状况下,3.4 g氨气所占的体积约为___________ L,它与同条件下___________ mol H2S含有相同的氢原子数。
(3)V L Fe2(SO4)3溶液中含有a g SO ,取此溶液0.5 VL,用水稀释至2 VL,则稀释后溶液中SO
,取此溶液0.5 VL,用水稀释至2 VL,则稀释后溶液中SO 的物质的量浓度为
的物质的量浓度为___________ 。
(4)下列数量的各物质,所含原子个数由大到小的顺序是___________ (填序号)。
①0.5 mol SO3 ②标准状况下22.4 L He
③4℃时9 mL水(水的密度为1 g/mL) ④0.2 mol CH3COONH4
(5)在一密闭容器中充入a mol NO和b mol O2,可发生如下反应:2NO+O2=2NO2,充分反应后容器中氮原子和氧原子的个数之比为___________ 。
(1)在标准状况下,6.72 L CO2质量为
(2)在标准状况下,3.4 g氨气所占的体积约为
(3)V L Fe2(SO4)3溶液中含有a g SO
 ,取此溶液0.5 VL,用水稀释至2 VL,则稀释后溶液中SO
,取此溶液0.5 VL,用水稀释至2 VL,则稀释后溶液中SO 的物质的量浓度为
的物质的量浓度为(4)下列数量的各物质,所含原子个数由大到小的顺序是
①0.5 mol SO3 ②标准状况下22.4 L He
③4℃时9 mL水(水的密度为1 g/mL) ④0.2 mol CH3COONH4
(5)在一密闭容器中充入a mol NO和b mol O2,可发生如下反应:2NO+O2=2NO2,充分反应后容器中氮原子和氧原子的个数之比为
您最近一年使用:0次
名校
解题方法
9 . 实验室中用质量分数98%、密度为1.84g/mL的浓硫酸配制0.2mol•L-1的稀硫酸溶液950mL,下列说法不正确的是
| A.所用容量瓶的规格和用量筒量取浓硫酸的体积分别为:1000mL;10.87mL |
| B.量取浓硫酸时俯视量筒刻度线会使配制溶液的浓度偏低 |
| C.应先在容量瓶中加入一定量蒸馏水再将量取的浓硫酸缓慢加入容量瓶 |
| D.除容量瓶外还需15mL量筒、玻璃棒、烧杯、胶头滴管即可完成配制 |
您最近一年使用:0次
名校
解题方法
10 . 有A、B、C、D四种可溶性盐,它们的阳离子分别是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别是NO 、SO
、SO 、Cl-、CO
、Cl-、CO 中的一种(离子不重复出现)。
中的一种(离子不重复出现)。
①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色:
②若向四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
请回答下列问题:
(1)A的化学式为_________ ,B的化学式为________ ,C的化学式为________ ,D的化学式为________ 。
(2)写出D与足量盐酸反应的化学方程式:_________ 。
(3)检验A溶液中阴离子的方法是________ 。
 、SO
、SO 、Cl-、CO
、Cl-、CO 中的一种(离子不重复出现)。
中的一种(离子不重复出现)。①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色:
②若向四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
请回答下列问题:
(1)A的化学式为
(2)写出D与足量盐酸反应的化学方程式:
(3)检验A溶液中阴离子的方法是
您最近一年使用:0次



