解题方法
1 . 已知物质A~H之间存在如图所示转化关系:
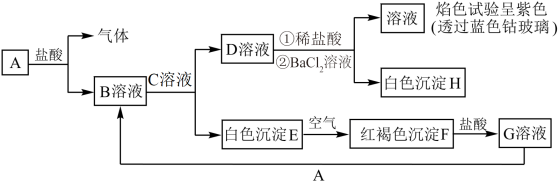
回答下列问题:
(1)D溶液为________ (填化学式)溶液。
(2)检验G溶液中是否含有B溶液中金属阳离子可以用酸性高锰酸钾溶液,写出溶液B中金属阳离子与酸性高锰酸钾溶液反应的离子方程式:________ (已知:酸性条件下高锰酸钾被还原为 )。
)。
(3)G溶液能否用铜制容器盛放,理由是________ 。
(4)白色沉淀E变为红褐色沉淀F时反应的化学方程式为________ 。
(5)下列物质不可以通过化合反应制得的是________ (填字母)。
a.物质B b.物质C c.物质F d.物质G
(6)制备溶液B时一般会加入稍过量的A,其目的是________ 。

回答下列问题:
(1)D溶液为
(2)检验G溶液中是否含有B溶液中金属阳离子可以用酸性高锰酸钾溶液,写出溶液B中金属阳离子与酸性高锰酸钾溶液反应的离子方程式:
 )。
)。(3)G溶液能否用铜制容器盛放,理由是
(4)白色沉淀E变为红褐色沉淀F时反应的化学方程式为
(5)下列物质不可以通过化合反应制得的是
a.物质B b.物质C c.物质F d.物质G
(6)制备溶液B时一般会加入稍过量的A,其目的是
您最近一年使用:0次
名校
解题方法
2 . 将绿矾( )溶于水配制成溶液喷施在叶面上,可解决植物叶面变黄问题,因此绿矾又被誉为“铁肥”。下列有关“铁肥”说法错误的是
)溶于水配制成溶液喷施在叶面上,可解决植物叶面变黄问题,因此绿矾又被誉为“铁肥”。下列有关“铁肥”说法错误的是
 )溶于水配制成溶液喷施在叶面上,可解决植物叶面变黄问题,因此绿矾又被誉为“铁肥”。下列有关“铁肥”说法错误的是
)溶于水配制成溶液喷施在叶面上,可解决植物叶面变黄问题,因此绿矾又被誉为“铁肥”。下列有关“铁肥”说法错误的是| A.“铁肥”易被空气氧化变质 |
B.可用 溶液检验“铁肥”是否发生变质 溶液检验“铁肥”是否发生变质 |
| C.为保证“铁肥”的效果,可向配制后的溶液中加入少量铁粉 |
D. 的摩尔质量为 的摩尔质量为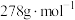 |
您最近一年使用:0次
2023-12-31更新
|
292次组卷
|
8卷引用:青海省西宁市大通县2023-2024学年高一上学期期末考试化学试题
名校
解题方法
3 . 下列试剂的贮存方法或解释错误 的是
| A.金属Na保存在煤油中,防止与空气中的O2和H2O反应 |
| B.漂白粉应密封保存,防止被空气中的氧气氧化 |
| C.FeSO4溶液中放有少量铁粉,防止其被氧化 |
| D.新制氯水保存在棕色瓶中并置于冷暗处,防止次氯酸的分解 |
您最近一年使用:0次
2023-04-05更新
|
125次组卷
|
2卷引用:青海省西宁市2022-2023学年高一上学期期末考试化学试题
解题方法
4 . 某工厂的工业废水中含有大量的 和较多的
和较多的 。为了减少污染并变废为宝,工厂计划从该废水中回收
。为了减少污染并变废为宝,工厂计划从该废水中回收 和金属铜。请根据以下流程图,回答下列问题。
和金属铜。请根据以下流程图,回答下列问题。
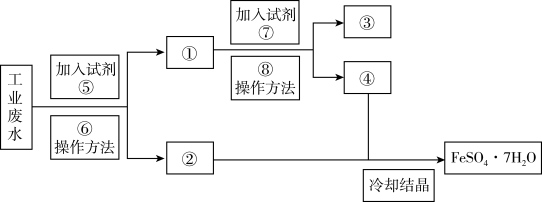
(1)鉴别溶液④中的金属阳离子时,应滴加的试剂依次是___________ ,现象依次是___________ ;请写出该鉴别过程中属于氧化还原反应的离子方程式:___________ 。
(2)若取2mL溶液④加入试管中,然后滴加氢氧化钠溶液,产生的现象是___________ ,此过程涉及反应的化学方程式是___________ 。
 和较多的
和较多的 。为了减少污染并变废为宝,工厂计划从该废水中回收
。为了减少污染并变废为宝,工厂计划从该废水中回收 和金属铜。请根据以下流程图,回答下列问题。
和金属铜。请根据以下流程图,回答下列问题。
(1)鉴别溶液④中的金属阳离子时,应滴加的试剂依次是
(2)若取2mL溶液④加入试管中,然后滴加氢氧化钠溶液,产生的现象是
您最近一年使用:0次
13-14高一上·辽宁·期末
名校
解题方法
5 . 下列离子的检验方法合理的是
| A.向某溶液中滴入硫氰化钾溶液呈红色,说明不含Fe2+ |
| B.向某溶液中通入氯气,然后再加入硫氰化钾溶液变红色,说明原溶液中含有Fe2+ |
| C.向某溶液中加入氢氧化钠溶液,得红褐色沉淀,说明溶液中含有Fe3+ |
| D.向某溶液中加入氢氧化钠溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+ |
您最近一年使用:0次
2022-12-20更新
|
515次组卷
|
41卷引用:青海省西宁市第四高级中学2017-2018学年高一上学期第二次月考化学试题1
青海省西宁市第四高级中学2017-2018学年高一上学期第二次月考化学试题1青海省西宁二十一中2017-2018学年高一上学期12月月考化学试题(已下线)2012-2013学年辽宁省实验中学分校高一上学期期末考试化学试卷(已下线)2012-2013年黑龙江哈尔滨第十二中学高一上学期期末考试化学试卷2015-2016学年广东省汕头金山中学高一上期末化学试卷2016-2017学年宁夏育才中学高一上月考二化学卷22016-2017学年江西省景德镇一中高一12月月考化学卷宁夏育才中学孔德校区2017-2018学年高一12月月考化学试题安徽省滁州市民办高中2018-2019学年高一上学期第三次月考化学试题【市级联考】吉林省公主岭市2018-2019学年高一上学期期末考试化学试题甘肃省武威第十八中学2018-2019学年高一上学期期末考试化学试题贵州省剑河县第二中学2018-2019学年高一上学期12月份考试化学试题(已下线)3.1.1 铁及其化合物练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 教材帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 教材帮(已下线)练习13 铁铜的获取和应用-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)江西省南昌市新建一中2020-2021学年高一上学期第二次月考化学试题(已下线)【浙江新东方】双师107专题9 第二单元 探究铁及其化合物的转化-高中化学必修第二册苏教版2019(已下线)【浙江新东方】高中化学20210304-019陕西省武功县普集高级中学2021-2022学年高一上学期第二次月考化学试题浙江省丽水外国语学校高中部2021-2022学年高一下学期第一次阶段性考试(3月)化学试题山东省济南九中2022-2023学年高一第二次线上质量评估(12月份)化学试题9.2.1反应的合理选择(课中)-2019苏教版必修2课前课中课后第2课时 铁盐和亚铁盐作业(十七) 亚铁盐和铁盐(已下线)【精品卷】3.1.2 铁的重要化合物课堂例题-人教版2023-2024学年必修第一册河北省高碑店市崇德实验中学2022-2023学年高一下学期期末考试化学试题2015-2016学年山西省晋城市高平市特立高中高二下期中文科化学试卷河北省邢台市第一中学2016-2017学年高二下学期第三次月考化学试题(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测辽宁省本溪满族自治县高级中学2019-2020学年高二下学期期末考试化学试题湖北省宜昌市葛洲坝中学2021届高三9月月考化学试题陕西省汉中市洋县第二高级中学2020-2021学年高二上学期11月月考化学试题(已下线)专题05 金属及其重要化合物-备战2021届高考化学二轮复习题型专练黑龙江省牡丹江市第三中学2021-2022学年高二上学期第一次月考化学(文)试题湖北省咸丰春晖学校2022-2023学年高二上学期9月月考化学试题吉林江城中学2021-2022学年高三上学期9月月考化学试题化学江苏省扬州市宝应区2023-2024学年曹甸高级中学高三上学期9月化学试卷
解题方法
6 . 硫酸亚铁 是一种重要的食品和饲料添加剂。实验室中通过如下步骤由铁屑制备
是一种重要的食品和饲料添加剂。实验室中通过如下步骤由铁屑制备 晶体。
晶体。
①将18mol/L的浓硫酸稀释为50mL3mol/L的稀硫酸;
②向稀硫酸中加入过量的铁屑,控制温度在50~80℃之间;
③趁热过滤,将滤液转入到密闭容器中,静置、结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)步骤①中需要18mol/L浓硫酸的体积为___________ mL(保留一位小数),配制时用到的玻璃仪器有烧杯、玻璃棒、量筒、___________ 和___________ 。
(2)稀硫酸与铁屑反应的离子方程式是___________ 。
(3)步骤②中控制温度高于室温是为了___________ ,但有可能生成 使产品不纯,因此加入过量铁屑的作用是
使产品不纯,因此加入过量铁屑的作用是___________ (用离子方程式表示)。
(4)经查阅资料后发现,硫酸亚铁晶体的溶解度如下表所示:
从硫酸亚铁溶液中结晶出 的方法是
的方法是___________ ,应控制的结晶温度范围为___________ 。
(5)制得的 晶体需要密闭保存的原因是
晶体需要密闭保存的原因是___________ 。
 是一种重要的食品和饲料添加剂。实验室中通过如下步骤由铁屑制备
是一种重要的食品和饲料添加剂。实验室中通过如下步骤由铁屑制备 晶体。
晶体。①将18mol/L的浓硫酸稀释为50mL3mol/L的稀硫酸;
②向稀硫酸中加入过量的铁屑,控制温度在50~80℃之间;
③趁热过滤,将滤液转入到密闭容器中,静置、结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)步骤①中需要18mol/L浓硫酸的体积为
(2)稀硫酸与铁屑反应的离子方程式是
(3)步骤②中控制温度高于室温是为了
 使产品不纯,因此加入过量铁屑的作用是
使产品不纯,因此加入过量铁屑的作用是(4)经查阅资料后发现,硫酸亚铁晶体的溶解度如下表所示:
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | ||
| 析出晶体 |  | 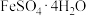 |  | ||||||||
 的方法是
的方法是(5)制得的
 晶体需要密闭保存的原因是
晶体需要密闭保存的原因是
您最近一年使用:0次
2022-01-20更新
|
175次组卷
|
2卷引用:青海省西宁市2022-2023学年高一上学期期末考试化学试题
名校
解题方法
7 . 某学校化学社团为探究SO2与Fe3+是否发生氧化还原反应,按如图所示装置进行实验(夹持、加热装置均省略),已知浓硫酸的沸点为338°C。下列说法错误的是


| A.甲中生成SO2的同时还会有硫酸酸雾产生 |
| B.试剂a为饱和NaHSO3溶液 |
| C.丙中溶液pH降低,证明Fe3+氧化了SO2 |
| D.若Fe3+氧化了SO2,则在丙中的溶液中滴加K3[Fe(CN)6]溶液,会出现蓝色沉淀 |
您最近一年使用:0次
2021-04-05更新
|
1620次组卷
|
6卷引用:青海省青海师范大学附属实验中学2022-2023学年高一上学期12月月考化学试题
青海省青海师范大学附属实验中学2022-2023学年高一上学期12月月考化学试题广东省2021届普通高中学业水平选择考模拟测试(一)化学试题(已下线)第09讲 铁及其重要化合物(精练)-2022年高考化学一轮复习讲练测(已下线)专题08 铁及其化合物(限时精练)-2022年高三毕业班化学常考点归纳与变式演练(已下线)专题12 硫及其化合物(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)第三章 金属及其化合物 第13练 铁及其重要化合物
8 . 铁是应用最广泛的金属,铁的氯化物、氧化物均为重要化合物。
(1)工业上常用 作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得
作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得 溶液,设计了如下方案:
溶液,设计了如下方案:

①试剂D为___________ (填名称)。
②滤液B的溶质为___________ (填化学式)。
③通入气体F时发生反应的离子方程式为___________ 。
④实验中若要证明蚀刻废液中不含 而可能含有
而可能含有 ,正确的实验操作为
,正确的实验操作为___________ 。
(2)水热法制备 纳米颗粒的反应为
纳米颗粒的反应为 。请回答下列问题:
。请回答下列问题:
①水热法制备 纳米颗粒的反应中,被氧化的元素为
纳米颗粒的反应中,被氧化的元素为___________ (填元素符号)。
②该反应的化学方程式中
___________ 。
③每生成 ,反应转移的电子为
,反应转移的电子为___________  。
。
(1)工业上常用
 作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得
作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得 溶液,设计了如下方案:
溶液,设计了如下方案:
①试剂D为
②滤液B的溶质为
③通入气体F时发生反应的离子方程式为
④实验中若要证明蚀刻废液中不含
 而可能含有
而可能含有 ,正确的实验操作为
,正确的实验操作为(2)水热法制备
 纳米颗粒的反应为
纳米颗粒的反应为 。请回答下列问题:
。请回答下列问题:①水热法制备
 纳米颗粒的反应中,被氧化的元素为
纳米颗粒的反应中,被氧化的元素为②该反应的化学方程式中

③每生成
 ,反应转移的电子为
,反应转移的电子为 。
。
您最近一年使用:0次
2021-01-30更新
|
461次组卷
|
5卷引用:青海省海东市2020-2021学年高一上学期期末考试化学试题
9 . 硫酸亚铁可作水处理剂,以防止水体的富营养化。某研究小组为了测定硫酸亚铁片中 FeSO4的含量,设计实验方案如下(假设硫酸亚铁片中的其它物质不参与反应)∶
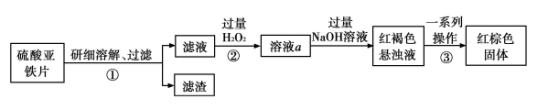
回答下列问题∶
(1)实验最终生成的红棕色固体是___________ (填化学式)。
(2)若向步骤①过滤后的滤液中加入过量的NaOH溶液,会观察到的实验现象是___________ ,该过程中发生的氧化还原反应的化学方程式为___________ 。
(3)步骤②中加入过量 H2O2的目的是___________ 。
(4)实验室检验溶液a中金属阳离子的方法是∶取适量溶液,向其中加入少量的___________ 溶液,若溶液变为___________ 色,则证明含有该阳离子。
(5)步骤③中所需的基本操作有:a.冷却 b.灼烧 c.过滤 d.洗涤,其正确的操作顺序为___________ (填选项序号)。
(6)若20g 硫酸亚铁片最终得到红棕色固体的质量为8g,则硫酸亚铁片中FeSO4的质量百分含量为___________ 。

回答下列问题∶
(1)实验最终生成的红棕色固体是
(2)若向步骤①过滤后的滤液中加入过量的NaOH溶液,会观察到的实验现象是
(3)步骤②中加入过量 H2O2的目的是
(4)实验室检验溶液a中金属阳离子的方法是∶取适量溶液,向其中加入少量的
(5)步骤③中所需的基本操作有:a.冷却 b.灼烧 c.过滤 d.洗涤,其正确的操作顺序为
(6)若20g 硫酸亚铁片最终得到红棕色固体的质量为8g,则硫酸亚铁片中FeSO4的质量百分含量为
您最近一年使用:0次
解题方法
10 . 电子工业常用FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某电子厂用过的腐蚀液中含有Fe3+、Cu2+,可以通过下列流程回收铜,并重新获得FeCl3溶液。
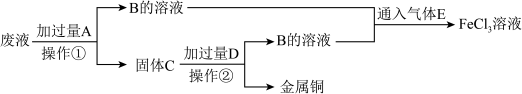
(1)检验溶液中含有Fe3+常用的试剂是________ ,证明Fe3+存在的现象是_________ ;
(2)操作①是______ ,C的成分是_________ ;
(3)废液中的Fe3+与A反应的离子方程式是____________ ,向B的溶液中滴加NaOH溶液时观察到的现象是______________ 。
(4)B与E反应的化学方程式是________________ 。

(1)检验溶液中含有Fe3+常用的试剂是
(2)操作①是
(3)废液中的Fe3+与A反应的离子方程式是
(4)B与E反应的化学方程式是
您最近一年使用:0次



