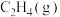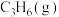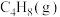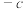1 . 丙烯(分子式为C3H6)是重要的有机化工原料,丙烷(分子式为C3H8)脱氢制丙烯具有显著的经济价值和社会意义。
(1)已知:Ⅰ.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) △H=-238kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
则丙烷脱氢制丙烯反应C3H8(g) C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为
C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为_______ kJ·mol-1(用带有a的代数式表示)。
(2)一定温度下,向恒容密闭容器中充入2molC3H8,发生丙烷脱氢制丙烯反应,容器内起始压强为2×10-5Pa。
①欲提高丙烷转化率,采取的措施是_______ (填标号)。
A.升高温度 B.再充入1molC3H8 C.加催化剂 D.及时分离出H2
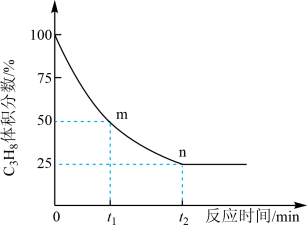
②丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图所示_______ Pa(Kp是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×物质的量分数)。
(3)若在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始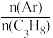 越大,丙烷的平衡转化率越大,其原因是
越大,丙烷的平衡转化率越大,其原因是_______ 。
(4)以丙烷(C3H8)为燃料制作新型燃料电池,电解质是熔融碳酸盐。则电池负极的电极反应式为_______ 。
(1)已知:Ⅰ.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) △H=-238kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
则丙烷脱氢制丙烯反应C3H8(g)
 C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为
C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为(2)一定温度下,向恒容密闭容器中充入2molC3H8,发生丙烷脱氢制丙烯反应,容器内起始压强为2×10-5Pa。
①欲提高丙烷转化率,采取的措施是
A.升高温度 B.再充入1molC3H8 C.加催化剂 D.及时分离出H2
②丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图所示
(3)若在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始
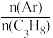 越大,丙烷的平衡转化率越大,其原因是
越大,丙烷的平衡转化率越大,其原因是(4)以丙烷(C3H8)为燃料制作新型燃料电池,电解质是熔融碳酸盐。则电池负极的电极反应式为
您最近一年使用:0次
2 . 氢能是应用前景广阔的新能源。
(1)制氢。工业上电解碱性尿素水溶液制氢。
①阳极活性物质Ni(OH)2首先放电生成NiOOH,该过程的电极反应式为___________ 。
②CO(NH2)2吸附在NiOOH上被氧化生成N2.根据电负性规则,CO(NH2)2分子中能被Ni吸附的原子是___________ (填元素符号)。
(2)储氢。部分H2和Mg一定条件下化合生成MgH2以储氢;部分H2和N2在催化剂表面合成氨以储氢,其反应机理的部分过程如图-1所示。______ 。
②研究发现,使用Ru系催化剂时,N2在催化剂表面的吸附活化是整个反应过程的控速步骤,实际工业生产时,将n(H2)/n(N2)控制在1.8~2.2之间,比理论值3小,其原因是___________ 。
(3)释氢。MgH2可通过热分解和水解两种方法制得H2。相较于热分解,从物质转化和能量利用的角度分析,MgH2水解释氢方法的优点有___________ 。
(4)储氢物质NH3的运用。NH3常用于烟气(主要成分NO、NO2)脱硝。以N2为载气,将含一定量NO、NH3及O2的模拟烟气以一定流速通过装有催化剂CeO2的反应管,研究温度、SO2(g)、H2O(g)对脱硝反应的影响。___________ 。
②如图-3所示,温度高于350℃时,和不含水蒸气的烟气相比,含10%水蒸气的烟气的NO转化率更高,其原因是___________ 。
③实验证明,烟气中含SO2会导致催化剂不可逆的中毒(Ce4+氧化SO2生成SO 覆盖在生成的Ce3+表面,阻止了O2氧化Ce3+)。而添加CuO后抗硫能力显著增强,请结合图-4机理,说明抗硫能力增强的原因
覆盖在生成的Ce3+表面,阻止了O2氧化Ce3+)。而添加CuO后抗硫能力显著增强,请结合图-4机理,说明抗硫能力增强的原因___________ 。
(1)制氢。工业上电解碱性尿素水溶液制氢。
①阳极活性物质Ni(OH)2首先放电生成NiOOH,该过程的电极反应式为
②CO(NH2)2吸附在NiOOH上被氧化生成N2.根据电负性规则,CO(NH2)2分子中能被Ni吸附的原子是
(2)储氢。部分H2和Mg一定条件下化合生成MgH2以储氢;部分H2和N2在催化剂表面合成氨以储氢,其反应机理的部分过程如图-1所示。

②研究发现,使用Ru系催化剂时,N2在催化剂表面的吸附活化是整个反应过程的控速步骤,实际工业生产时,将n(H2)/n(N2)控制在1.8~2.2之间,比理论值3小,其原因是
(3)释氢。MgH2可通过热分解和水解两种方法制得H2。相较于热分解,从物质转化和能量利用的角度分析,MgH2水解释氢方法的优点有
(4)储氢物质NH3的运用。NH3常用于烟气(主要成分NO、NO2)脱硝。以N2为载气,将含一定量NO、NH3及O2的模拟烟气以一定流速通过装有催化剂CeO2的反应管,研究温度、SO2(g)、H2O(g)对脱硝反应的影响。

②如图-3所示,温度高于350℃时,和不含水蒸气的烟气相比,含10%水蒸气的烟气的NO转化率更高,其原因是
③实验证明,烟气中含SO2会导致催化剂不可逆的中毒(Ce4+氧化SO2生成SO
 覆盖在生成的Ce3+表面,阻止了O2氧化Ce3+)。而添加CuO后抗硫能力显著增强,请结合图-4机理,说明抗硫能力增强的原因
覆盖在生成的Ce3+表面,阻止了O2氧化Ce3+)。而添加CuO后抗硫能力显著增强,请结合图-4机理,说明抗硫能力增强的原因
您最近一年使用:0次
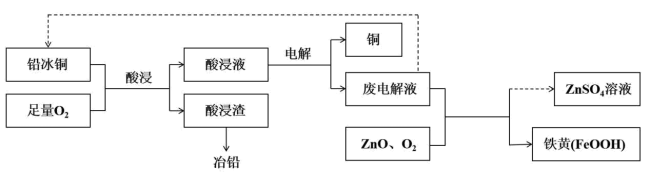
3 . 铅、铜是芯片焊接和封装工艺过程中常用的金属材料,采用“火法工艺”和“湿法工艺”均可将铅冰铜冶炼成铅和铜。
已知:
ⅰ.铅冰铜成分: 、PbS及少量FeS、ZnS;富冰铜主要成分:
、PbS及少量FeS、ZnS;富冰铜主要成分: 、FeS。
、FeS。
ⅱ. 、PbS难溶于酸,FeS、ZnS可溶于酸。
、PbS难溶于酸,FeS、ZnS可溶于酸。
ⅲ.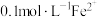 沉淀为
沉淀为 ,起始的pH为6.3,完全沉淀的pH为8.3;
,起始的pH为6.3,完全沉淀的pH为8.3;
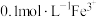 沉淀为FeOOH,起始的pH为1.5,完全沉淀的pH为2.8。
沉淀为FeOOH,起始的pH为1.5,完全沉淀的pH为2.8。
Ⅰ.火法工艺:
①“熔炼”时铁可以将PbS中的铅置换出来,化学方程式为 。
②富冰铜中的 进行二次熔炼生成2mol铜时,至少需要反应
进行二次熔炼生成2mol铜时,至少需要反应 的物质的量
的物质的量_______ 。
③控制空气用量进行二次熔炼而不能使用足量空气一次性熔炼的原因是_______ 。
Ⅱ.湿法工艺:
①氧气可将 氧化成硫和
氧化成硫和 ,酸浸液中的阳离子还有
,酸浸液中的阳离子还有_______ 。
②废电解液不能循环使用次数过多原因
(3)用废电解液制备 和铁黄。
和铁黄。
①经氧气处理后的废电解液中。 实际浓度大于
实际浓度大于 ,用
,用_______ (化学式)调节溶液pH至1.5时,开始有FeOOH沉淀析出。
②废电解液中 转化为铁黄的离子方程式是
转化为铁黄的离子方程式是_______ 。
(4)“湿法工艺”与“火法工艺”处理铅冰铜相比,湿法工艺的优点是_______ 。
已知:
ⅰ.铅冰铜成分:
 、PbS及少量FeS、ZnS;富冰铜主要成分:
、PbS及少量FeS、ZnS;富冰铜主要成分: 、FeS。
、FeS。ⅱ.
 、PbS难溶于酸,FeS、ZnS可溶于酸。
、PbS难溶于酸,FeS、ZnS可溶于酸。ⅲ.
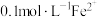 沉淀为
沉淀为 ,起始的pH为6.3,完全沉淀的pH为8.3;
,起始的pH为6.3,完全沉淀的pH为8.3;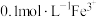 沉淀为FeOOH,起始的pH为1.5,完全沉淀的pH为2.8。
沉淀为FeOOH,起始的pH为1.5,完全沉淀的pH为2.8。Ⅰ.火法工艺:
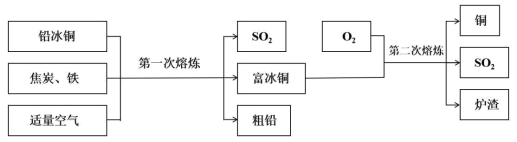
①“熔炼”时铁可以将PbS中的铅置换出来,化学方程式为 。
②富冰铜中的
 进行二次熔炼生成2mol铜时,至少需要反应
进行二次熔炼生成2mol铜时,至少需要反应 的物质的量
的物质的量③控制空气用量进行二次熔炼而不能使用足量空气一次性熔炼的原因是
Ⅱ.湿法工艺:
①氧气可将
 氧化成硫和
氧化成硫和 ,酸浸液中的阳离子还有
,酸浸液中的阳离子还有②废电解液不能循环使用次数过多原因
(3)用废电解液制备
 和铁黄。
和铁黄。①经氧气处理后的废电解液中。
 实际浓度大于
实际浓度大于 ,用
,用②废电解液中
 转化为铁黄的离子方程式是
转化为铁黄的离子方程式是(4)“湿法工艺”与“火法工艺”处理铅冰铜相比,湿法工艺的优点是
您最近一年使用:0次
4 . 乙二胺四乙酸铁钠(化学式 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。
已知:① 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为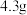 。
。
②乙二胺四乙酸( ,用
,用 表示)是一种弱酸。
表示)是一种弱酸。
Ⅰ.制备
实验室用铁屑制备 的主要流程如下:
的主要流程如下:___________
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量 ,过程中浓度减少的离子有
,过程中浓度减少的离子有___________ (填离子符号)。
(3)“制备”步骤,向氧化所得的 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。
①从反应后的混合物中获得较高产率的 粗品的实验操作是,
粗品的实验操作是,___________ ,过滤,水洗,干燥。检验 是否洗净的试剂是
是否洗净的试剂是___________
②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是___________ 。
样品中乙二胺四乙酸铁钠纯度可用 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为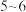 发生反应:
发生反应: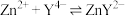 ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
(4)补充完整实验方案:准确称取 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:___________ 。
 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。已知:①
 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为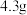 。
。②乙二胺四乙酸(
 ,用
,用 表示)是一种弱酸。
表示)是一种弱酸。Ⅰ.制备

实验室用铁屑制备
 的主要流程如下:
的主要流程如下:
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量
 ,过程中浓度减少的离子有
,过程中浓度减少的离子有(3)“制备”步骤,向氧化所得的
 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。①从反应后的混合物中获得较高产率的
 粗品的实验操作是,
粗品的实验操作是, 是否洗净的试剂是
是否洗净的试剂是②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液
 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是
样品中乙二胺四乙酸铁钠纯度可用
 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为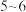 发生反应:
发生反应: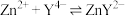 ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。(4)补充完整实验方案:准确称取
 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:
您最近一年使用:0次
名校
解题方法
5 . 化学反应伴随有能量的变化,获取反应能量变化有多条途径。
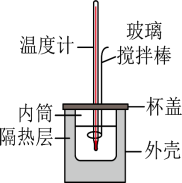
Ⅰ.用如图所示的装置测定中和反应反应热,实验药品: 盐酸、
盐酸、 溶液、
溶液、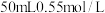 氨水。已知弱碱电离时吸热。回答下列问题。
氨水。已知弱碱电离时吸热。回答下列问题。__________ 。
(2)将浓度为 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为
的碱溶液各50mL混合(溶液密度均为 ),生成的溶液的比热容
),生成的溶液的比热容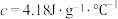 ,测得温度如下:
,测得温度如下:
①甲组实验放出的热量__________ 乙组实验放出的热量(填“>”、“<”或“=”)。
②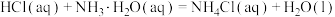 的
的
__________  (保留一位小数)。
(保留一位小数)。
Ⅱ.通过化学键的键能计算。
(3)汽车发动机工作时会引发 和
和 反应,其能量变化示意图如下:
反应,其能量变化示意图如下:__________ 。
Ⅲ.通过盖斯定律计算。
(4)氧化亚铜常用于制船底防污漆,已知反应:
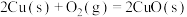

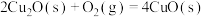

则 的
的
__________ 。
(5)利用丁烯和乙烯的催化歧化反应制丙烯:
 。相关物质的燃烧热数据如下表所示:
。相关物质的燃烧热数据如下表所示:
该催化歧化反应的
__________  。
。
Ⅰ.用如图所示的装置测定中和反应反应热,实验药品:
 盐酸、
盐酸、 溶液、
溶液、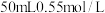 氨水。已知弱碱电离时吸热。回答下列问题。
氨水。已知弱碱电离时吸热。回答下列问题。
(2)将浓度为
 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为
的碱溶液各50mL混合(溶液密度均为 ),生成的溶液的比热容
),生成的溶液的比热容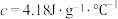 ,测得温度如下:
,测得温度如下:反应物 | 起始温度 | 最高温度 |
甲组 | 15.0 | t |
乙组 | 15.0 | 18.1 |
②
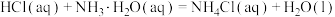 的
的
 (保留一位小数)。
(保留一位小数)。Ⅱ.通过化学键的键能计算。
(3)汽车发动机工作时会引发
 和
和 反应,其能量变化示意图如下:
反应,其能量变化示意图如下: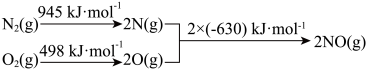
Ⅲ.通过盖斯定律计算。
(4)氧化亚铜常用于制船底防污漆,已知反应:
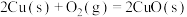

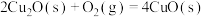

则
 的
的
(5)利用丁烯和乙烯的催化歧化反应制丙烯:

 。相关物质的燃烧热数据如下表所示:
。相关物质的燃烧热数据如下表所示:物质 |
|
|
|
燃烧热 |
|
|
|

 。
。
您最近一年使用:0次
6 . (一)碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质,请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如图:_______ 。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) △H=-1176kJ•mol-1,则反应过程中,每转移1mol电子放出的热量为_______ 。
(3)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ•mol-1;②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1;③C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1;CH4、H2组成的混合气体2mol,完全㜔烧后放出热量1297.0kJ能量,该混合气体中CH4与H2的物质的量之比n(CH4):n(H2)=_____ ,C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出其反应热△H=_____ kJ•mol-1。
(二)0.50mol•L-1的盐酸与0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题: 溶于不同量水中的热效度如下表:
溶于不同量水中的热效度如下表:
下列说法正确的是_______ 。
A.当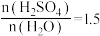 时,溶解放热
时,溶解放热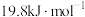
B.向 的溶液中加入9g水,放出热量6.9kJ
的溶液中加入9g水,放出热量6.9kJ
C.用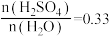 的溶液测定中和反应的反应热会使△H偏小
的溶液测定中和反应的反应热会使△H偏小
(5)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
①表中的温度差平均值为_______ ℃。
②近似认为0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•(g•℃)-1.则中和热△H=_____ (取小数点后一位)。
(6)下列说法正确的是_______ (填字母)。
a.为了使反应充分进行,药品可以分多次加入
b.完成一次中和反应反应热平行样的测定,温度计需要使用2次
c.测量NaOH与不同种类的酸(如HCl、 等)中和反应的反应热,数值可能不同
等)中和反应的反应热,数值可能不同
d.用温度计测定NaOH溶液起始温度后直接测定 溶液的温度
溶液的温度
(1)有机物M经过太阳光光照可转化成N,转化过程如图:
 △H=+88.6kJ•mol-1
△H=+88.6kJ•mol-1
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) △H=-1176kJ•mol-1,则反应过程中,每转移1mol电子放出的热量为
(3)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ•mol-1;②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1;③C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1;CH4、H2组成的混合气体2mol,完全㜔烧后放出热量1297.0kJ能量,该混合气体中CH4与H2的物质的量之比n(CH4):n(H2)=
(二)0.50mol•L-1的盐酸与0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
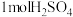 溶于不同量水中的热效度如下表:
溶于不同量水中的热效度如下表: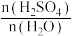 | 2.0 | 1.0 | 0.67 | 0.50 | 0.33 |  |
溶解放热 | 15.8 | 27.8 | 35.9 | 41.6 | 48.9 | 95.3 |
A.当
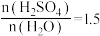 时,溶解放热
时,溶解放热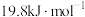
B.向
 的溶液中加入9g水,放出热量6.9kJ
的溶液中加入9g水,放出热量6.9kJC.用
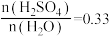 的溶液测定中和反应的反应热会使△H偏小
的溶液测定中和反应的反应热会使△H偏小(5)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t1-t2)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.6 | 26.6 | 26.6 | 29.1 | 2.5 |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | 4 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 |
②近似认为0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•(g•℃)-1.则中和热△H=
(6)下列说法正确的是
a.为了使反应充分进行,药品可以分多次加入
b.完成一次中和反应反应热平行样的测定,温度计需要使用2次
c.测量NaOH与不同种类的酸(如HCl、
 等)中和反应的反应热,数值可能不同
等)中和反应的反应热,数值可能不同d.用温度计测定NaOH溶液起始温度后直接测定
 溶液的温度
溶液的温度
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
7 . 硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:
(1)将 置入抽空的刚性容器中,升高温度发生分解反应:
置入抽空的刚性容器中,升高温度发生分解反应: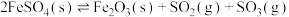 (I)。平衡时
(I)。平衡时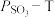 的关系如下图所示。
的关系如下图所示。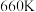 时,该反应的平衡总压
时,该反应的平衡总压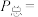
___________  、平衡常数
、平衡常数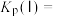
___________  。
。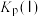 随反应温度升高而
随反应温度升高而___________ (填“增大”“减小”或“不变”)。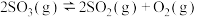 (II),平衡时
(II),平衡时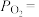
___________ (用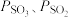 表示)。在
表示)。在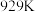 时,
时, ,则
,则
___________  ,
,
___________  (列出计算式)。
(列出计算式)。
(1)将
 置入抽空的刚性容器中,升高温度发生分解反应:
置入抽空的刚性容器中,升高温度发生分解反应: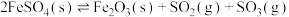 (I)。平衡时
(I)。平衡时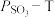 的关系如下图所示。
的关系如下图所示。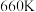 时,该反应的平衡总压
时,该反应的平衡总压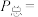
 、平衡常数
、平衡常数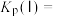
 。
。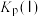 随反应温度升高而
随反应温度升高而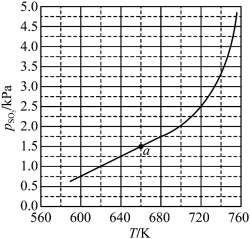
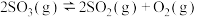 (II),平衡时
(II),平衡时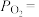
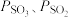 表示)。在
表示)。在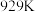 时,
时, ,则
,则
 ,
,
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
8 . 2023年7月全球首枚液氧甲烷火箭——朱雀二号在酒泉卫星发射中心发射成功。根据所学知识,回答下列问题:
(1)某科研小组用甲烷燃料电池(电解质溶液为 溶液)提供能量制备
溶液)提供能量制备 ,并获得副产品
,并获得副产品 ,其工作原理如下图所示(已知:电解装置的电极材料分别为金属钴和不锈钢,
,其工作原理如下图所示(已知:电解装置的电极材料分别为金属钴和不锈钢, 是一元弱酸)。
是一元弱酸)。 为
为___________ (填“阳”或“阴”)离子交换膜。
②电解过程中,原料室溶液的
___________ (填“增大”“减小”或“不变”)。
③燃料电池 极的电极反应为
极的电极反应为___________ 。
(1)某科研小组用甲烷燃料电池(电解质溶液为
 溶液)提供能量制备
溶液)提供能量制备 ,并获得副产品
,并获得副产品 ,其工作原理如下图所示(已知:电解装置的电极材料分别为金属钴和不锈钢,
,其工作原理如下图所示(已知:电解装置的电极材料分别为金属钴和不锈钢, 是一元弱酸)。
是一元弱酸)。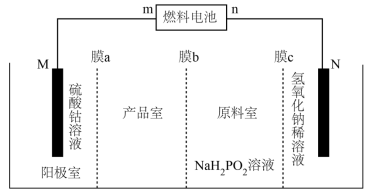
 为
为②电解过程中,原料室溶液的

③燃料电池
 极的电极反应为
极的电极反应为
您最近一年使用:0次
9 . 回答下列问题。
(1)锅炉水垢的主要成分是碳酸钙和硫酸钙,清洗时,经常先加入饱和的碳酸钠溶液浸泡,最后用酸溶解。结合沉淀溶解平衡原理解释清洗硫酸钙的过程___________ 。
(2)当器壁上附有 很难除去时,也常采用沉淀转化的方法。已知某温度下
很难除去时,也常采用沉淀转化的方法。已知某温度下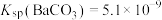 ,
,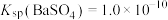 。在该温度下要使
。在该温度下要使 转化成
转化成 ,
, 溶液的浓度应大于
溶液的浓度应大于___________  。
。
(1)锅炉水垢的主要成分是碳酸钙和硫酸钙,清洗时,经常先加入饱和的碳酸钠溶液浸泡,最后用酸溶解。结合沉淀溶解平衡原理解释清洗硫酸钙的过程
(2)当器壁上附有
 很难除去时,也常采用沉淀转化的方法。已知某温度下
很难除去时,也常采用沉淀转化的方法。已知某温度下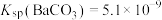 ,
,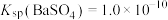 。在该温度下要使
。在该温度下要使 转化成
转化成 ,
, 溶液的浓度应大于
溶液的浓度应大于 。
。
您最近一年使用:0次
2024高三下·全国·专题练习
10 . 资源化利用二氧化硫,一方面能保护环境,另一方面能提高经济效益,具有深远意义。
(1)将 通入
通入 溶液时,得到一组
溶液时,得到一组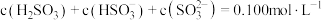 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。 ,溶液中
,溶液中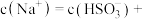
___________ ,此时溶液中
___________  。(选填“
。(选填“ ”“
”“ ”或“
”或“ ”)
”)
(2)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数( )。以醋酸钠(
)。以醋酸钠( )为例,其水解平衡常数存在以下定量关系:
)为例,其水解平衡常数存在以下定量关系: (
( 为水的离子积常数,
为水的离子积常数, 为
为 的电离常数)亚硫酸为二元弱酸,
的电离常数)亚硫酸为二元弱酸, 时,其电离常数
时,其电离常数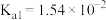 ,
,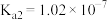 。请结合相关数据说明
。请结合相关数据说明 溶液呈酸性的理由。
溶液呈酸性的理由。___________
(1)将
 通入
通入 溶液时,得到一组
溶液时,得到一组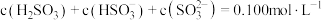 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。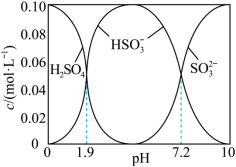
 ,溶液中
,溶液中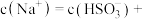

 。(选填“
。(选填“ ”“
”“ ”或“
”或“ ”)
”)(2)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数(
 )。以醋酸钠(
)。以醋酸钠( )为例,其水解平衡常数存在以下定量关系:
)为例,其水解平衡常数存在以下定量关系: (
( 为水的离子积常数,
为水的离子积常数, 为
为 的电离常数)亚硫酸为二元弱酸,
的电离常数)亚硫酸为二元弱酸, 时,其电离常数
时,其电离常数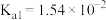 ,
,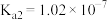 。请结合相关数据说明
。请结合相关数据说明 溶液呈酸性的理由。
溶液呈酸性的理由。
您最近一年使用:0次

 /℃
/℃ /℃
/℃