1 . 液态硝基甲烷(化学式 )可溶于水,
)可溶于水,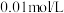 的硝基甲烷溶液
的硝基甲烷溶液 ,能使紫色石蕊试液显红色。在水中存在互变异构反应(
,能使紫色石蕊试液显红色。在水中存在互变异构反应( 很小):
很小):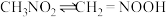 。下列说法错误的是
。下列说法错误的是
 )可溶于水,
)可溶于水,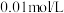 的硝基甲烷溶液
的硝基甲烷溶液 ,能使紫色石蕊试液显红色。在水中存在互变异构反应(
,能使紫色石蕊试液显红色。在水中存在互变异构反应( 很小):
很小):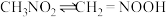 。下列说法错误的是
。下列说法错误的是A.硝基甲烷的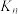 约为 约为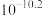 | B.滴入少量 溶液,互变异构反应不移动 溶液,互变异构反应不移动 |
| C.二硝基甲烷酸性强于硝基甲烷 | D.液态硝基甲烷可以作炸药 |
您最近一年使用:0次
名校
解题方法
2 . Ⅰ、按要求回答下列问题:
(1)常温下,有关下列四种溶液的说法正确的是___________。
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,若氨水的浓度为2.0mol·L-1,溶液中的c(OH−)=___________ mol·L−1。
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
Ⅱ、氢气可以用于合成甲醇的反应为CO(g)+2H2(g) CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:
CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:___________ (填“>”“<”或“=”)0。
②写出一条可同时提高反应速率和H2平衡转化率的措施:___________ 。
③保证该压强不变,向T1温度下, =0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
=0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡___________ (填“正向”“逆向”或“不”)移动。
(1)常温下,有关下列四种溶液的说法正确的是___________。
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
| A.由水电离出的c(H+):③>① |
| B.①稀释到原来的100倍,pH与②相同 |
C.①与③混合,若溶液pH=7,则溶液中c(NH )>c(Cl-) )>c(Cl-) |
| D.②与④等体积混合,混合溶液的pH>7 |
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=Ⅱ、氢气可以用于合成甲醇的反应为CO(g)+2H2(g)
 CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:
CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示: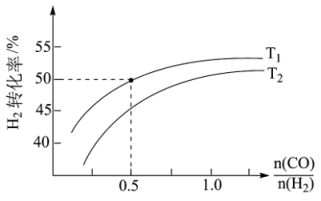
②写出一条可同时提高反应速率和H2平衡转化率的措施:
③保证该压强不变,向T1温度下,
 =0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
=0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
您最近一年使用:0次
名校
3 . 电解质的水溶液跟日常生活、工农业生产和环境保护息息相关.
(1)电解质在水中会发生电离,酸、碱在溶液中能发生中和反应.
①常温下, 的氢氧化钠溶液中由水电离出的
的氢氧化钠溶液中由水电离出的 的浓度为
的浓度为___________  .
.
②常温下, 的醋酸溶液与
的醋酸溶液与 的氢氧化钠溶液反应的离子方程式为:
的氢氧化钠溶液反应的离子方程式为:___________
③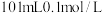 的盐酸和
的盐酸和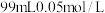 的
的 溶液混合后,
溶液混合后,
___________ .
(2)有浓度为 的盐酸、硫酸、醋酸三种溶液,试回答:
的盐酸、硫酸、醋酸三种溶液,试回答:
①中和一定量 溶液生成正盐时,需上述三种酸的体积依次是
溶液生成正盐时,需上述三种酸的体积依次是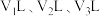 ,则
,则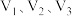 的关系为
的关系为
___________ =___________ .
②与锌反应时产生氢气的速率分别为 ,其由大到小关系为
,其由大到小关系为___________ .
(3) 时,有
时,有 的醋酸溶液,试回答:
的醋酸溶液,试回答:
达平衡时,溶液中氢离子浓度为___________  (
( 时,醋酸的电离平衡常数为
时,醋酸的电离平衡常数为 ).
).
(1)电解质在水中会发生电离,酸、碱在溶液中能发生中和反应.
①常温下,
 的氢氧化钠溶液中由水电离出的
的氢氧化钠溶液中由水电离出的 的浓度为
的浓度为 .
.②常温下,
 的醋酸溶液与
的醋酸溶液与 的氢氧化钠溶液反应的离子方程式为:
的氢氧化钠溶液反应的离子方程式为:③
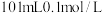 的盐酸和
的盐酸和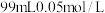 的
的 溶液混合后,
溶液混合后,
(2)有浓度为
 的盐酸、硫酸、醋酸三种溶液,试回答:
的盐酸、硫酸、醋酸三种溶液,试回答:①中和一定量
 溶液生成正盐时,需上述三种酸的体积依次是
溶液生成正盐时,需上述三种酸的体积依次是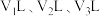 ,则
,则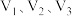 的关系为
的关系为
②与锌反应时产生氢气的速率分别为
 ,其由大到小关系为
,其由大到小关系为(3)
 时,有
时,有 的醋酸溶液,试回答:
的醋酸溶液,试回答:达平衡时,溶液中氢离子浓度为
 (
( 时,醋酸的电离平衡常数为
时,醋酸的电离平衡常数为 ).
).
您最近一年使用:0次
解题方法
4 . 常温下,用0.100 mol/L的NaOH溶液滴定20.00 mL未知浓度的次磷酸H3PO2溶液。溶液pH、所有含磷微粒的分布系数 [比如
[比如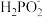 的分布系数:[
的分布系数:[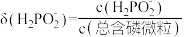 ]随滴加NaOH溶液体积V(NaOH)的变化关系如图所示。下列说法不正确的是
]随滴加NaOH溶液体积V(NaOH)的变化关系如图所示。下列说法不正确的是
 [比如
[比如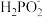 的分布系数:[
的分布系数:[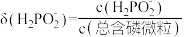 ]随滴加NaOH溶液体积V(NaOH)的变化关系如图所示。下列说法不正确的是
]随滴加NaOH溶液体积V(NaOH)的变化关系如图所示。下列说法不正确的是
| A.H3PO2是一种一元弱酸 |
B.常温下,H3PO2的电离常数 |
C.V(NaOH)=10 mL时,c(Na+)<c(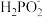 ) ) |
| D.pH=7时,溶液中c(Na+)<0.05 mol/L |
您最近一年使用:0次
2024-03-19更新
|
707次组卷
|
6卷引用:江西省宜春市丰城市第九中学2023-2024学年高二下学期4月期中考试化学试题
江西省宜春市丰城市第九中学2023-2024学年高二下学期4月期中考试化学试题江西省南昌市2024届高三第一次模拟测试化学试卷江西省南昌市2024届高三下学期第一次模拟测试化学试题(已下线)题型7 化学反应速率与化学平衡 水溶液中的离子反应与平衡(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)提升练06 电解质溶液图像分析-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)压轴题07?水溶液中微粒变化图像题
名校
5 . 室温下,取pH相同的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积变化的曲线如图所示,下列说法正确的是


A.酸性 |
| B.溶液中水的电离程度:b点>c点 |
| C.溶液中的导电能力:d点>e点 |
D.从b点到d点, 比值变小 比值变小 |
您最近一年使用:0次
名校
解题方法
6 . 常温下向100mL蒸馏水中滴入10mL5mol·L-1HA溶液,利用传感器测得溶液中c(H+)和温度随着加入HA溶液体积的变化曲线如图所示,下列有关说法不正确的是


| A.HA是弱酸 |
| B.c、d两点的电离平衡常数相等 |
| C.c~d段,c(H+)增大,HA电离程度减小 |
| D.向c点加入0.5mL5mol/L的NaOH溶液后,c(Na+)=c(A-)+c(HA) |
您最近一年使用:0次
7 . 已知草酸为二元弱酸:H2C2O4
 +H+ , Ka1,
+H+ , Ka1,

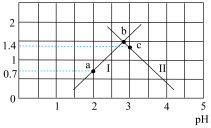
 +H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中
+H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中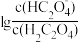 或
或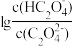 与混合溶液pH关系如图所示。
与混合溶液pH关系如图所示。
回答下列问题:
(1)常温下,草酸的电离常数Ka1=__________ ,Ka2=__________ 。
(2)如果所得溶液溶质为KHC2O4,则该溶液显________ (填“酸性”“碱性”或“中性”)。
(3)如果所得溶液溶质为K2C2O4,则该溶液中各离子浓度由大到小顺序为__________ 。
(4)a、b、c三点,水的电离程度的变化趋势是___________ 。
(5)已知电离度 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,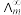 为无限稀释时溶液的摩尔电导率。T=298K,
为无限稀释时溶液的摩尔电导率。T=298K, 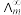 =0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的
=0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的 = 0.002 S·m2·mol-1。
= 0.002 S·m2·mol-1。
①该条件下测定的0.01mol/L乙酸中的c(H+)为_________ mol/L。
②已知摩尔电导率越大,溶液的导电性越好。在298K时,几种离子的摩尔电导率如表所示。在做水的电解实验时,为了增强水溶液的导电性,向水中加入一种盐,请从下表中选择最适宜的盐_______ (填化学式)。

 +H+ , Ka1,
+H+ , Ka1,

 +H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中
+H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中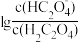 或
或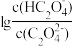 与混合溶液pH关系如图所示。
与混合溶液pH关系如图所示。
回答下列问题:
(1)常温下,草酸的电离常数Ka1=
(2)如果所得溶液溶质为KHC2O4,则该溶液显
(3)如果所得溶液溶质为K2C2O4,则该溶液中各离子浓度由大到小顺序为
(4)a、b、c三点,水的电离程度的变化趋势是
(5)已知电离度
 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,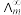 为无限稀释时溶液的摩尔电导率。T=298K,
为无限稀释时溶液的摩尔电导率。T=298K, 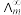 =0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的
=0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的 = 0.002 S·m2·mol-1。
= 0.002 S·m2·mol-1。①该条件下测定的0.01mol/L乙酸中的c(H+)为
②已知摩尔电导率越大,溶液的导电性越好。在298K时,几种离子的摩尔电导率如表所示。在做水的电解实验时,为了增强水溶液的导电性,向水中加入一种盐,请从下表中选择最适宜的盐
| 离子种类 |  | Cl- | CH3COO- | K+ | Na+ |
| 摩尔电导率/(10-4 S·m2·mol-1) . | 79.8 | 76.34 | 50.18 | 73.52 | 50.11 |
您最近一年使用:0次
2023-12-03更新
|
165次组卷
|
2卷引用:江西省抚州市资溪县第一中学2023-2024学年高二上学期11月期中化学试题
名校
8 . 25℃时,用浓度为0.1000 mol⋅L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol⋅L-1的三种酸HX、HY、HZ,滴定曲线如图所示。

下列说法错误的是

下列说法错误的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序: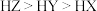 |
B.根据滴定曲线,可得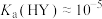 |
C. mL时,三份溶液中 mL时,三份溶液中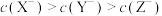 |
D.HY与HZ混合,达到平衡时: |
您最近一年使用:0次
2023-11-23更新
|
356次组卷
|
3卷引用:江西省丰城拖船中学2023-2024学年高二上学期11月期中化学试题
名校
解题方法
9 .  常用作食品添加剂;回答下列问题:
常用作食品添加剂;回答下列问题:
(1) 可作净水剂,其原理是(用离子方程式说明)
可作净水剂,其原理是(用离子方程式说明)_____ 。
(2)浓度均为0.1 的四种电解质溶液的pH随温度变化的曲线如图1所示:
的四种电解质溶液的pH随温度变化的曲线如图1所示:

①其中符合 溶液的pH随温度变化的曲线是
溶液的pH随温度变化的曲线是_____ (填标号),导致 溶液的pH随温度变化的原因是
溶液的pH随温度变化的原因是_____ 。
②20℃时,0.1
 溶液中
溶液中
_____  (用含a或b的代数式表示)。
(用含a或b的代数式表示)。
(3) 溶液中离子浓度从大到小的顺序为
溶液中离子浓度从大到小的顺序为_____
(4)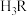 是一种三元弱酸,常温下其三级电离常数分别是
是一种三元弱酸,常温下其三级电离常数分别是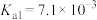 ,
,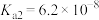 ,
, 。
。
①利用 与
与 的相对大小判断:常温下,
的相对大小判断:常温下, 的水溶液pH
的水溶液pH_____ 7(填“>”、“<”或“=”)。
②常温下, 的水溶液中
的水溶液中
_____ (保留2位有效数字)。
 常用作食品添加剂;回答下列问题:
常用作食品添加剂;回答下列问题:(1)
 可作净水剂,其原理是(用离子方程式说明)
可作净水剂,其原理是(用离子方程式说明)(2)浓度均为0.1
 的四种电解质溶液的pH随温度变化的曲线如图1所示:
的四种电解质溶液的pH随温度变化的曲线如图1所示:
①其中符合
 溶液的pH随温度变化的曲线是
溶液的pH随温度变化的曲线是 溶液的pH随温度变化的原因是
溶液的pH随温度变化的原因是②20℃时,0.1

 溶液中
溶液中
 (用含a或b的代数式表示)。
(用含a或b的代数式表示)。(3)
 溶液中离子浓度从大到小的顺序为
溶液中离子浓度从大到小的顺序为(4)
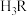 是一种三元弱酸,常温下其三级电离常数分别是
是一种三元弱酸,常温下其三级电离常数分别是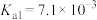 ,
,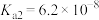 ,
, 。
。①利用
 与
与 的相对大小判断:常温下,
的相对大小判断:常温下, 的水溶液pH
的水溶液pH②常温下,
 的水溶液中
的水溶液中
您最近一年使用:0次
名校
10 . 研究电解质在水溶液中的平衡能了解它的存在形式。
Ⅰ.已知在25℃时,部分弱酸的电离常数如表所示:
(1)写出亚硫酸的第二级电离平衡常数表达式: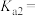
_____ 。
(2)若保持温度不变,在醋酸溶液中加入少量醋酸钠固体,下列各量会变小的是_____(填字母)。
(3)pH相等的 溶液、
溶液、 溶液、
溶液、 溶液中,溶质的物质的量浓度最大的是
溶液中,溶质的物质的量浓度最大的是_____ 溶液。

Ⅱ.常温下,向 溶液中逐滴加入
溶液中逐滴加入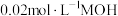 溶液,所得溶液的pH随MOH溶液的体积变化如图甲所示(溶液体积变化忽略不计)。
溶液,所得溶液的pH随MOH溶液的体积变化如图甲所示(溶液体积变化忽略不计)。
(4)①常温下, 溶液中由水电离出的
溶液中由水电离出的
_____  。
。
②常温下,一定浓度的MA稀溶液的 ,则a
,则a_____ 7(填“>”“<”或“=”),用离子方程式表示其原因为_____ 。
③K点时,溶液中
_____  。
。
Ⅰ.已知在25℃时,部分弱酸的电离常数如表所示:
 | 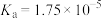 |
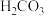 | 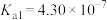 、 、 |
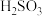 | 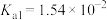 、 、 |
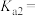
(2)若保持温度不变,在醋酸溶液中加入少量醋酸钠固体,下列各量会变小的是_____(填字母)。
A. | B. |
| C.醋酸的电离平衡常数 | D.醋酸的电离度 |
 溶液、
溶液、 溶液、
溶液、 溶液中,溶质的物质的量浓度最大的是
溶液中,溶质的物质的量浓度最大的是
Ⅱ.常温下,向
 溶液中逐滴加入
溶液中逐滴加入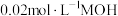 溶液,所得溶液的pH随MOH溶液的体积变化如图甲所示(溶液体积变化忽略不计)。
溶液,所得溶液的pH随MOH溶液的体积变化如图甲所示(溶液体积变化忽略不计)。(4)①常温下,
 溶液中由水电离出的
溶液中由水电离出的
 。
。②常温下,一定浓度的MA稀溶液的
 ,则a
,则a③K点时,溶液中

 。
。
您最近一年使用:0次



