1 . 铁与水蒸气反应的实验装置如图所示,下列有关该实验的说法不正确 的是
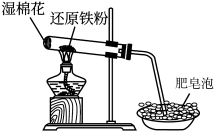

| A.湿棉花的作用是提供水蒸气 |
B.每消耗3mol ,生成4mol ,生成4mol |
| C.点燃酒精灯产生肥皂泡,证明发生了反应 |
D.铁与水蒸气反应生成的固体产物是 |
您最近一年使用:0次
名校
2 . 为探究浓度对化学平衡的影响,某同学进行如下实验:下列说法不正确 的是
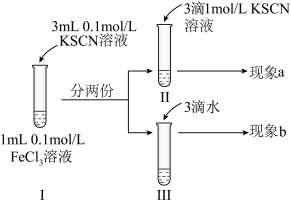

| A.该实验通过观察颜色变化以判断生成物浓度的变化 |
| B.观察到现象a比现象b中红色更深,即可证明增加反应物浓度,平衡正向移动 |
| C.进行II、III对比实验的主要目的是防止由于溶液体积变化引起各离子浓度变化而干扰实验结论得出 |
| D.若I中加入KSCN溶液的体积改为2mL也可以达到实验目的 |
您最近一年使用:0次
2020-07-09更新
|
270次组卷
|
7卷引用:北京市延庆区2019-2020学年高二下学期期末考试化学试题
北京市延庆区2019-2020学年高二下学期期末考试化学试题(已下线)第19讲 化学平衡 (练) — 2022年高考化学一轮复习讲练测(新教材新高考)湖南省长沙市长郡中学2021-2022学年高二上学期第一次月考化学试题(已下线)考向22 化学平衡状态 化学平衡的移动-备战2022年高考化学一轮复习考点微专题(已下线)第19讲 化学平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)河南省商丘名校联盟2022-2023学年高二上学期期中考试化学试题河南省兰考县第一高级中学2022-2023学年高二上学期期中考试化学试题
解题方法
3 . 化学电池的发明,是贮能和供能技术的巨大进步。
(1)如图所示装置中,Zn片是_____ (填“正极”或“负极”),Cu片上发生的电极反应为_____ 。

(2)该装置是典型的原电池装置,可将氧化还原反应释放的能量直接转变为电能,能证明产生电能的实验现象是_____ 。
(3)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如图:

下列说法不正确的是_____ (填序号)。
①A为电池的正极
②该装置实现了电能转化为化学能
③电池工作时,电池内部的锂离子定向移动
(1)如图所示装置中,Zn片是

(2)该装置是典型的原电池装置,可将氧化还原反应释放的能量直接转变为电能,能证明产生电能的实验现象是
(3)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如图:

下列说法不正确的是
①A为电池的正极
②该装置实现了电能转化为化学能
③电池工作时,电池内部的锂离子定向移动
您最近一年使用:0次
2020-07-09更新
|
83次组卷
|
3卷引用:北京市延庆区2019-2020学年高一下学期期末考试化学试题
名校
解题方法
4 . 化学小组探究 与
与 溶液的反应,实验如下:
溶液的反应,实验如下:
已知:经检验白色沉淀为
(1)实验ⅰ中发生的离子方程式为_______ 。
(2)实验ⅱ中检测到 ,依据的实验现象是
,依据的实验现象是_______ 。
(3)从平衡移动的原理解释实验ⅱ红色消失的原因_______ 。
(4)对实验ⅱ中 产生的原因作如下假设:
产生的原因作如下假设:
假设1:溶液中的 被_______氧化
被_______氧化
假设2: 与
与 的反应是一个可逆反应
的反应是一个可逆反应
假设3:在实验ⅱ的条件下, 被
被 氧化
氧化
请将假设1补充完整_______ 。
(5)设计实验验证假设。
实验ⅲ 取2mL溶液a,向其中滴加5滴0.1mol/L 溶液,放置较长时间,溶液颜色不变红,证明假设1不成立。
溶液,放置较长时间,溶液颜色不变红,证明假设1不成立。
实验ⅳ 实验装置如下图所示,闭合开关K,电流计指针不动。向右侧 溶液中滴加0.1mol/L
溶液中滴加0.1mol/L ,指针向右大幅度偏转,溶液中有白色浑浊物产生。取出左侧溶液,滴加0.1mol/L
,指针向右大幅度偏转,溶液中有白色浑浊物产生。取出左侧溶液,滴加0.1mol/L ,溶液变红。
,溶液变红。_______ 。
②假设2不成立的实验证据是_______ 。
③实验证明假设3成立。
请结合电极反应式解释实验ⅱ中 产生的原因
产生的原因_______ 。
 与
与 溶液的反应,实验如下:
溶液的反应,实验如下:| 序号 | 实验方案 | 实验现象 |
| 实验ⅰ |
| 振荡试管,观察到溶液变为蓝色,待反应充分后,试管底部有 粉剩余。 粉剩余。 |
| 实验ⅱ | 取实验ⅰ中的上层清液,向其中滴加0.1mol/L 溶液 溶液 | 溶液局部变红,同时产生白色沉淀,振荡试管,红色消失。 |

(1)实验ⅰ中发生的离子方程式为
(2)实验ⅱ中检测到
 ,依据的实验现象是
,依据的实验现象是(3)从平衡移动的原理解释实验ⅱ红色消失的原因
(4)对实验ⅱ中
 产生的原因作如下假设:
产生的原因作如下假设:假设1:溶液中的
 被_______氧化
被_______氧化假设2:
 与
与 的反应是一个可逆反应
的反应是一个可逆反应假设3:在实验ⅱ的条件下,
 被
被 氧化
氧化请将假设1补充完整
(5)设计实验验证假设。
实验ⅲ 取2mL溶液a,向其中滴加5滴0.1mol/L
 溶液,放置较长时间,溶液颜色不变红,证明假设1不成立。
溶液,放置较长时间,溶液颜色不变红,证明假设1不成立。实验ⅳ 实验装置如下图所示,闭合开关K,电流计指针不动。向右侧
 溶液中滴加0.1mol/L
溶液中滴加0.1mol/L ,指针向右大幅度偏转,溶液中有白色浑浊物产生。取出左侧溶液,滴加0.1mol/L
,指针向右大幅度偏转,溶液中有白色浑浊物产生。取出左侧溶液,滴加0.1mol/L ,溶液变红。
,溶液变红。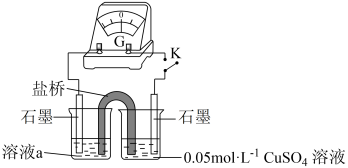
②假设2不成立的实验证据是
③实验证明假设3成立。
请结合电极反应式解释实验ⅱ中
 产生的原因
产生的原因
您最近一年使用:0次
2022-12-30更新
|
258次组卷
|
3卷引用:北京市延庆区2022-2023学年高二上学期期末考试化学试题
5 . 下列事实不能证明 NH3‧H2O是弱电解质的是
| A.0.1mol/L的氨水遇石蕊溶液变蓝 |
B. 沉淀可溶于氯化铵溶液 沉淀可溶于氯化铵溶液 |
C. 的氨水稀释1000倍后, 的氨水稀释1000倍后,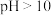 |
| D.常温时,等浓度氢氧化钠溶液和氨水的导电性,前者大于后者 |
您最近一年使用:0次
6 . 某小组通过观察电流表的指针偏转探究电极上发生的氧化还原反应。
(1)连接装置(如图Ⅰ所示),断开开关K时,将铁片和铜片同时插入稀硫酸中,Fe表面产生大量无色气泡,Cu表面无明显变化;闭合开关K,电流表指针向右偏转,Fe和Cu表面均产生大量无色气泡。

①欲验证铁电极发生氧化反应的产物,实验操作和现象是_______ 。
②分别用化学用语表示Fe和Cu表面均产生无色气泡的原因:_______ ;_______ 。
(2)该小组同学将(1)中装置的稀硫酸换成浓硝酸,两极均产生大量红棕色气体。改进实验装置(如图II所示),闭合开关K后,将铁电极快速插入浓硝酸中,观察到指针快速向右偏转,约2秒后指针缓缓向左偏转,并在一段时间内电流表示数几乎不变。

①铜与浓硝酸反应的离子方程式为_______ 。
②闭合开关K后,将铁电极快速插入浓硝酸中,观察到指针快速向右偏转的原因是_______ (结合铜电极反应式说明)。
③电流表指针向左偏转后,示数几乎不变的原因之一是铁电极上氧化膜放电,但氧化膜的生成速率大于(或等于)氧化膜的消耗速率。请设计实验方案证明:_______ 。
(1)连接装置(如图Ⅰ所示),断开开关K时,将铁片和铜片同时插入稀硫酸中,Fe表面产生大量无色气泡,Cu表面无明显变化;闭合开关K,电流表指针向右偏转,Fe和Cu表面均产生大量无色气泡。

①欲验证铁电极发生氧化反应的产物,实验操作和现象是
②分别用化学用语表示Fe和Cu表面均产生无色气泡的原因:
(2)该小组同学将(1)中装置的稀硫酸换成浓硝酸,两极均产生大量红棕色气体。改进实验装置(如图II所示),闭合开关K后,将铁电极快速插入浓硝酸中,观察到指针快速向右偏转,约2秒后指针缓缓向左偏转,并在一段时间内电流表示数几乎不变。

①铜与浓硝酸反应的离子方程式为
②闭合开关K后,将铁电极快速插入浓硝酸中,观察到指针快速向右偏转的原因是
③电流表指针向左偏转后,示数几乎不变的原因之一是铁电极上氧化膜放电,但氧化膜的生成速率大于(或等于)氧化膜的消耗速率。请设计实验方案证明:
您最近一年使用:0次
名校
7 . 室温下,1体积水能溶解约700体积的NH3。将向下排空气法收集NH3后的试管倒扣在水槽里的水中,观察。对该实验现象的分析正确的是


| A.试管内液面上升,证明NH3与H2O发生了反应 |
| B.试管中剩余少量气体,是因为NH3在水中的溶解达到了饱和 |
C.取试管中少量无色液体于另一试管中,向其中加入酚酞溶液,溶液显红色,原因是:NH3 + H2O NH3·H2O NH3·H2O NH NH + OH- + OH- |
| D.将实验后试管中溶液敞口放置在空气中一段时间,pH会降低,主要是由于NH3被空气中的O2氧化 |
您最近一年使用:0次
2022-04-02更新
|
918次组卷
|
6卷引用:北京市延庆区2022届高三一模化学试题
北京市延庆区2022届高三一模化学试题北京市八一学校2021-2022学年高三下学期二模前阶段性测试化学试题(已下线)第14讲 氮及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)北京首都师范大学附属中学2021-2022学年高一下学期期末考试化学试题北京市海淀区教师进修学校附属实验学校2023届高三三模化学试题(已下线)5.2.2氨和铵盐-随堂练习
8 . 为探究化学反应“2Fe3++2I-⇌2Fe2++I2”存在限度及平衡移动与物质的浓度、性质的关系,甲、乙两同学进行如下实验。
已知:a.含I2的溶液呈黄色或棕黄色。b.利用色度计可测定溶液的透光率,通常溶液颜色越深,透光率数值越小。
Ⅰ.甲同学设计下列实验进行相关探究,实验如下:
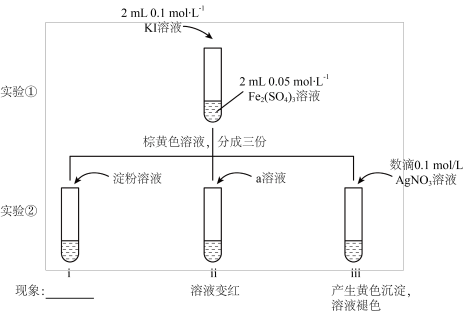
回答下列问题:
(1)甲同学利用实验②中i和ii证明Fe2(SO4)3溶液与KI溶液的反应存在限度,实验i中的现象是________ ,实验ii中a是________ (化学式)溶液。
(2)用离子方程式表示实验②iii中产生黄色沉淀的原因________ 。
Ⅱ.乙同学:利用色度计对Fe2(SO4)3溶液与KI溶液的反应进行再次探究
【实验过程】
实验中溶液的透光率数据变化如图所示:

回答下列问题:
(3)乙同学实验③的目的是______ 。
(4)乙同学通过透光率变化推断:FeCl3溶液与KI溶液的反应存在限度。其相应的推理过程是______ 。
(5)乙同学根据氧化还原反应的规律,用如图装置(a、b均为石墨电极),探究化学平衡移动与I-与Fe2+浓度及还原性强弱关系,操作过程如下:
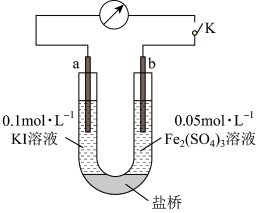
①K闭合时,电流计指针向右偏转,乙同学得出结论:2Fe3++2I—⇌2Fe2++I2向正反应方向进行,b作______ (填“正”或“负”)极,还原性I—>Fe2+。
②当指针归零(反应达到平衡)后,向U形管右管滴加0.1mol/LFeSO4溶液,电流计指针向左偏转,由此得出还原性Fe2+_____ I—(填“>”或“<”)。
(6)综合甲、乙两位同学的实验探究过程,得出的结论有______ 。
已知:a.含I2的溶液呈黄色或棕黄色。b.利用色度计可测定溶液的透光率,通常溶液颜色越深,透光率数值越小。
Ⅰ.甲同学设计下列实验进行相关探究,实验如下:

回答下列问题:
(1)甲同学利用实验②中i和ii证明Fe2(SO4)3溶液与KI溶液的反应存在限度,实验i中的现象是
(2)用离子方程式表示实验②iii中产生黄色沉淀的原因
Ⅱ.乙同学:利用色度计对Fe2(SO4)3溶液与KI溶液的反应进行再次探究
【实验过程】
| 序号 | 实验步骤1 | 实验步骤2 |
| 实验③ | 将盛有2mL蒸馏水的比色皿放入色度计的槽孔中 | 向比色皿中逐滴滴入5滴(每滴约0.025mL)0.05mol·L-1Fe2(SO4)3溶液,同时采集溶液的透光率数据 |
| 实验④ | 将盛有2mL0.1mol·L-1KI溶液的比色皿放入色度计的槽孔中 | 同上 |
| 实验⑤ | 将盛有2mL0.2mol·L-1KI溶液的比色皿放入色度计的槽孔中 | 同上 |

回答下列问题:
(3)乙同学实验③的目的是
(4)乙同学通过透光率变化推断:FeCl3溶液与KI溶液的反应存在限度。其相应的推理过程是
(5)乙同学根据氧化还原反应的规律,用如图装置(a、b均为石墨电极),探究化学平衡移动与I-与Fe2+浓度及还原性强弱关系,操作过程如下:

①K闭合时,电流计指针向右偏转,乙同学得出结论:2Fe3++2I—⇌2Fe2++I2向正反应方向进行,b作
②当指针归零(反应达到平衡)后,向U形管右管滴加0.1mol/LFeSO4溶液,电流计指针向左偏转,由此得出还原性Fe2+
(6)综合甲、乙两位同学的实验探究过程,得出的结论有
您最近一年使用:0次
名校
解题方法
9 . 某研究性小组为探究铜丝与过量浓硫酸的反应,设计了如图所示装置进行有关实验,最后发现试管中铜有剩余。请回答:
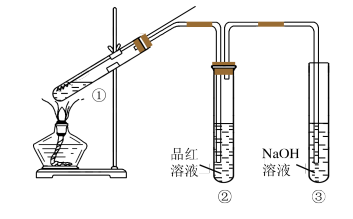
(1)试管①中发生反应的化学方程式是________ ,该反应体现了浓硫酸的______ (填“氧化性”或“还原性”)。
(2)试管②中的实验现象是______________ 。
(3)试管③中,NaOH的作用是____________ 。反应的化学方程式是______ 。
(4)该小组认为还应有一定的硫酸剩余,请说明铜丝未完全溶解并仍有一定量余酸的原因_______ 。
(5)为证明反应结束后的试管中确实有余酸,可选用下列药品中的______________ 。
A.锌粒 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(6)若想使铜继续反应可以向试管①中加入一种物质,该物质可能是_______ (填序号)
A.NaNO3 B. Na2SO4 C. NaCl D.FeCl2
试写出该反应的离子方程式____________________________________________ 。

(1)试管①中发生反应的化学方程式是
(2)试管②中的实验现象是
(3)试管③中,NaOH的作用是
(4)该小组认为还应有一定的硫酸剩余,请说明铜丝未完全溶解并仍有一定量余酸的原因
(5)为证明反应结束后的试管中确实有余酸,可选用下列药品中的
A.锌粒 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(6)若想使铜继续反应可以向试管①中加入一种物质,该物质可能是
A.NaNO3 B. Na2SO4 C. NaCl D.FeCl2
试写出该反应的离子方程式
您最近一年使用:0次
2020-07-07更新
|
168次组卷
|
2卷引用:北京市延庆区2019-2020学年高一下学期期中考试化学试题
解题方法
10 . 物质中的化学能在一定条件下可转化为电能。

(1)将锌片放入盛有稀硫酸的烧杯中,反应的离子方程式是_______ 。
(2)将锌片、铜片按照图所示装置连接,能证明化学能转化为电能的实验现象是:铜片上有气泡产生、_______ 。
(3)稀硫酸在图所示装置中的作用是:传导离子、_______ 。
(4)下列反应通过原电池装置,可实现化学能直接转化为电能的是_______ (填序号)。
① 2H2 + O2 =2 H2O
② SO3+ H2O = H2SO4
③ Cu + 2Fe3+ =Cu2++ 2Fe2+

(1)将锌片放入盛有稀硫酸的烧杯中,反应的离子方程式是
(2)将锌片、铜片按照图所示装置连接,能证明化学能转化为电能的实验现象是:铜片上有气泡产生、
(3)稀硫酸在图所示装置中的作用是:传导离子、
(4)下列反应通过原电池装置,可实现化学能直接转化为电能的是
① 2H2 + O2 =2 H2O
② SO3+ H2O = H2SO4
③ Cu + 2Fe3+ =Cu2++ 2Fe2+
您最近一年使用:0次
2020-07-07更新
|
133次组卷
|
2卷引用:北京市延庆区2019-2020学年高一下学期期中考试化学试题




