名校
1 . 小组同学探究盐溶液对反应 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与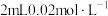 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
ii. (黄色)
(黄色)
iii.已知 对实验无影响
对实验无影响
下列说法不正确的是
 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与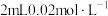 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。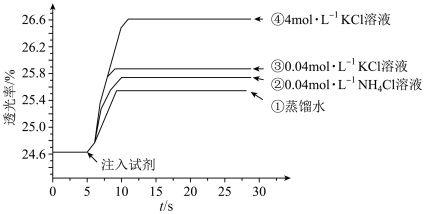
ii.
 (黄色)
(黄色)iii.已知
 对实验无影响
对实验无影响下列说法不正确的是
A.注入试剂①后溶液透光率增大,证明 逆向移动 逆向移动 |
B.透光率③比②高,可能是阳离子种类或溶液 不同导致的 不同导致的 |
C.透光率④比③高,可能发生了反应 |
D.若要证明试剂③中 对平衡体系有影响,还应使用 对平衡体系有影响,还应使用 的 的 溶液进行对照实验 溶液进行对照实验 |
您最近一年使用:0次
2023-11-21更新
|
366次组卷
|
7卷引用:黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期得分训练化学试卷(二)
名校
解题方法
2 . 某实验小组用如下实验测定海带预处理后所得溶液的碘含量,实验步骤及现象如下:
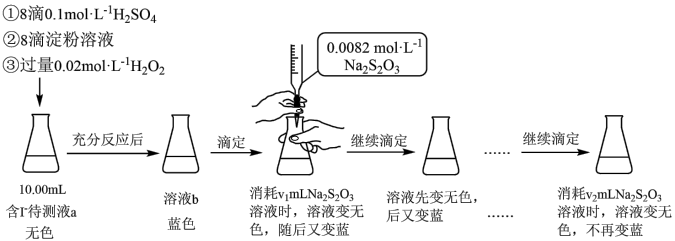
已知:I2+2Na2S2O3=2NaI+Na2S4O6,下列说法不正确 的是:

已知:I2+2Na2S2O3=2NaI+Na2S4O6,下列说法
| A.溶液b为蓝色是因为发生了反应:H2O2+2I-+2H+=I2+2H2O |
| B.该实验可证明蓝色恢复与空气无关 |
| C.溶液反复由无色变蓝的原因可能是H2O2氧化I-的反应速率比Na2S2O3还原I2的反应速率快 |
| D.上述实验不能准确测定待测液中的碘含量,应补充实验步骤:滴定前向溶液b中加少量MnO2,反应至不再产生气泡,过滤,对滤液进行滴定 |
您最近一年使用:0次
2023-11-06更新
|
1274次组卷
|
10卷引用:黑龙江省大庆实验中学实验三部2023-2024学年高三上学期阶段考试(二)化学试题
黑龙江省大庆实验中学实验三部2023-2024学年高三上学期阶段考试(二)化学试题北京市丰台区2023-2024学年高三上学期期中练习化学试题(已下线)选择题21-23(已下线)选择题11-14湖北省武昌实验中学2023-2024学年高三上学期12月月考化学试题北京实验学校2023-2024学年高三上学期12月化学学科竞赛试题内蒙古赤峰二中2023-2024学年高二上学期第二次月考化学试题湖南省长沙市长郡中学2023-2024学年高二上学期12月阶段性检测化学试题河北省保定市唐县第一中学2023-2024学年高二上学期1月期末化学试题河南省信阳高级中学2023-2024学年高二上学期元旦测试化学试题
名校
3 . 甲烷水蒸气催化重整是制备高纯氢的方法之一、反应如下:
反应i.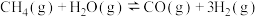
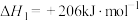 ;
;
反应ii.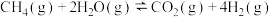
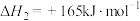 。
。
回答下列问题:
(1)反应iii. 的
的
________  ;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高CO2转化率的措施有
;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高CO2转化率的措施有________ ,下列说法可以证明该反应已达到平衡状态的是________ (填字母)。
a. b.容器内气体压强不再改变
b.容器内气体压强不再改变
c.H2的浓度不再改变 d.CO和H2O的浓度之比为1:1
(2)对于反应i,向体积为 的恒容密闭容器中,按
的恒容密闭容器中,按 投料。
投料。
①若在恒温条件下,反应达到平衡时CH4的转化率为50%,则平衡时容器内的压强与起始压强之比为___________ (最简单整数比)。
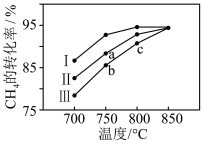
②其他条件相同时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,反应相同时间,CH4的转化率随反应温度的变化如图所示。a点___________ (填“是”或“不是”)化学平衡状态。
(3)某科研小组研究了反应ii的动力学,获得其速率方程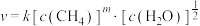 ,k为速率常数(只受温度影响),m为
,k为速率常数(只受温度影响),m为 的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
CH4的反应级数m=___________ ,当实验2进行到某时刻,测得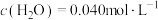 ,则此时的反应速率v=
,则此时的反应速率v=___________  (已知
(已知 )。
)。
(4)甲烷水蒸气催化重整制备高纯氢只发生反应i、反应ii.在恒温、恒压条件下,
 和
和
 反应达平衡时,
反应达平衡时, 的转化率为a,
的转化率为a, 的物质的量为
的物质的量为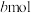 ,则反应i的平衡常数
,则反应i的平衡常数
___________ [写出含有a、b的计算式;对于反应 ,
,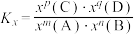 ,x为物质的量分数]。
,x为物质的量分数]。
反应i.
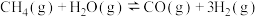
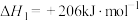 ;
;反应ii.
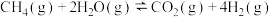
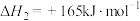 。
。回答下列问题:
(1)反应iii.
 的
的
 ;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高CO2转化率的措施有
;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高CO2转化率的措施有a.
 b.容器内气体压强不再改变
b.容器内气体压强不再改变c.H2的浓度不再改变 d.CO和H2O的浓度之比为1:1
(2)对于反应i,向体积为
 的恒容密闭容器中,按
的恒容密闭容器中,按 投料。
投料。①若在恒温条件下,反应达到平衡时CH4的转化率为50%,则平衡时容器内的压强与起始压强之比为
②其他条件相同时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,反应相同时间,CH4的转化率随反应温度的变化如图所示。a点

(3)某科研小组研究了反应ii的动力学,获得其速率方程
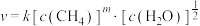 ,k为速率常数(只受温度影响),m为
,k为速率常数(只受温度影响),m为 的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:| 实验序号 |  |  |  |
| 1 | 0.100 | 0.100 |  |
| 2 | 0.100 | 0.200 |  |
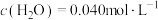 ,则此时的反应速率v=
,则此时的反应速率v= (已知
(已知 )。
)。(4)甲烷水蒸气催化重整制备高纯氢只发生反应i、反应ii.在恒温、恒压条件下,

 和
和
 反应达平衡时,
反应达平衡时, 的转化率为a,
的转化率为a, 的物质的量为
的物质的量为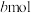 ,则反应i的平衡常数
,则反应i的平衡常数
 ,
,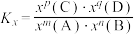 ,x为物质的量分数]。
,x为物质的量分数]。
您最近一年使用:0次
4 . 科学证明姜酮可以使人延年益寿,入伏吃姜效果最好,姜酮大量存在于姜皮中,其结构简式如图所示。下列说法错误的是
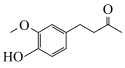
| A.分子中含有3种官能团 | B.能与FeCl3溶液发生显色反应 |
| C.苯环上一溴代物有2种 | D.1mol姜酮最多能与4molH2发生加成反应 |
您最近一年使用:0次
2023-09-24更新
|
61次组卷
|
2卷引用:黑龙江省哈尔滨市2023-2024学年高三上学期六校联考化学试题
2022高三·全国·专题练习
名校
5 . 下列说法错误的是
| A.碳酸钠可用于去除餐具的油污 |
| B.用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+ |
| C.Na2O2可与CO2反应放出氧气,可用于制作呼吸面具 |
| D.Na2O2在空气中放置后由淡黄色变为白色,反应的化学方程式为2Na2O2=2Na2O+O2↑ |
您最近一年使用:0次
名校
6 . “可燃冰”(甲烷的水合物)是一种清洁燃料,其开发利用是解决能源危机的重要课题。在一定条件下CH4(g)与H2O(g)可发生反应I:CH4(g)+H2O(g) CO(g)+3H2(g)△H1),已知表中数据:
CO(g)+3H2(g)△H1),已知表中数据:
(1)请写出反应I的热化学方程式:____ 。
利用上述反应制氢是目前制氢的常用方法,还包含反应II:CO(g)+H2O(g) CO2(g)+H2(g)△H2。分析I、II两个反应,回答下列问题:
CO2(g)+H2(g)△H2。分析I、II两个反应,回答下列问题:
(2)下列说法中能证明该反应体系已达到化学平衡状态的是____ (填字母)。
(3)不同温度下反应达到平衡时各物质的物质的量分数如图所示。

①根据图象解释温度高于T1时,CO2的物质的量分数随温度升高而下降的原因可能为____ 。
②T2℃时,容器中 =
=____ 。
(4)反应I与反应II的平衡常数的自然对数lnKp与温度的关系如图所示。

表示反应II的曲线是____ 。(填写“m”或“n”)
(5)某温度下,向恒压密闭容器中充入1molCH4和1molH2O(g),容器的总压强为100kPa,.反应达到平衡时,CO2的平衡分压p(CO2)=10kPa,H2体积百分含量为60%,则H2O(g)的转化率为____ ,该温度下反应IICO(g)+H2O(g) CO2(g)+H2(g)的平衡常数Kp=
CO2(g)+H2(g)的平衡常数Kp=____ 。
 CO(g)+3H2(g)△H1),已知表中数据:
CO(g)+3H2(g)△H1),已知表中数据:| 化学键 | C—H | H—O | C≡O | H—H |
| 键能(kJ/mol) | 413 | 463 | 1075 | 436 |
利用上述反应制氢是目前制氢的常用方法,还包含反应II:CO(g)+H2O(g)
 CO2(g)+H2(g)△H2。分析I、II两个反应,回答下列问题:
CO2(g)+H2(g)△H2。分析I、II两个反应,回答下列问题:(2)下列说法中能证明该反应体系已达到化学平衡状态的是
| A.恒温恒容,混合气体的密度不再发生变化 |
B.恒温恒容, = =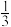 |
| C.恒容绝热,体系温度不再发生变化 |
| D.恒温恒容,气体平均相对分子质量不再改变 |

①根据图象解释温度高于T1时,CO2的物质的量分数随温度升高而下降的原因可能为
②T2℃时,容器中
 =
=(4)反应I与反应II的平衡常数的自然对数lnKp与温度的关系如图所示。

表示反应II的曲线是
(5)某温度下,向恒压密闭容器中充入1molCH4和1molH2O(g),容器的总压强为100kPa,.反应达到平衡时,CO2的平衡分压p(CO2)=10kPa,H2体积百分含量为60%,则H2O(g)的转化率为
 CO2(g)+H2(g)的平衡常数Kp=
CO2(g)+H2(g)的平衡常数Kp=
您最近一年使用:0次
名校
解题方法
7 . 溴及其化合物在生产中有广泛应用。工业上常用“吹出法”从海水中提溴,工艺流程示意图如下。
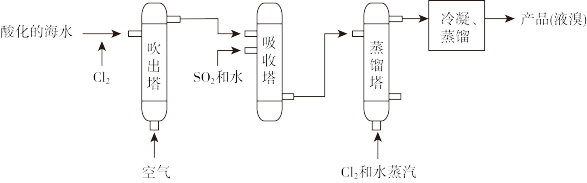
下列说法不正确 的是

下列说法
| A.“吹出法”主要包括氧化、吹出、吸收、蒸馏和冷凝等环节 |
| B.海水中Br- 经氧化、吹出、吸收后,可实现溴的富集 |
| C.该工艺流程可证明还原性:Br- >SO2>Cl- |
| D.“吸收塔”内也可用Na2CO3溶液吸收吹出的Br2 |
您最近一年使用:0次
2022-04-04更新
|
630次组卷
|
2卷引用:黑龙江省龙西北八校联合体2022-2023学年高三上学期开学考试化学试题
8 . 下列有关实验装置的说法中正确的是
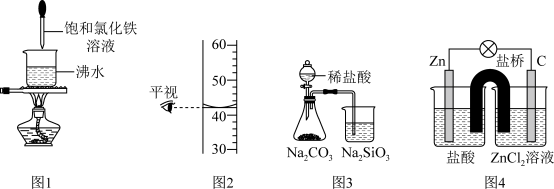

| A.用图1装置可以制备少量氢氧化铁胶体 |
B.图2装置中读取的数据为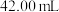 |
C.用图3可证明酸性强弱顺序为: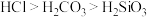 |
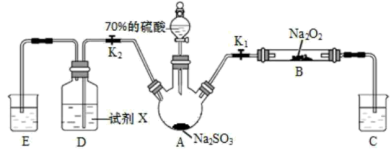
| D.用图4装置可以实现化学能持续转化为电能 |
您最近一年使用:0次
2022-03-07更新
|
257次组卷
|
2卷引用:黑龙江省海伦市第二中学2022-2023学年高三上学期期末考试化学试题
9 . 如图是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。下列有关说法正确的是

| A.为防止环境污染,装置C和E中的试剂均取用饱和的石灰水 |
| B.关闭K1,打开K2,试剂X是酸性KMnO4或FeCl3溶液,均可证明SO2有还原性 |
| C.实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性 |
| D.关闭K2,打开K1,滴加硫酸,则装置B中每消耗1molNa2O2,转移1mol电子 |
您最近一年使用:0次
2021-10-21更新
|
124次组卷
|
2卷引用:黑龙江省宾县第一中学校2021-2022学年高三上学期第一次月考化学试题
名校
解题方法
10 . 某研究性学习小组欲用下图所示的装置证明酸性:H2SO3>HClO。下列有关说法正确的是


| A.通过本实验可得出非金属性:S>Cl |
| B.可以去掉C、D装置,将从B中出来的气体直接通入E中,根据H2O+SO2+Ca(ClO)2=CaSO3↓+2HClO,若观察到有沉淀析出,则证明酸性:H2SO3>HClO |
| C.A中的酸不用浓硫酸的原因是浓硫酸与亚硫酸钠发生氧化还原反应,不能制得二氧化硫气体 |
| D.B中饱和NaHSO3溶液的作用是除去挥发的HCl气体 |
您最近一年使用:0次



